Рынок лекарственных средств является одной из наиболее динамично развивающихся отраслей мировой экономики. Основанием для данных выводов может служить постоянное расширение ассортимента фармацевтической продукции и рост объема мирового рынка, несмотря на небольшое падение в период начала пандемии коронавирусной инфекции.
По состоянию на конец 2020 г. (+2 % к 2019 г.) общий мировой фармацевтический рынок оценивался примерно в 1,27 трлн долл. США. Это значительный рост по сравнению с 2001 г., когда рынок оценивался всего в 390 млрд долл. США, в том числе с учетом влияния распространения новой коронавирусной инфекции COVID-19 (рис. 1) [1].
Ведущими фармпредприятиями мира по объемам продаж (в 2020 г.) стали такие компании, как Roche, Novatis, GlaxoSmithKline, Sandoz, Abbvie, J&J Pharmaceuticals, стоит заметить, что в продажах не учтены новые разработки в области вакцинации от коронавирусной инфекции, так как многие из них находятся в процессе испытаний [2].
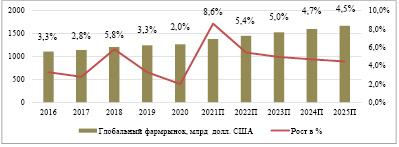
Рис. 1. Прогноз динамики глобального фармацевтического рынка, млрд долл. США [2]
Общие тенденции мирового фармацевтического рынка, безусловно, касаются не только развитых стран, но и развивающихся, в особенности если речь идет о региональных экономических интеграциях. Евразийский экономический союз может служить одним из наиболее интересных рынков для рассмотрения динамики, поиска наиболее перспективных направлений для развития общего рынка лекарственных средств.
Таким образом, цель данного исследования – провести анализ текущего состояния данного рынка, выявить проблемы для становления на пути свободного движения данных товаров, а также выработать рекомендации по дальнейшему развитию.
Анализ текущего состояния рынка лекарственных средств ЕАЭС
В Евразийском экономическом союзе (ЕАЭС, Союз) по итогам 2020 г. доля взаимной торговли лекарственными средствами (расфасованными для розничной продажи) составила 35,69 % в экспорте, всего 2,88 % в импорте и 10 % в обороте [3], что свидетельствует о перспективах данного рынка. Рынок ЕАЭС весьма интересен для Белоруссии и Казахстана, доли в экспорте данных товаров на рынок ЕАЭС которых составили 83,97 и 85,49 % соответственно. Экспорт из России в страны ЕАЭС за 2020 г. вырос на 32,7 % по сравнению с аналогичным периодом предыдущего года, а импорт сразу трех стран ЕАЭС данных товаров из России также показал рост (Армении в 2 раза, Казахстана – на 30,4 %, Киргизии – на 16 %), что может быть объяснимо с учетом развития в 2020 г. пандемии новой коронавирусной инфекции COVID-19.
Важно также отметить, что сохраняется высокая доля импорта данных товаров из третьих стран (97,12 % в целом по ЕАЭС), в особенности в Российской Федерации – 99,99 %, что говорит о потенциале развития кооперации и взаимной торговли лекарственными средствами.
Рассмотрим динамику взаимной торговли лекарственными средствами. Так, за годы функционирования Союза по итогам 2020 г. в сравнении с результатами 2015 г. у всех стран ЕАЭС вырос экспорт: например, экспорт Казахстана в страны ЕАЭС вырос в 6,67 раз, Армении в 2,26 раза, России – на 95 % (таблица).
Динамика торговли в ЕАЭС товарами по коду ТН ВЭД ЕАЭС 3004 «Лекарственные средства, расфасованные для розничной продажи» в 2014–2020 гг.
|
№ |
Страна |
2015 |
2020 |
%, 2020 г. к 2015 г. |
|
Экспорт в страны ЕАЭС |
||||
|
1 |
Армения |
2 420 110 |
5 482 057 |
+126 % |
|
2 |
Белоруссия |
115 629 566 |
238 364 272 |
+106 % |
|
3 |
Казахстан |
6 919 827 |
46 215 408 |
+568 % |
|
4 |
Киргизия |
150 692 |
181 004 |
+20 % |
|
5 |
Россия |
117 307 658 |
228 392 763 |
+95 % |
|
Всего |
242 427 853 |
290 242 741 |
+20 % |
|
Источник: составлено на основе [4]
Таким образом, данный рынок обладает значительными перспективами, в том числе развития с учетом промышленной кооперации, снятия препятствий для свободного движения товаров, в том числе в результате двустороннего сотрудничества стран в условиях пандемии COVID-19. Справедливо отметить, что кризис, вызванный распространением новой коронавирусной инфекции, меняет приоритеты государств, в том числе на данном рынке [4]. Несмотря на данные обстоятельства, отрасль имеет все шансы стать драйвером региональной фармацевтической индустрии [5].
Вместе с тем можно выделить специфические особенности, препятствующие развитию общего фармацевтического рынка ЕАЭС. Например, сходный ассортимент производимых лекарств, что порождает высокий уровень конкуренции в соответствующих рынках, неготовность делиться национальными полномочиями ведомств и организаций по экспертизе и регистрации лекарственных средств и др.
Регулирование общего рынка лекарственных средств в рамках ЕАЭС
В соответствии с Договором о ЕАЭС от 29 мая 2014 г. и соглашении о единых правилах обращения лекарственных средств в рамках ЕАЭС, общий рынок лекарственных средств существует с 1 января 2016 г. Целью создания указанного рынка стало обеспечение свободного обращения фармацевтических товаров, укрепление здоровья населения и повышение доступности безопасных и эффективных лекарственных средств.
Соглашением установлены переходные периоды, согласно которым переход на единую регистрацию должен был произойти 1 января 2021 г. с возможностью изменений регистрационных досье по законодательству стран ЕАЭС до конца 2025 г. До указанных дат действует переходный период, в течение которого осуществляется параллельная работа союзной и национальной систем регистрации.
В целях реализации соглашения органами ЕАЭС принят 71 нормативный акт в данной сфере. Нормативные акты охватывают различные аспекты «жизненного цикла» фармацевтической продукции – от ее разработки и изучения до производства и регистрации, а также контроля безопасности в процессе обращения.
По информации от Евразийской экономической комиссии акты права ЕАЭС в данной сфере разработаны на основе международных подходов [6]. Однако ряд авторов отмечают ряд различий между документами Европейского союза и ЕАЭС [7]. По их мнению, отдельные положения актов ЕАЭС в сфере лекарственных средств более совершенны, поскольку предусматривают положения, не учтенные в соответствующих национальных актах Европейского союза [8].
С декабря 2018 г. начата регистрация лекарств по единым правилам Союза, запущена единая информационная система [9], утверждена Фармакопея ЕАЭС (позволяющая признавать результаты контроля качества лекарств без их перепроверки). В настоящее время проводится активная работа по внедрению цифровой маркировки лекарственных средств в рамках ЕАЭС средствами идентификации [10].
Предусмотрена процедура приведения в соответствие новыми едиными правилами ЕАЭС регистрационных досье ранее выпущенных по национальным правилам препаратов, что, по мнению ряда авторов, позволит, в частности, пересмотреть ранее зарегистрированные лекарства на предмет их соответствия требованиям к качеству, безопасности и эффективности [11]. Переход всех лекарственных препаратов на наднациональную регистрацию планируется завершить до 2025 г. [12].
Отсутствие автоматического признания регистрации
Несмотря на предусмотренное Договором о ЕАЭС определение термина «единый (общий) рынок», согласно которому под ним понимается свобода перемещения (в том числе товаров), Решением Совета ЕЭК от 3 ноября 2016 г. № 78 утверждены Правила регистрации и экспертизы лекарственных средств для медицинского применения, которые установили процедуру, согласно которой зарегистрированная первый раз с прохождением всех процедур (в референтном государстве) продукция, должна в каждой следующей стране ЕАЭС каждый раз проходить процедуру признания (в государстве признания).
Тем самым государства вправе отказать в регистрации на территории своей страны, соответственно, не допустив такое лекарство на свой рынок, что не соответствует целям создания Союза и определению термина «общий рынок».
Однако до настоящего времени данная «децентрализованная» схема сохраняется. О том, что свободное обращение в странах «пятерки» не обеспечено, также свидетельствуют цифры. Так, по состоянию на 11 июля 2021 г. в Единый реестр зарегистрированных лекарственных средств Евразийского экономического союза [13] включено всего 388 торговых наименований лекарственных средств (рис. 2).
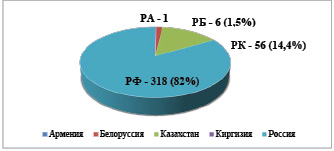
Рис. 2. Зарегистрированные по единым правилам ЕАЭС лекарственные средства по стране регистрации, ед., на 11.11.2021. Источник: составлено на основе [13]
Как видно на рис. 2, ни одного удостоверения не выдано органом Кыргызской Республики. Кроме того, выданные российским, армянским и белорусским органами удостоверения функционируют только на территориях указанных стран, и лишь в Казахстане орган принимал на регистрацию и регистрировал лекарственные средства для обращения одновременно в нескольких странах – 1 удостоверение для обращения в четырех странах ЕАЭС (кроме России), 1 – для обращения на территориях Казахстана и Белоруссии, 1 – для обращения на территориях Казахстана и Киргизии.
Для сравнения, в Реестре России по состоянию на 10 июля 2021 г. содержалось 18 902 зарегистрированных лекарственных препарата, в том числе, например, 41 препарат производства Казахстана, около 250 препаратов из Белоруссии, 2 препарата из Киргизии и 5 препаратов из Армении [14].
Таким образом, несмотря на заявленную дату запуска этого рынка с 1 января 2016 г., до настоящего времени регистрация по единым правилам значительным спросом не пользуется, то есть производители предпочитают регистрацию по национальным правилам. Кроме того, регистрация осуществляется преимущественно для обращения на территориях только одного государства – члена ЕАЭС, что не позволяет говорить об общем рынке и может свидетельствовать о препятствиях на внутреннем рынке ЕАЭС для их свободного обращения.
С другой стороны, для перехода к централизованной регистрации с автоматическим взаимным признанием регистрации возможны только два подхода:
1) единый наднациональный регистрирующий орган ЕАЭС, о возможности создания прототипа которого также высказывалось руководство ЕЭК [15]. Создание такого органа привело бы к потере части суверенитета государств и может быть не поддержано странами;
2) автоматическое безоговорочное признание регистрации, проведенной национальными органами. При данном подходе возникают вопросы недоверия стран друг к другу, несмотря на единые требования, правила и процедуры.
1. Одинаковые цены за регистрацию и признание регистрации в каждой стране
Принятие единых правил регистрации лекарств предполагало уменьшение процедур и затрат субъектов предпринимательства по доступу на рынки друг друга, посредством введения экспертизы в референтном государстве и последующим согласованием отчета, подготовленного по результатам данной экспертизы, в государствах признания.
Исходя из общей логики, в результате цены за такие процедуры, то есть цены за процедуру регистрации в референтном государстве и в каждом из государств признания, не должны быть на одном уровне. В ином случае потребуется в каждой стране Союза оплачивать за экспертизу сумму, равную сумме в референтном государстве. В результате нивелируется смысл общего рынка, поскольку до создания единого рынка также требовалось соответствующую сумму платить в каждом государстве.
В связи с чем в Решение Совета ЕЭК № 78 об утверждении единых правил регистрации включен пункт, которым поручалось государствам – членам Союза утвердить сборы с учетом сложности процедур, проводимых в референтном государстве и государстве признания.
Вместе с тем, например, в Российской Федерации установлены размеры государственной пошлины, равные за проведение экспертизы лекарственного препарата (325 000 руб.) и за оценку экспертного отчета (325 000 руб.).
Необходимо отметить, что затратность процедур, проводимых в референтном государстве, больше трудоемкости работ, проводимых в государстве признания, что прямо вытекает из единых правил регистрации, согласно которым в референтном государстве процедуры проводятся 210 дней, а в государстве признания – 90 дней. Так, в государстве признания не проводятся фармацевтическая инспекция и лабораторные испытания, которые проводятся в референтном государстве. В государстве признания также не составляется экспертный отчет.
Таким образом, при разной трудоемкости работ цены за регистрацию и признание регистрации устанавливаются одинаковые, несмотря на прямое поручение обеспечить учет трудоемкости. Указанные действия нивелируют преимущества единого рынка и могут быть одними из причин, по которым единый рынок так и не начал до настоящего времени полноценно функционировать.
2. Доступ к государственным закупкам и иные барьеры
Несмотря на создание общего рынка лекарственных средств, а также работы по обеспечению национального режима в государственных (муниципальных) закупках, до настоящего времени фактически прямой доступ к закупкам не обеспечен. Так, например, в Российской Федерации требуется учреждать юридическое лицо в стране поставки для получения лицензии на фармацевтическую деятельность, только после этого появляется право участвовать в соответствующих закупках.
Кроме того, сдерживающим фактором роста взаимной торговли лекарственными средствами можно назвать имеющиеся барьеры (нарушения Договора о ЕАЭС) для функционирования общего рынка. Так, например, в Белоруссии требуется иметь в аптеках всех форм собственности около 240 видов лекарственных средств именно белорусского или российского производства, отсутствие которых является грубым нарушением требований о лицензировании. Тем самым стимулируется закупка российских и белорусских фармацевтических препаратов, дискриминируя лекарства других стран ЕАЭС, что было признано Коллегией ЕЭК барьером для развития указанного рынка.
3. Проблемы по переходу на регистрацию ЕАЭС
Другим проблемным вопросом перехода на единые правила является получение по «союзным» правилам сертификатов GMP на производство. Так, изначально был установлен срок (до 1 января 2021 г.) по окончанию выдачи национальных сертификатов GMP и получении сертификатов GMP ЕАЭС для регистрации лекарственных средств, для чего необходимо было обеспечить проведение инспекций предприятий. Однако только Российская Федерация с 9 февраля 2021 г. перешла на оформление лекарственных средств российского производства по общим правилам ЕАЭС.
Причиной задержки процедуры прохождения сертификации в установленные сроки, по мнению производителей лекарственных средств стран – участниц ЕАЭС, стала пандемия COVID-19, из-за которой было невозможно проводить очные проверки в 2020–2021 гг., а также отсутствие у инспектирующего органа технической невозможности одновременно проверить более двух тысяч производственных площадок [16].
В результате переходный период был продлен до 1 января 2022 г. Однако и этого времени оказалось недостаточно.
В результате проведенного исследования установлено, что рынок лекарственных средств ЕАЭС находится на стадии формирования и обладает большим потенциалом перспективы развития.
Следует отметить, что в настоящее время проделана колоссальная работа по согласованию множества единых документов для создания наднационального регулирования обращения лекарственных средств на территории стран – участниц ЕАЭС [17].
Однако представляется целесообразным решение следующих задач для достижения более эффективного функционирования рынка медицинских изделий ЕАЭС:
− переход на взаимное признание зарегистрированных по единым требованиям и правилам лекарственных средств во всех государствах – членах ЕАЭС одновременно. Создание единой нормативной базы, которая позволит нивелировать препятствия для их свободного обращения, снизит издержки по регистрации, перерегистрации;
− проработка вопросов кооперации производителей государств – членов ЕАЭС для включения в «карту индустриализации» ЕАЭС, в том числе в формах совместных предприятий, последнее позволит, в частности, снизить расходы на исследования и компоненты, логистические издержки, снизить себестоимость фармпрепаратов и увеличить объем поставок;
− определение возможности создания совместных инструментов по возмещению затрат на расходы по регистрации, подтверждению соответствия, решению вопросов защиты интеллектуальной собственности;
− включение лекарственных средств в формируемый Комиссией перечень условий производственных и технологических операций при производстве промышленного товара государства – члена Союза в рамках Правил определения страны происхождения отдельных видов товаров для целей государственных (муниципальных) закупок, что будет являться стимулом взаимодействия поставщиков компонентов лекарств и их производителей в ЕАЭС и откроет рынок преференций в государственных (муниципальных) закупках стран ЕАЭС;
− решение вопросов в отношении взаимного признания лицензий на фармацевтическую деятельность, в том числе в сфере государственных (муниципальных) закупок, последнее позволит обеспечить прямой доступ на рынки;
− устранение имеющихся барьеров по поставкам лекарственных средств.
Библиографическая ссылка
Еликбаев К.Н., Дятлова М.И. ОБЩИЙ РЫНОК ЛЕКАРСТВЕННЫХ СРЕДСТВ ЕАЭС: АНАЛИЗ ТЕКУЩЕГО СОСТОЯНИЯ И ПРОБЛЕМ РАЗВИТИЯ // Фундаментальные исследования. 2022. № 3. С. 47-52;URL: https://fundamental-research.ru/ru/article/view?id=43213 (дата обращения: 14.02.2026).
DOI: https://doi.org/10.17513/fr.43213



