В последние годы наблюдается повышенный интерес к созданию новых экологически чистых безопасных ВВ различного назначения (подушки безопасности, горнодобывающая отрасль, противопожарная охрана и т.д.) [1]. Особого внимания в этом плане заслуживают нитраты и перхлораты азотистых соединений, например мочевины и диаминомочевины [2, 3], имеющие в своем составе высокое содержание кислорода и обладающие высокоэнергетическими свойствами, позволяющими использовать их в газогенерирующих композициях или как смесевые ВВ. Продолжающийся поиск новых малочувствительных, мощных и экологически безвредных, заместителей вторичных взрывчатых веществ, таких как гексоген, является актуальным, с одной стороны, и очень сложной задачей, с другой стороны. В то же время гетероциклические системы привлекают внимание химиков-синтетиков как потенциальные высокоэнергетические соединения, перспективные компоненты газогенерирующих топлив и композиционных взрывчатых веществ с высокой плотностью.
В этом аспекте представляет интерес недавно синтезированное соединение 2,3,4а,6,7,8а,9,10-октааза-4,8-диоксо-3,4,4a,7,8,8а,9,9a,10,10а-декагидроантрацен (соединение 1) полученный реакцией трициклизации бис(нитросемикарбазон)глиоксаля [4], и его аналог, содержащий в положениях 1 и 5 метильные радикалы [5].
Целью данной работы является исследование взаимодействия 2,3,4а,6,7,8а,9,10-октааза-4,8-диоксо-3,4,4a,7,8,8а,9,9a,10,10а-декагидроантрацена с азотной или хлорной кислотой с получением соответствующих солей и исследование свойств полученных образцов.
Материалы и методы исследования
Работа выполнена при использовании оборудования Бийского регионального центра коллективного пользования СО РАН (ИПХЭТ СО РАН, г. Бийск). Спектры ЯМР 1H и 13C образца зарегистрированы на «Bruker AV-400» с рабочей частотой 400,13 МГц для ядер 1H и соответственно 100,61 МГц для ядер 13С. В качестве стандарта были использованы сигналы растворителя ДМСО–d6: δ = 2,50 м.д. для остаточных протонов группы CHD2 в спектре 1H–ЯМР и δ = 39,51 м.д. для группы CD3 в спектрах 13С-ЯМР. УФ-спектры поглощения фиксировали на спектрофотометре «Cary 50» фирмы «Varian» в воде в кварцевых кюветах (l = 0,5) при 20 °С. ИК-спектры образца в KBr записывали на Фурье-спектрометре «ФТ-801» в области от 4000 до 500 см-1. Элементный состав определяли на элементном С, Н, N, О анализаторе «FlashEATM 1112». Измерение точки плавления проводили на столике VEB Analytik Dresden PHMK. Термический анализ проводился на термоанализаторах TGA/SDTA 851e и DSC 822e («Mettler Toledo», Швейцария) в диапазонах температур 25 °С 300 °С и 25 °С 500 °С со скоростью нагрева 10 °С/мин, в среде азота. Результаты оцифровывались и обрабатывались стандартным программным обеспечением термоаналитического комплекса «STAReSoftware 11.0».
Исходный 2,3,4а,6,7,8а,9,10-октааза-4,8-диоксо-3,4,4a,7,8,8а,9,9a,10,10а-декагидроантрацен (соединение 1) синтезировали по методике [4].
Динитрат 2,3,4а,6,7,8а,9,10-октааза-4,8-диоксо-3,4,4a,7,8,8а,9,9a,10,10а-декагидроантрацена (2). Навеску 0,5 г исходного соединения 1 растворяли в 12 мл 68 % растворе азотной кислоты при 0 °С. Реакционную массу выдерживали 1 ч при 0 °С. По окончании выдержки реакционную массу смешивали с 10 г льда. Выпавшие кристаллы отфильтровывали и сушили при комнатной температуре. Выход – 39 %, Тпл = 277 °С. ИК-спектр (KBr, см-1): 3243, 1693, 1526, 1418, 1385, 1276, 1132, 928, 731. Спектр ЯМР 1Н (ДМСО-D6), δ, м.д.: 5,15-5,16 д. (1H,СH), 6,69 д. (1H, НС=N), 10,33 с. (1Н,NH).
Диперхлорат 2,3,4а,6,7,8а,9,10-октааза-4,8-диоксо-3,4,4a,7,8,8а,9,9a,10,10а-декагидроантрацена (3). Навеску 0,5 г исходного соединения 1 растворяли в 9 мл 10 % хлорной кислоты при охлаждении до 0 °С и выдерживали при перемешивании и данной температуре в течение 1 ч. По окончании выдержки реакционную массу смешивали с 10 г льда. Выпавшие кристаллы отфильтровывали и сушили при комнатной температуре. Выход – 36 %, Тпл = 321 °С. ИК-спектр (KBr, см-1): 3318, 3187, 3065, 1690, 1644, 1599, 1532, 1438, 1282.4, 1206, 1106, 1067, 985, 936, 884, 830, 690, 656, 605. Спектр ЯМР 1Н (ДМСО-D6), δ, м.д.: 5,15-5,16 д. (1H,СH), 6,69 д. (1H, НС=N), 10,33 с. (1Н,NH).
Результаты исследования и их обсуждение
Соединение 1 представляет собой плоскую конденсированную систему, аналогичную восстановленному антрацену, содержащую два фрагмента замещенного гидразина, два фрагмента гидразона, два фрагмента этилена и две карбонильные группы. Состоит из трех шестичленных колец, из которых два – 1,2,4-триазиновые, а один – 1,2,4,5-тетразиновый [4]. Имеет две пары свободных протонов, находящихся у атомов азота в положении 3 и 7 (амидные) и 9, 10 (аминные), способных к взаимодействию с азотной (хлорной) кислотой с образованием соответствующих солей, ди- или тетранитрата (перхлората) (схема). В связи с тем, что основность амидного азота слишком мала, из-за влияния электроноакцепторной карбонильной группы, можно ожидать, что центром атаки азотной кислоты (хлорной) будут азоты (9, 10) центрального цикла. Для подтверждения этого предположения были проведены исследования по взаимодействию соединения 1 с азотной или хлорной кислотой различных концентраций с образованием соответствующих кислых солей 2-5.
Обработка соединения 1 эквимолярным количеством азотной кислоты с концентрацией от 6 до 24 % не приводит к получению соответствующего нитрата, во всех случаях, по данным ИК-спектроскопии, полученный осадок полностью соответствует исходному соединению 1. При использовании стандартной азотной кислоты с концентрацией 65–68 % удалось получить продукт реакции, ИК-спектр которого отличается от исходного характеристичной полосой поглощения на 1384 см-1, соответствующей колебаниям аниону NO3- (рис. 1). В ИК-спектре полученного нитрата отсутствуют валентные (n) и деформационные (d) колебания как свободной, так и связанной N-H группы, имеющуюся полосу поглощения на 3243 см-1 следует отнести к n (N – H) амида в ассоциированной форме, при этом полоса амид I, n (С=О) соответствует свободной форме, характеристичное валентное колебание которого находится на 1693 см-1. Полосы поглощения на 1526 см-1 и 1275 см-1 следует отнести к полосе амид II, d (N – H). Валентные (n) и деформационные (d) колебания СН связи проявляются соответственно на 3050 см-1 и на 1418 см-1.
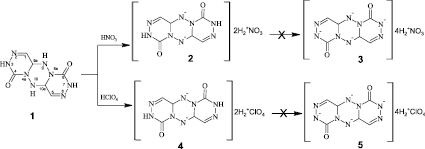
Образования кислых солей 2,3,4а,6,7,8а,9,10-октааза-4,8-диоксо-3,4,4a,7,8,8а,9,9a,10,10а-декагидроантрацена
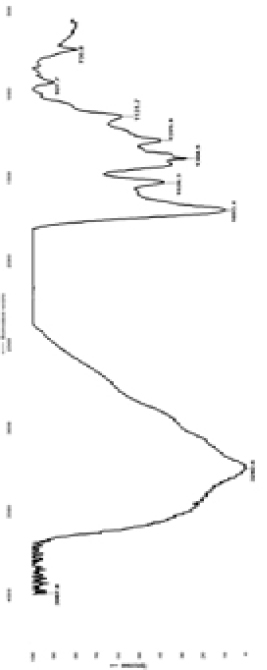
Рис. 1. ИК-Фурье спектр нитрата образца 1, снятый в КBr
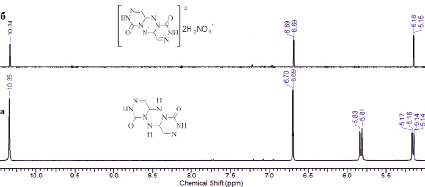
Рис. 2. Сравнение 1H ЯМР спектров соединения 1 (а) и соединения 2 (б) в ДМСО-D6
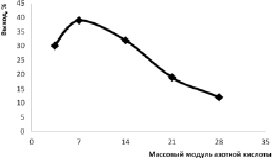
Рис. 3. Зависимости выхода соединения 2 от массового модуля кислоты при 0 °С
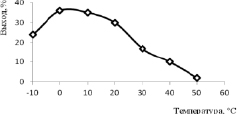
Рис.4. Зависимость выхода соединения 2 от температуры реакции
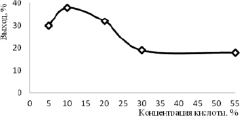
Рис. 5. Зависимость выхода соединения 4 от концентрации хлорной кислоты при 0 °С
Из рис. 2, где представлены спектры сравнения 1H ЯМР для исходного соединения 1 (а) и полученного нитрата (б), следует, что синтезированное соединение следует относить к динитрату соединения 1, то есть к соединению 2 (схема), так как в спектре (б) отсутствуют сигналы (дублет) на 5,81 м.д., относящиеся к протонам H-N центрального кольца (положение 9 и 10, схема, соединение 1), при этом сохраняется большинство сигналов исходного трициклического соединения, это синглетные протоны H-N при 10,36 м.д., дублет двойной связи метиновых протонов при 6,69 м.д., и дублет циклической С-Н связи при 5,15 м.д.
Таким образом, из приведенного 1H ЯМР спектра (б) следует, что в результате взаимодействия соединения 1 с азотной кислотой образуется дианион соединения 1 и протонированная азотная кислота, типа H2NO3+.
На рис. 3 представлена зависимость выхода соединения 2 от массового модуля кислоты. Максимальный выход соединения 2 достигается при модуле равном 7, дальнейшее повышение модуля приводит к разложению исходного соединения, что связано с образованием сильно кислой среды. Во всех экспериментальных опытах получение тетранитрата соединения 1 (соединение 3) не обнаружено.
Зависимость влияния температуры реакции на выход соединения 2 при массовом модуле кислоты равном 7 показана на рис. 4. Максимальный выход соединения 2 наблюдается при температуре 0 °С, дальнейшее повышение температуры реакции приводит к снижению выхода.
УФ-спектр чистого образца соединения 2, снятого в воде, выражен максимумом поглощения на 247 нм и наличием второго максимума поглощения на 204 нм.
Аналогичные исследования были проведены с использованием хлорной кислоты концентрацией от 5 % до 55 %, в результате выделен и идентифицирован диперхлорат 2,3,4a,6,7,8a,9,10-октааза-4,8-диоксо-3,4,4a,7,8,8a,9,9a,10,10a-декагидроантрацена, соединение 4.
Как видно из рис. 5, максимальный выход 39 % получен при использовании 10 % хлорной кислоты при охлаждении до 0 °С. Повышение концентрации отрицательно сказывается на выходе соединения 4, строение которого установлено по совокупности данных ИК- и ЯМР 1Н-спектроскопий.
В ИК-спектре соединения 4, сохраняются валентные (n) и деформационные (d) колебания N-H группы на 3319, 3187 см-1 и 1644 см-1 соответственно. При этом наблюдается незначительное смещение характеристичного валентного колебания амидного карбонила С=О группы в высокочастотную область на 1690 см-1 по сравнению с исходным соединением. Валентные (n) и деформационные (d) колебания С-Н связи проявляются соответственно на 3065 см-1 и 1438 см-1, а внеплоскостные на 690 см-1, 883 см-1 и 985 см-1, при этом наблюдается появление новых полос поглощения в области 1280–1100 см-1 (широкая полоса) и на 605 см-1, что подтверждает образование перхлората HClO4- и соответствует литературным данным [6].
Спектр ЯМР 1Н соединения 4 полностью совпадает со спектром соединения 2, как и УФ-спектр, что свидетельствует об аналогичности строения кислых солей 2 и 4.
Исследования методами термогравиметрического анализа (ТГА) и дифференциально-термического анализа (ДТГ) в политермическом режиме, в атмосфере азота при скорости нагрева 10 °С/мин показали хорошую термическую стабильность полученных соединений. Было установлено, что в интервале температур ≈ до 100 °С происходит потеря массы образцов в количестве от 4 % (соединение 4) до 10 % (соединение 2), сопровождающаяся эндотермическим эффектом, что, очевидно, связано с испарением гидратированной воды. В интервале 177–277 °С происходит значительная потеря массы, сопровождающаяся значительным экзотермическим эффектом. Результаты испытаний по методу ДТА и ТГА приведены в табл. 1, из которых видно, что разложение протекает в две стадии.
Таблица 1
Характеристики термического разложения соединений 2 и 4
|
Соединение |
Температура начала интенсивного разложения, °С |
Температура максимума интенсивного разложения, °С |
Температура конца процесса, °С |
Энергия активации, ккал/моль |
Потеря массы, % по ДТА |
|
|
2 |
пик I |
143,8 |
178,6 |
208,9 |
146 |
9,9 |
|
пик II |
269,8 |
276,9 |
284,2 |
398 |
52,1 |
|
|
4 |
пик I |
252,9 |
267,6 |
282,2 |
833 |
3,9 |
|
пик II |
297,1 |
321,3 |
349,6 |
166 |
60,0 |
|
Оценка чувствительности нитрата 2 по ГОСТ 4545-48 и ГОСТ Р 50835-95 показала, что вещество нечувствительно к удару и трению (табл. 2). При проведении испытаний наблюдалось изменение цвета образца и появление очагов термоокисления, а также образование дыма.
Таблица 2
Результаты испытаний по определению чувствительности
|
Соединение |
Чувствительность к удару на копре Каста (нижний предел, мм) при массе падающего груза Р = 10 кг и высоте Н = 250 мм |
Чувствительность к трению (нижний предел кгс/см2 (МПа)) при Руд = 2200 кгс•см–2 |
|
2 |
250 |
>10000 (981) |
Примечание. Нижний предел чувствительности к удару – минимальная высота падения груза, при которой хотя бы в одном из 25 опытов произошел взрыв. Нижний предел чувствительности к трению – максимальное давление прижатия навески бризантного взрывчатого вещества, находящегося между стальными плоскостями, при котором не происходит ни одного взрыва из 25 испытаний при ударном сдвиге одной плоскости относительно другой.
Выводы
Разработаны способы получения нитрата и перхлората 2, 3, 4а, 6, 7, 8а, 9, 10-октааза-4,8-диоксо-3,4,4а,7,8,8а,9,9а,10,10а-декагидроантрацена, путем взаимодействия с соответствующими неорганическими кислотами. Структура полученных соединений доказана совокупностью данных ЯМР 1H – и ИК-спектроскопий. Полученные нитрат 2 и перхлорат 4 стабильны, обладают повышенной термической стойкостью и перспективны в качестве безопасных ВВ.
Библиографическая ссылка
Глухачева В.С., Ильясов С.Г., Ермошина В.А. ИССЛЕДОВАНИЕ СОЛЕОБРАЗУЮЩЕЙ СПОСОБНОСТИ 2,3,4А,6,7,8А,9,10-ОКТААЗА-4,8-ДИОКСО-3,4,4A,7,8,8А,9,9A,10,10А-ДЕКАГИДРОАНТРАЦЕНА // Фундаментальные исследования. 2018. № 11-2. С. 137-142;URL: https://fundamental-research.ru/ru/article/view?id=42312 (дата обращения: 08.01.2026).
DOI: https://doi.org/10.17513/fr.42312



