В последнее время тема качества в фармацевтической отрасли стала остро обсуждаемой, наблюдается рост значимости качества фармацевтической продукции. Появилось много литературы, задача которой продемонстрировать особый характер взаимоотношений продукта и потребителей, медицины и пациентов. Возросла ответственность работников фармацевтических предприятий, так как при производстве препаратов используются системы чистых помещений. При грамотном проектировании и строительстве такие системы обеспечивают идеальные условия производства. Но, как показывает практика, в большинстве случаев нарушение условий изготовления препаратов допускается именно работниками предприятий [1]. Это указывает на наличие недостатков в системе менеджмента и системе управления качеством. Тем не менее правильно организованная система менеджмента качества является основополагающим фактором высокого профессионализма работников компании.
Цель исследования: изучение менеджмента качества фармацевтических предприятий, а также системы обеспечения качества в чистых помещениях, как основополагающих способов управления качеством на предприятии.
Материалы и методы исследования
В ходе исследования были проанализированы существующие системы менеджмента качества производства фармацевтических препаратов и перспективы дальнейшего развития этой системы с помощью абстрактно-логического метода и метода мониторинга условий и процессов на производстве.
Результаты исследования и их обсуждение
Система менеджмента была разработана Международной организацией по стандартизации (International Organization for Standardization), в которую входят представители из 164 стран мира. Данная организация содействует развитию стандартизации и смежной деятельности в мире, с целью обеспечения международного обмена товарами и услугами. Также в интересы организации входит развитие международного сотрудничества и поддержки экономики стран-членов, развитие их интеллектуальной и научно-технической деятельности. В данный момент в Международную организацию по стандартизации входят более 200 комитетов, занимающихся созданием стандартов ИСО.
Данные стандарты применимы на всех этапах реализации проекта фармацевтического предприятия, начиная от проектирования до эксплуатации. На последней стадии применяются стандарты управления работы персонала. Основой такой стандартизации послужила теория всеобщего управления качеством (TQM), именно она повлекла за собой разработку и систематизацию стандартов ISO серии 9000. В них систематизирован мировой опыт управления качеством через реализацию рациональных мероприятий менеджмента качества. Стандарты ИСО носят рекомендательный характер. Их приняли в качестве национальных стандартов более чем в 90 странах мира, в том числе и в Российской Федерации.
В Российской Федерации переводом, адаптацией и утверждением международных стандартов ISO занимается Росстандарт, как уполномоченный орган. Некоторые переведенные и адаптированные стандарты, соответствующие целям и принципам Федерального Закона № 184-ФЗ «О техническом регулировании», были утверждены как стандарты ГОСТ [2].
Система менеджмента производственной безопасности и охраны труда OHSAS 18001:1999 предусматривает мероприятия по сведению рисков к минимуму, постоянному контролю производства, а также предотвращению рисков и улучшению условий на рабочем месте. На данный момент систематическое и структурированное управление – лучший способ минимизации риска происшествий. Избежать происшествий также позволят неукоснительное соблюдение техники безопасности при работе на производстве и создание отдела по охране здоровья работников. Формируя такую систему охраны труда на предприятии, компания значительно повышает уровень безопасности работников и может страховать свой персонал на льготных условиях. Вышеописанные меры соответствуют требованиям стандарта SA 8000, которые подчеркивают высокую социальную ответственность предприятия и профессиональную этику. А эти факторы важны для формирования имиджа фармацевтической компании, привлечения квалифицированного персонала и благоприятного отношения потребителей.
В нынешнее высокотехнологическое время, когда инновационные продукты и технологии используются повсеместно, на первый план выходит информационная безопасность. Устранить угрозы и уладить недостатки системы информационной безопасности предприятия поможет стандарт ISO 27001 [3]. Соответствие данному стандарту обеспечит оптимальное управление информационными рисками, а также подтвердит надежность компании перед инвесторами и партнерами.
Подводя итоги вышесказанному, можно утверждать, что все системы менеджмента тесно взаимосвязаны. Так, выбирая один стандарт, предприятие заочно выполняет требования других. Сейчас для фармацевтических организаций наиболее актуально интегрировать такие системы менеджмента качества, как GMP, HACCP, ISO 9001:2000, а также системы экологического менеджмента ИСО 14001:2004. Помимо этого, на производстве необходима система контроля промышленной безопасности OHSAS 18001:1999 и принципов социальной ответственности SA 8000 [4]. На рисунке показана взаимосвязь интегрированных систем менеджмента.
В работу интегрированной системы менеджмента (ИСМ) входит разработка единой для предприятия системы, совмещающей менеджмент качества (СМК) и экологический менеджмент (СЭК) производственной безопасности. Такая объединенная система будет иметь:
- общую структуру планирования (политика, цели, планы);
- общую структуру процессов;
- общую структуру документации, с требованиями к управлению документами и записями;
- общие подходы к управлению персоналом;
- единые подходы к внутренним аудитам, выполнению корректирующих и предупреждающих действий;
- использование цикла управления РDСА (Plan – Do – Check – Action) [5].
Все интегрированные системы условно можно разделить на простые и сложные. Простые – это интегрированные системы менеджмента качества, сложные – системы менеджмента качества, которые интегрируются со стандартами другой сферы ответственности, например экологии, менеджмента безопасности труда, социальной ответственности и (или) информационной безопасности, менеджмента персонала.
Отдельное внимание стоит уделить менеджменту персонала, работающего в чистых помещениях (самый распространенный вид помещений на производстве лекарственных препаратов). Именно персонал играет ведущую роль в производстве фармацевтических препаратов – обеспечивает и поддерживает условия производства, необходимые для выпуска качественной продукции. Целесообразно ввести определение и классификацию чистых помещений, чтобы понимать, о каких именно помещениях идет речь и какую функцию они выполняют на производстве. Согласно ISO 14644-1-2002, чистое помещение – это помещение, в котором контролируется концентрация взвешенных в воздухе частиц, построенное и используемое так, чтобы свести к минимуму поступление, выделение и удержание частиц внутри помещения, и позволяющее, по мере необходимости, контролировать другие параметры, например температуру, влажность и давление.
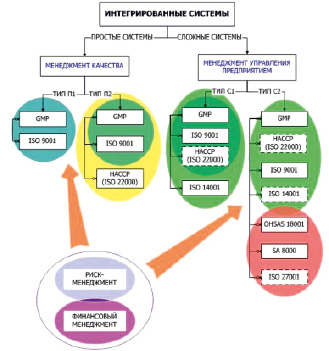
Взаимосвязи в построении систем менеджмента
Классификация чистых помещений по стандарту ИСО 14644-1
|
Класс чистоты |
Предельно допустимое число частиц в куб. м воздуха, размером равным и превышающим (мкм) |
|||||
|
0,1 |
0,2 |
0,3 |
0,5 |
1,0 |
5,0 |
|
|
ИСО 1 |
10 |
2 |
||||
|
ИСО 2 |
100 |
24 |
10 |
4 |
||
|
ИСО 3 |
1000 |
217 |
102 |
35 |
8 |
|
|
ИСО 4 |
10000 |
2370 |
1020 |
352 |
83 |
|
|
ИСО 5 |
100000 |
23700 |
10200 |
3520 |
832 |
29 |
|
ИСО 6 |
1000000 |
237000 |
102000 |
35200 |
8320 |
293 |
|
ИСО 7 |
352000 |
83200 |
2930 |
|||
|
ИСО 8 |
3252000 |
832000 |
29300 |
|||
|
ИСО 9 |
35200000 |
8320000 |
293000 |
|||
Чистые помещения на фармацевтическом производстве являются необходимостью, так как загрязнителями производственной среды могут выступать работники, оборудование, отделочные строительные материалы и т.д. Чистые помещения контролируют количество частиц в зоне производства препаратов, предъявляя строгие требования к оборудованию, используемым строительным материалам и личной и технической гигиене персонала, тем самым обеспечивая абсолютно «чистое» производство. Создание чистых помещений проходит в три этапа: проектирование и строительство, испытания, эксплуатация. При этом строительство и испытания являются самыми важными этапами. Испытания же необходимы, чтобы установить, соответствуют ли параметры чистых помещений техническим требованиям, заложенным в проекте, и будут ли эти требования выполняться в будущем. Когда чистое помещение готово к сдаче в эксплуатацию, перед руководством встает задача подбора персонала для работы в чистом помещении и разработки правил поведения, которых должен строго придерживаться персонал (включая техников по монтажу и обслуживанию оборудования) [6], находясь в чистом помещении. Необходимо отметить, что продукция, производимая в чистых помещениях, обладает различной чувствительностью к загрязнениям, и правила поведения в чистых помещениях должны это отражать.
Топ-менеджменту компании необходимо понимать и оценивать текущий (на момент проверки) уровень компетентности работников фармацевтического производства. При неудовлетворительном показателе следует подумать о привлечении консультантов иных предприятий отрасли. При систематической оценке компетентности следует предусмотреть меры обеспечения и поддержания психологической устойчивости работников. Длительность реорганизации менеджмента (особенно в тех случаях, когда она носит радикальный характер), а также ее результаты могут вызвать апатию, чувство усталости и раздражения, в иных случаях – разочарование работников фармацевтического предприятия. А это прямой путь к снижению работоспособности и пренебрежению техникой безопасности и требованиям к поведению в чистых помещениях, которые играют важнейшую роль в качестве производимой продукции. К мерам преодоления негативных психологических явлений на производстве можно отнести организацию совместного досуга, мероприятия по «тимбилдингу», разъяснительную работу в части причин, целей, характера, сроков и последствий создания интегрированной системы, обеспечение благоприятных стартовых условий для выполнения работ, мониторинг и регулярный анализ хода работ, информирование о его результатах всего персонала посредством прямых контактов с сотрудниками [7].
Повышенное внимание на фармацевтическом предприятии необходимо уделять обязательной предварительной подготовке работников производства, материалов и спецодежды перед началом работы в чистых помещениях. Под подготовкой понимается переодевание работников в спецкостюмы, прохождение стерилизации спецкостюмов и материалов, планируемых для использования, проверка состояния здоровья работника и физическое самочувствие. Ведь на производстве наблюдается повышенный фактор человеческой ошибки, несоблюдения правил эксплуатации помещения и правил поведения в чистых зонах. Иногда критическими для климата чистых помещений могут стать такие процессы, как несоблюдение личной гигиены или ненадлежащее место переодевания, хранения спецкостюмов, выход на рабочее место в больном виде, использование работником косметических средств.
Также всем работникам необходимо предварительно пройти обучение по работе в чистых помещениях. Учебные программы делятся на два уровня: для руководителей и для исполнителей. Для этих целей у предприятия должна иметься база подготовки специалистов как начального этапа, так и повторно-периодического [8].
Вернёмся же к интегрированным системам. При внедрении интегрированной системы необходимо первым делом удостовериться, что она заработала и стала стабильно функционировать. Если эти два пункта осуществлены, то следующим этапом следует внедрить систематичные самоинспекции (внутренние аудиты). Их назначение – проверка надлежащего выполнения условий и требований интегрированной системы, адаптированных рекомендаций ISO 19011, охватывающих всю деятельность такой системы. Такой подход обеспечит плавный переход от начала работы одной системы к началу внедрения следующей. Как показывает практика, такие переходы занимают у компании от полугода и больше. Система менеджмента никогда не может быть завершенной, а должна интегрировать в себя все новые задачи. Следовательно, она должна быть всегда открытой по отношению к новой задаче. Результат – устойчивость и развитие компании.
Выводы
В России уже введен ряд государственных стандартов по чистым помещениям (ГОСТ Р ИСО), представляющих собой идентичный перевод соответствующих международных стандартов ИСО. Введение норм на чистоту помещений на производстве фармацевтических препаратов, а также требований к подготовке и управлению персоналом соответствующих мировому уровню, является необходимой мерой. Принятие международных норм – объективный и необходимый процесс. Он полностью соответствует установке руководства страны по деятельности во Всемирной торговой организации (ВТО) и устранению технических барьеров. Он соответствует и интересам населения. Принятие современных норм на чистоты помещений на производстве и менеджмента персонала, а также следование им – одно из звеньев в этой работе.
Библиографическая ссылка
Гуров А.С., Нарежная Т.К. ОСОБЕННОСТИ СИСТЕМЫ МЕНЕДЖМЕНТА КАЧЕСТВА ОБЪЕКТОВ ФАРМАЦЕВТИЧЕСКОЙ ПРОМЫШЛЕННОСТИ // Фундаментальные исследования. 2018. № 9. С. 48-52;URL: https://fundamental-research.ru/ru/article/view?id=42261 (дата обращения: 21.12.2025).



