Наноструктуры на основе диоксида олова (SnO2) являются перспективными материалами, полупроводниками n-типа для различных приложений [1]. Электрохимические свойства и возможность легко регулировать микроструктурные характеристики дисперсного SnO2 делают его перспективным материалом для электрохимических источников тока, в частности твердополимерных топливных элементов (ТПТЭ) и литий-ионных аккумуляторов (ЛИА) [2, 3].
Наиболее распространенными методами получения диоксида олова являются золь-гель метод [4, 5], гидротермальный метод [6] и химическое осаждение из паровой фазы [7, 8]. Все эти методы предполагают применение высоких температур или вакуума, а также сложными пред- и/или постобработкой материала. Кроме того, большинство химических подходов к синтезу диоксида олова предполагают использование поверхностно-активных веществ (ПАВ) в качестве структурообразующих агентов и стабилизаторов [9]. При этом достаточно сложно удалить эти вещества из конечного продукта, что в дальнейшем негативно сказывается на его функциональных свойствах. Электрохимические подходы к получению дисперсных оксидов металлов, в частности диоксида олова, являются перспективными ввиду того, что позволяют избежать большинства проблем, перечисленных выше. Для электрохимических методов характерны высокий выход конечного продукта и сравнительно низкая стоимость процесса синтеза оксидов металлов по сравнению с химическими подходами.
Большинство электрохимических методов получения дисперсных оксидов металлов предполагают использование постоянного тока. Однако для получения диоксида олова в условиях постоянного тока к электродам необходимо приложить высокие потенциалы (20–40 В), а затем полученный диоксид олова должен быть отожжен на воздухе при 700 °С для получения кристаллической структуры оксида [10]. Использование синусоидального переменного тока может значительно интенсифицировать процесс образования диоксида олова, однако продукты, синтезированные в таких условиях, состоят не только из фазы SnO2, но также включают в себя фазы Sn2O3 и Sn3O4 в гидратированной, аморфной форме.
Применение импульсных режимов электролиза для синтеза наноструктурованных оксидов металлов позволяет проводить синтез при гораздо более низких потенциалах, сохраняя при этом высокие значения плотностей токов. Кроме того, известно, что скорость окисления и диспергирования металлов под действием импульсного переменного тока значительно выше, чем скорость анодного окисления металлов в условиях постоянного тока [11]. Явление ускорения коррозии металлов под действием переменного тока являлось предметом исследования еще в середине 20 В [12], а метод электрохимического диспергирования металлов был успешно применен нами для синтеза различных электродных материалов [13]. Отличительной особенностью данного метода является то, что синтезированные дисперсные оксиды металлов могут быть использованы as prepared, то есть они не требуют дополнительной постобработки (в частности, термической) для улучшения их функциональных свойств.
В данной работе мы применили метод электрохимического диспергирования и окисления металлов к получению дисперсного SnO2 и исследовали его свойства в составе анодных материалов ЛИА и ТПТЭ.
Материалы и методы исследования
Получение дисперсного SnO2 осуществляли по следующей методике: два оловянных электрода одинаковой геометрической площади помещали в раствор 2М NaCl. На электроды подавали переменный импульсный ток со средней плотностью 1 А/см2, под действием которого происходило окисление и диспергирование оловянных электродов в объеме электролита. Синтез вели при постоянном охлаждении и перемешивании электролита. По окончании синтеза суспензию фильтровали и многократно промывали дистиллированной водой. Полученный порошок SnO2 сушили при 80 °С до постоянной массы.
Синтез платиносодержащих катализаторов на основе гибридного носителя SnO2-C осуществляли по методике ранее описанной нами в [14]. Содержание диоксида олова в катализаторе составило 30 %, содержание платины – 25 %.
Рентгенофазовое исследование полученных материалов проводили с использованием ARL X’TRA Powder Diffractometer, Thermo Scientific, (CuKα, λ = 1,5418 Å). Данные рентгенофазового анализа регистрировались в диапазоне 2θ 20–100 град.
Микроскопические исследования дисперсного SnO2 и Pt/SnO2-C электрокатализатора проводили с использованием сканирующего электронного микроскопа Hitachi S-3400N и просвечивающего электронного микроскопа JEM-2100, JOEL.
Для исследования электрохимических характеристик SnO2 в качестве анодного материала ЛИА готовили электродную массу, состоящую из SnO2, углеродной сажи Super C65 (Timcal) и карбоксиметилцеллюлозы в качестве связующего компонента. Соотношение компонентов составляло 80:5:15 % соответственно. Полученную массу наносили на медную фольгу и сушили 12 часов при 120 °С под вакуумом. Масса диоксида олова на полученных электродах составила 2,5 мг/см2. Исследование электрохимических характеристик проводили методом циклической вольтамперометрии (ЦВА) с использованием электрохимической ячейки выполненной из политетрафторэтилена (ПТФЭ), вспомогательным электродом послужила литиевая фольга, электрод сравнения – хлорсеребряный, электролит 1М LiPF6.
Для исследования электрохимических характеристик Pt/SnO2-C материала в качестве анодного катализатора ТПТЭ готовили «каталитические чернила» и рабочие электроды по методике, представленной в [15]. Влияние диоксида олова на электрокаталитические свойства платиносодержащего катализатора исследовали на примере реакции электрохимического окисления этанола методом циклической вольтамперометрии.
Результаты исследования и их обсуждение
Электрохимическое поведение олова в электролитах с различным значением pH, таких как боратный буфер [16], бикарбонатный буфер [17], разбавленный раствор NaOH в присутствии галогенов [18] на сегодняшний день изучено достаточно широко. Но большинство этих исследований осуществлялось в электролитах с достаточно низкой концентрацией галогенов (0,01–0,1 моль/л). Однако проведение процесса электрохимического диспергирования металлов невозможно при таких низких значениях концентрации электролита ввиду высоких омических потерь при наложении потенциала на электроды. Поэтому мы исследовали вольтамперометрическое поведение оловянного электрода в водном растворе NaCl с концентрацией 2 моль/л и pH ≈ 7.
На рис. 1 представлены первые 10 ЦВА кривые оловянного электрода в 2M NaCl в интервале потенциалов –2,2 – 0 В. Как на анодном, так и на катодном ходе кривой наблюдаются различные пики, соответствующие формированию SnO, Sn(OH)2 и Sn(OH)4 [19]. Формирование оксидной пленки на поверхности оловянного электрода протекает в несколько стадий [17]:
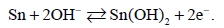 (1)
(1)
Пенка, сформированная в соответствии с уравнением (1), быстро окисляется до более стабильной фазы (уравнение 2):
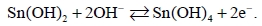 (2)
(2)
При более положительных потенциалах (выше –0,5 В) (рис. 1, область С) происходит прямое окисление Sn до Sn(IV) [17]:
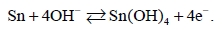 (3)
(3)
Который дегидрируется в соответствии с уравнением
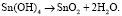 (4)
(4)
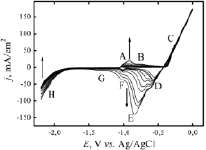
Рис. 1. ЦВА Sn электрода в 2M NaCl, скорость развертки потенциала 50 мВ/с
На катодном ходе кривой наблюдаются пики восстановления окисленной поверхности олова D, E, F, G, которые смещаются к более катодным потенциалам в ходе циклирования. Наличие таких пиков, соответствующих формированию и восстановлению разнообразных оксидов олова, уже наблюдалось в щелочных и хлоридных [18], карбонатных [17] буферных растворах с pH ≈ 7. Выделение водорода протекает с большим перенапряжением, при потенциалах ниже –1,7 В (рис. 1, область H), что согласуется с результатами [17], где было показано, что выделение водорода на Sn/SnO протекает при потенциале –1,6 В. Таким образом, образовавшиеся на поверхности олова оксидные пленки не восстанавливаются полностью в катодный период и механически удаляются с поверхности оловянного электрода за счет интенсивного выделения водорода. В присутствии Cl- ионов при высоких анодных потенциалах может наблюдаться образование растворимых хлоридных комплексов [Sn(OH)4Cl2]2- [18], что в результате может привести к наличию небольшого количества хлора в конечном продукте.
Таким образом, на основе результатов циклической вольтамперометрии можно предположить, что для получения дисперсного SnO2 с применением переменного импульсного тока должны соблюдаться следующие условия:
1) во время анодного импульса потенциалы электрода должны достигать не менее +2 В для полного окисления олова, минуя образование Sn(OH)2 и Sn(OH)4 фаз;
2) во время паузы потенциал электрода должен быть не ниже –0,5 В, чтобы избежать восстановления сформировавшихся оксидов;
3) интенсивное выделение водорода для удаления оксидной пленки с поверхности электрода.
Рентгеноструктурные исследования показали, что результатом электрохимического диспергирования оловянных электродов под действием переменного импульсного тока является образование диоксида олова типичной тетрагональной структуры (пространственная группа P42/mnm (no. 136)) (рис. 2, а) с размером частиц порядка 15 нм (рис. 2, б).
Для рентгенограммы Pt/SnO2-C катализатора (рис. 2, в) характерно наличие ярко выраженных рефлексов платины. Интенсивность пиков SnO2 при этом значительно ниже. Размер наночастиц платины в полученном катализаторе порядка 10 нм (рис. 2, г).
Как известно, диоксид олова является сокатализатором платины в реакции электрохимического окисления этанола [2]. На рис. 3, а, показана ЦВА Pt/SnO2-C катализатора, полученного методом электрохимического диспергирования в сравнении с Pt/C катализатором. Установлено, что введение диоксида олова в состав платинового катализатора не приводит к общему увеличению скорости окисления этанола, однако потенциал начала окисления этанола на Pt/SnO2-C катализаторе сдвинут в катодную область потенциалов почти на 200 мВ, что свидетельствует о значительном снижении перенапряжения реакции окисления этанола.
Способность внедрения лития в SnO2 материал определяет его пригодность в качестве электродного материала литий-ионного аккумулятора. На рис. 3, б, представлены ЦВА SnO2 в 1M LiPF6, на анодном ходе которых видны пики, характерные для образования различных фаз сплавов, таких как Li7Sn2, Li7Sn3, Li13Sn5 и Li22Sn5 [20], что свидетельствует о возможности применения полученного методом электрохимического диспергирования SnO2 в качестве анодного материала ЛИА.
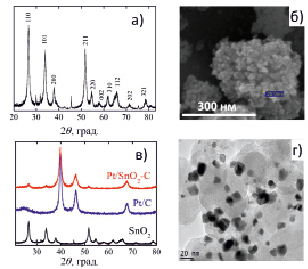
Рис. 2. Рентгенограммы синтезированного SnO2 (a) и Pt/SnO2-C катализатора (в), СЭМ-изображение дисперсного SnO2 (б) и ПЭМ-изображение Pt/SnO2-C катализатора (г)
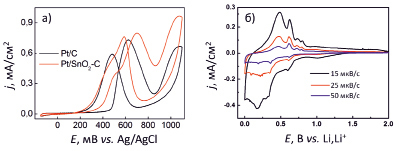
Рис. 3. ЦВА Pt/C и Pt/SnO2-C катализаторов в 0,5 M H2SO4 + 0,5 M C2H5OH, скорость развертки потенциала 5 мВ/с (а); ЦВА SnO2 материала в 1M LiPF6 при различной скорости развертки потенциала (б)
Заключение
Таким образом, электрохимическое окисление и диспергирование оловянных электродов под действием переменного импульсного тока позволяет получать кристаллический диоксид олова, который проявляет хорошие электрокаталитические свойства и способность к интеркаляции лития, что делает его перспективным электродным материалом для твердополимерных топливных элементов и литий-ионных аккумуляторов.
Работа выполнена при финансовой поддержке Российского научного фонда (проект 14-23-00078).
Исследования выполнены с использованием лабораторного оборудования Центра коллективного пользования «Нанотехнологии» Южно-Российского государственного политехнического университета имени М.И. Платова.
Библиографическая ссылка
Смирнова Н.В., Куриганова А.Б., Фаддеев Н.А., Пудова Л.С., Ульянкина А.А. ЭЛЕКТРОДНЫЕ МАТЕРИАЛЫ НА ОСНОВЕ ДИОКСИДА ОЛОВА ДЛЯ ЭЛЕКТРОХИМИЧЕСКИХ ПРИЛОЖЕНИЙ // Фундаментальные исследования. 2017. № 12-2. С. 323-327;URL: https://fundamental-research.ru/ru/article/view?id=42023 (дата обращения: 12.03.2026).
DOI: https://doi.org/10.17513/fr.42023



