Гипохлорит натрия относится к новому поколению реагентов, используемых для обеззараживания воды в качестве альтернативы газообразному хлору. Применяется или товарный (технический) гипохлорит (ТГ), представляющий собой высококонцентрированный сильнощелочной раствор, производимый на химических заводах и содержащий 14 % активного хлора, или низкоконцентрированный раствор (ЭГ), производящийся на месте использования в необходимом количестве путем электролиза хлорида натрия (метод электрохлорирования). Из-за высокой концентрации товарный гипохлорит разлагается быстрее получаемого непосредственно на месте в электролизере ЭГ. Это разложение гипохлорита до хлората приводит как к потере продукта, так и к возникновению нежелательного побочного продукта, попадающего в воду. В случае 14 % ТГ 0,6 % активного хлора преобразуется в хлорат уже в течение первых суток хранения при 22 °C [1], так что при транспортировке и хранении его может накопиться значительное количество. Производство ЭГ на месте потребления по мере необходимости сокращает срок его хранения перед использованием и резко снижает потери. ТГ имеет высокое значение водородного показателя (pH = 12) для обеспечения стабильности продукта. Поэтому при обеззараживании воды с высоким содержанием катионов кальция и магния («жесткая вода») возможно образование нерастворимых карбонатов и гидроксидов, для удаления которых необходима фильтрация воды перед использованием. Водородный показатель растворов ЭГ не превышает 9,5 и подобной проблемы не возникает, однако при приготовлении раствора для электрохлорирования все же лучше использовать дистиллированную или умягченную воду. Это позволяет сократить расходы на периодическую чистку электродов. Кроме того, в [2, с. 852] показано, что в присутствии карбонат- и сульфат-анионов выход по току электрохлорирования снижается, причем тем сильнее, чем выше плотность тока. Для обеззараживания технологической воды вместо исходного раствора хлорида натрия может использоваться морская вода, при этом поверхность электродов покрывается более рыхлым слоем солей, чем при использовании неумягчённой воды [3]. Наконец, ТГ содержит потенциально канцерогенный бромат, концентрация которого не должна превышать в странах ЕС 10 мкг/л. ЭГ с низким содержанием бромата может быть получен благодаря использованию хлорида натрия с низким содержанием бромида. Эти факторы обеспечивают все более широкое применение систем электрохлорирования вместо установок дозирования технического гипохлорита.
Целью исследования являлось установление оптимальных параметров электрохлорирования для установки небольшой мощности, предназначенной для использования в бытовых условиях.
Материалы и методы исследования
Оптимизацию параметров электрохлорирования выполняли на установке со стеклянным реактором объёмом 1 л, содержащим четыре биполярных вертикально расположенных прямоугольных титановых электрода, с окисно-рутениевыми анодами, каждый площадью 60 см2. Зазор между электродами устанавливали одинаковым по всей длине и изменяли с помощью двух горизонтальных изолирующих проставок толщиной 1, 2 или 3 мм. Для дополнительного к газлифту перемешивания реакционной смеси использовали магнитную мешалку, расположенную на дне электролитической ячейки. В качестве источника тока использовали потенциостат-гальваностат Elins Р-150Х. Реактор эксплуатировали либо в проточном либо в непроточном режиме. Раствор хлорида натрия готовили из дистиллированной воды и хлорида натрия категории «х.ч.». В проточном режиме подачу осуществляли с помощью перистальтического насоса Zalimp peristaltic pump Type PP1-05. Концентрацию активного хлора определяли по ГОСТ Р 50551-93 [4] и ГОСТ 18190-72 [5], содержание газообразного хлора в отходящих газах по ГОСТ 6718-93 [6]. Проводимость растворов измеряли кондуктометром HI 9033 фирмы Hanna Ins.
Результаты исследования и их обсуждение
Под «активным хлором» для раствора гипохлорита, как и хлорноватистой кислоты, понимают весь хлор, выделяющийся при воздействии на раствор избытка соляной кислоты:
NaClO + HCl → Cl2↑ + NaCl,
HClO + HCl → Cl2↑ + H2O.
Наряду с определением концентрации активного хлора иодометрическим методом по ГОСТ Р 50551-93, было проведено определение концентрации титрованием метиловым оранжевым по ГОСТ 18190-72 с 25-кратным разбавлением 10 мл аликвоты. Методика с метиловым оранжевым менее трудоёмка и показала хорошее совпадение результатов для полученных разбавленных растворов гипохлорита натрия.
При концентрациях менее 1 % гипохлорит натрия классифицируется как неопасный реагент, являясь в то же время эффективным дезинфектантом, поэтому для использования в быту и снижения опасности для персонала были выбраны параметры электрохлорирования, обеспечивающие его концентрацию от 0,2 % до 0,8 %. При таких малых концентрациях NaClO и невысоких значениях pH выход по току гипохлорита натрия максимален из-за минимального протекания побочных процессов электрохимического окисления гипохлорита и химического образования хлората натрия. Следовательно, при таких концентрациях в готовом гипохлорите практически отсутствует хлорат. Зависимость выхода по току «активного хлора» от плотности тока имеет максимум в области от 0,1 до 0,2 А/см2, повышение концентрации хлорида натрия вплоть до 10 г/л увеличивает выход по току, при дальнейшем увеличении концентрации он возрастает незначительно [7]. После сравнения результатов при плотности тока 0,1; 0,125; 0,15 А/см2 нами было выбрано значение 0,1 А/см2 как позволяющее использовать менее мощный и, следовательно, более дешевый источник тока, при приемлемой продолжительности процесса.
Наиболее опасным побочным продуктом электрохлорирования хлорида натрия является газообразный хлор. Было изучено влияние величины межэлектродного расстояния на содержание хлора в отходящих газах при плотности тока 0,1 А/см2. Установлено, что оптимальным является межэлектродное расстояние в 1 мм. При его увеличении до 2 и 3 мм, содержание хлора в отходящих газах возрастает. С другой стороны, увеличение концентрации хлорида натрия более 35 г/л при выбранной плотности тока и межэлектродном расстоянии в 1 мм вызывает существенное возрастание побочных процессов электрохимического восстановления гипохлорита натрия, находящегося в прямой зависимости от интенсивности перемешивания:
ClO- + H2O + 2e- → Cl- + 2 OH-.
В ячейке электролизера на аноде образуется хлор, на катоде разлагается вода с образованием водорода и гидроксил-ионов.
2Cl-- 2e- → Cl2,
2H2O + 2e- → H2 + 2OH-.
Одновременно с этими процессами на аноде может происходить разряд гидроксильных ионов или разложение воды c выделением кислорода. Конструкция электролизера в виде открытого реактора вызывает интенсивное перемешивание электролита в зоне, прилегающей к электродам, при этом выделяющийся хлор растворяется в электролите и подвергается диспропорционированию с образованием малодиссоциирующей хлорноватистой кислоты и хлороводородной кислоты:
Cl2 + 2H2O ↔ HClO + HCl.
Получающиеся в результате восстановления воды гидроксил-ионы нейтрализуют эти кислоты, образуя гипохлорит и хлорид натрия:
HClO + HСl + 2OH- → Cl- + ClO- .
Суммарное уравнение электролиза:
Cl- + H2O → H2 + ClO-.
При выборе оптимальной температуры процесса необходимо учитывать, что окисно-рутениевый анод наиболее устойчив в агрессивной среде хлоратора при температурах не ниже 18 °С [8]. С другой стороны, чрезмерный разогрев электролита неблагоприятно сказывается на выходе гипохлорита натрия, поэтому оптимальная температура составляет 40–45 °С [9, 10]. Для проточного электролизера температура электролита тем выше, чем меньше расход и, следовательно, больше время пребывания электролита в реакторе. Также разогрев электролита, при прочих одинаковых условиях, больше там, где ниже исходная концентрация хлорида натрия. Опытным путем установлено, что в широком диапазоне расходов от 0,8 до 6,0 л/ч при использовании исходного раствора с температурой не более 20 °С превышения оптимальной температуры не происходит. Водородный показатель растворов в процессе электролиза увеличивается до величин pH = 8,8÷9,4 по мере увеличения времени электролиза и роста концентрации соли из-за восстановления молекул воды. Из рис. 1 видно, что соотношение между содержанием гипохлорит-иона и хлорноватистой кислоты определяется протеканием реакций гидролиза гипохлорита натрия и диссоциации хлорноватистой кислоты и при pH = 9,4 происходит практически полный переход хлорноватистой кислоты в гипохлорит натрия.
Расход, обеспечивающий достижение концентрации активного хлора 0,2 %, при плотности тока I = 0,1A/см2 составляет от 6 до 7,5 л/ч в зависимости от концентрации хлорида. Для достижения более высокой концентрации активного хлора 0,4 % необходимо снижение расхода до 2,5÷2,7 л/ч [12]. Проводимость растворов в процессе электрохлорирования меняется незначительно в пределах 3÷5 % от исходной.
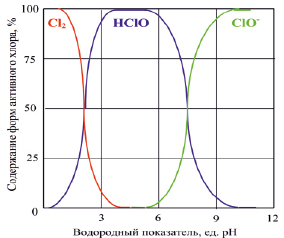
Рис. 1. Соотношение содержания форм активного хлора в воде при различных значениях водородного показателя [11]
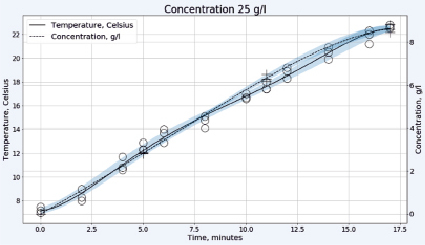
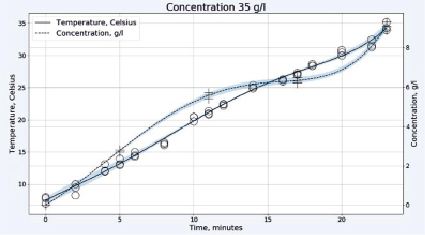
Рис. 2. Зависимость температуры в градусах Цельсия (левая шкала, круги) и концентрации активного хлора в г/л (правая шкала, кресты) от времени электрохлорирования в непроточной ячейке для плотности тока 0,1 А/см2 и концентрации исходного раствора хлорида натрия 25 г/л (верхний рисунок) или 35 г/л (нижний рисунок)
Для обеззараживания относительно небольших объемов воды, например в индивидуальных домовладениях, выгоднее использовать более дешёвые установки непроточного типа. Предварительное охлаждение раствора хлорида натрия до 7÷9 °C позволяет в этом случае обойтись без водяного охлаждения электролизера. На рис. 2 представлены результаты работы электролизера в таком режиме.
При относительно небольшой концентрации хлорида натрия 25 г/л, как видно на рис. 2, происходит практически линейный рост концентрации «активного хлора» в растворе, что свидетельствует о незначительном протекании побочных реакций. Температура возрастает также линейно и во всем диапазоне концентраций остается ниже допустимых значений с учетом возможности локального перегрева реакционной смеси в межэлектродном пространстве. На рис. 2 внизу представлен вид тех же зависимостей при более высокой концентрации хлорида натрия в растворе 35 г/л. От начала электролиза и вплоть до 12 минут концентрация «активного хлора» возрастает практически линейно, при этом темп его накопления превышает характерный для более низкой концентрации NaCl. Затем, на участке от 12 до 17 минут, температура реакционной смеси продолжает линейно возрастать, но концентрация «активного хлора» увеличивается значительно медленнее. Разогрев раствора оказывается выше на 10 °C, а та же концентрация «активного хлора» достигается на 6 минут позже, чем для раствора меньшей концентрации. Это может быть связано с потерей части газообразного хлора из-за активного газовыделения и локальных перегревов, приводящих к протеканию побочных процессов электрохимического окисления гипохлорита:
6ClO- + 3H2O – 6e- → 2ClO3- + 4 Cl- + 1,5O2 + 6H+
и химического образования хлората:
2HClO + ClO- → ClO3- + 2Cl- + 2H+.
Этот эффект может быть преодолен снижением концентрации хлорида натрия или увеличением межэлектродного расстояния, но последнее нежелательно из-за увеличения содержания газообразного хлора в отходящих газах.
Выводы
Использование непроточной ячейки с межэлектродным расстоянием 1 мм между четырьмя биполярными параллельными титановыми электродами прямоугольной формы с окисно-рутениевыми анодами при плотности тока 0,1 А/см2 и концентрации исходного раствора хлорида натрия 25 г/л позволяет обеспечить удобную эксплуатацию хлоратора в режиме линейной зависимости концентрации активного хлора от времени электрохлорирования. В готовом изделии такая зависимость позволяет указать требуемую концентрацию активного хлора на таймере. Показано, что в предлагаемом режиме улучшается воспроизводимость результатов и уменьшается разогрев раствора в процессе электрохлорирования. Ту же самую ячейку можно использовать в проточном режиме с расходом 2,5÷2,7 л/ч для получения продукта с 0,4 % активного хлора или с расходом 6÷7,5 л/ч для продукта с концентрацией активного хлора 0,2 %. Низкая щелочность продукта (pH = 8,8÷9) позволяет использовать полученный раствор гипохлорита для обеззараживания даже жёсткой воды без риска образования осадка.
Библиографическая ссылка
Богословский С.Ю., Болдырев В.С., Кузнецов Н.Н., Астапов К.Р. ОПТИМИЗАЦИЯ ПРОЦЕССА ЭЛЕКТРОЛИТИЧЕСКОГО ПОЛУЧЕНИЯ ГИПОХЛОРИТА НАТРИЯ ДЛЯ ОБЕЗЗАРАЖИВАНИЯ ВОДЫ // Фундаментальные исследования. 2017. № 11-1. С. 30-34;URL: https://fundamental-research.ru/ru/article/view?id=41893 (дата обращения: 12.03.2026).



