В последние годы интерес к нанодисперсным порошковым материалам сильно возрос. В работах [19, 15] показано, что по ряду физических свойств наноструктурные материалы значительно превосходят обычные крупнозернистые материалы. Особый интерес вызывает керамика на основе магний-алюминиевой шпинели, нашедшая широкое применение в металлургии, радиотехнике, химическом производстве, а также рассматривается перспектива использования и в ядерной энергетике [6]. Данный керамический материал обладает достаточной механической прочностью, хорошей коррозионной и радиационной стойкостью [5, 3] и применяется в качестве инертной матрицы в ядерном топливе [6], а также для иммобилизации радиоактивных отходов как инертная матрица композиции Синрок.
Одним из решений проблемы поиска альтернативного сырья для получения продуктов в химической и нефтехимической отраслях промышленности может стать вовлечение в переработку природного газа [9]. Метан с высокой эффективностью может быть превращен в метанол через синтез-газ [10, 17]. Последующая конверсия метанола в углеводороды бензинового ряда требует применения мезопористых цеолитных катализаторов пентасилового типа [10, 16]. В последние годы разрабатываются различные процессы получения низших олефинов и ароматических углеводородов на основе природного газа через метанол. Установлено, что наиболее эффективными катализаторами процесса прямого превращения метанола в ароматические углеводороды являются цеолиты типа ZSM-5, содержащие модификаторы P, B, Mg, La и Zr, введенные в цеолит методом пропитки растворами соответствующих солей [4]. Традиционный способ получения таких каталитических систем путем пропитки цеолитов растворами солей с последующим термическим разложением или окислением, как правило, не приводит к образованию высокодисперсных активных фаз. В этом отношении более предпочтительно получение каталитических систем механическим смещением нанопорошков соответствующих металлов или их оксидов с мезопористыми материалами.
Цель исследования
Цель настоящей работы – синтез нанопорошков состава CexMg1-xAl2O4 шпинельной структуры, изучение их физико-химических и каталитических свойств в композиции с высококремнеземным цеолитом типа НZSM5 в превращении метанола в n-ксилол.
Материалы и методы исследования
Согласно общепринятой методике для синтеза магний-алюминиевой шпинели используют химически чистые порошки MgO и Al2O3 [8, 11]. Синтез проводят твердофазной реакцией в интервале температур 1100–1600 °С [8, 9, 12, 14, 15].
В настоящей работе нанопорошки шпинельной структуры получали методом низкотемпературного горения [2, 13]. Исходными реактивами для синтеза являлись реактивы марки «ХЧ»: -алюминий азотнокислый 9-водный Al(NO3)3 9H2O, магний азотнокислый 6-водный Mg(NO3)2 6H2O, церий карбонат (III) Се2(CO3)3, диэтилмалонат C7H12O4, гидразин моногидрат NH2NH2 H2O, спирт абсолютный C2H5OH с плотностью 0,7895 г/см3, азотная кислота HNO3 с концентрацией 65 % и плотностью 1,41 г/см3.
Предшественником являлась высушенная смесь комплексных соединений магния и алюминия с гидразидами малоновой кислоты. При синтезе предшественника применяли свежеприготовленную дигидразид малоновую кислоту, полученную при перемешивании диэтилмалоната с гидразин моногидратом в мольных соотношениях 1:2. Процесс протекает по химической реакции
2 (1 – x) Mg(NO3)2· 6 H2O + Al(NO3)3·9H2O + 5 C3H8 N4O2 + 2x Се (NO3)3 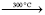
2 СеxMg1-x Al2O4 + 15 H2O + 13 CO2 + 20 N2
с использованием азотнокислых солей алюминия и магния. Раствор азотнокислого церия получен растворением карбоната церия (III) в концентрированной HNO3 при комнатной температуре. Се(NO3)3 получали по реакции
Се2(CO3)3 + 6HNO3 > 2Се(NO3)3 + 3 H2O + 3CO2.
После прекращения выделения CO2 раствор концентрировали до определенной кондиции выпариванием при 60–80 °С. Затем полученные растворы смешивали таким образом, чтобы мольные соотношения соответствовали Се: Mg: Al = x:(1-х):2 (где х – мольная доля церия), чтобы конечный состав соединения соответствовал СехMg(1-х)Al2О4. Нами синтезированы составы, где х = 0,03; 0,05; 0,10 и нелегированная шпинель MgAl2O4.
Катализаторы были приготовлены при сухом смешивании нанопорошка CeхMg(1-х) Al2О4 с Н-формой цеолита типа HZSM-5 в механической вибрационной мельнице на воздухе с последующей обработкой приготовленной смеси при 550 °С в течение 3-х часов. Концентрация нанопорошка в катализаторе варьировалась от 1,0 до 10,0 мас. %. Н-форму цеолита HZSM-5 с мольным соотношением SiO2/Al2O3 равным 33 готовили согласно процедуре, описанной в [4].
Опыты проводили на установке проточного типа со стационарным слоем катализатора объемом 4 см3 в реакторе идеального вытеснения при атмосферном давлении в интервале температур 350–400 °С. Объемная скорость подачи 2 ч-1. Длительность опыта составляла 1,0 ч. В качестве исходного реагента использовали метанол с чистотой 99,8 % (производство AzMeCo, г. Баку).
Кислотные свойства цеолитов изучали методом термодесорбции аммиака [17], адсорбционные исследования были выполнены по методике, описанной в работе [17, 18].
Результаты исследования и их обсуждение
Термогравиметрическим методом определен характер протекания процесса разложения и горения сухого остатка после выпаривания свободной воды. Для исследования выбирали образец, соответствующий конечному составу. Результаты анализа представлены в виде кривых на рис. 1. Наклон кривых соответствует интенсивности выделения испаряющихся веществ. По наклону кривую можно разделить на три участка: 120÷210, 210÷500 и 500–800 °С. На первом участке потеря веса составляет до 22 % от первоначального веса образца, на втором участке потеря веса составляет около 43 %, а на третьем – около 20 %. На первом участке выделяются воды (адсорбированные и координационные), на втором газы и некоторые легколетучие органические молекулы образующихся при разложении комплексных соединений.
На кривой ДТА появляются три эндотермических эффекта при 100, 150 и 200 °С при выделении воды. Эти эффекты отсутствуют при 100 °С или малозаметны при 150 и 200 °С на кривой процесса ДТА (рис. 1).
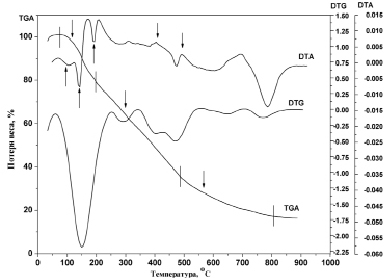
Рис. 1. Кривые термогравиметрического анализа (ТГ, ДТГ и ДТА) процесса получения Ce0,10Mg0,90Al2O4
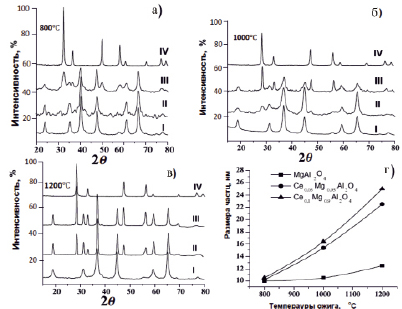
Рис. 2. Дифрактограммы составов MgAl2O4, Ce0,10Mg0,90Al2O4 и Ce0,05Mg0,95Al2O4
На II участке наблюдаются три четких эндотермических эффекта. Наличие соединений церия усиливает эндоэффекты при 300 и 460 °С. Экзоэффекты на кривой при 310 и 390°С, по-видимому, связаны с горением органической части предшественника с выделением газов. Эндотермические эффекты при 460 °С на кривых ДТА и DTГ связаны с процессом разложения и выделения некоторых органических частей оставшихся субстратами. Природа этого процесса не ясна. Рентгенограмма образца, снятого до и после этого эффекта, не дает никаких результатов, в обоих случаях вещества аморфны. Предполагается, что выше 460 °С в субстрате остаются оксипроизводные металлов или же аморфные карбонаты. Последняя версия более приемлема, так как 460 °С достаточно высокая температура и при такой температуре в открытых условиях ничего не должно оставаться в составе.
Рентгенографическим путем доказано, что на третьем этапе происходит формирование шпинельной фазы, т.к. в нагретых до 700 °С и очищенных образцах, отожжённых при этой температуре в течение 2 часов наблюдается образование зародышей кристаллической фазы. Следует отметить, что температура начала эндотермического эффекта (на кривой ДТА) соответствует 700 °С. Наличие потери веса на этом участке дает основание говорить о том, что процесс образования шпинелей сопровождается выделенным СО2 за счет разложения твердых растворов карбонатов [1, 7].
Проведен рентгенофазовый анализ термически обработанных при 800, 1000 и 1200 °С в течение 2 часов шпинельных фаз, с содержащих участием церия. Дифрактограммы составов MgAl2O4, Ce0,10Mg0,90Al2O4 и Ce0,05Mg0,95Al2O4 приведены на рис. 2.
Следует отметить, что они термодинамически более устойчивы, чем другие окисные соединения металла. Поэтому при разложении цериевых комплексов (в данном случае комплекса церия с дигидразидом малоновой кислоты) в открытой системе вероятность образования CeO2 больше других. Если при синтезе церий полностью внедряется в решетку магний-алюминовой шпинели, замещая ионы магния в узлах решетки, то на дифрактограммах вышеуказанных легированных кристаллов не появляются иные рефлексы, кроме рефлексов шпинельной фазы. В противном случае возможно появление дифракционных рентгенорефлексов CeO2 фазы [1, 7]. Как видно, на дифрактограммах вновь синтезированных и отожженных кристаллов кроме рентгенорефлексов шпинельных структур имеются и рентгенорефлексы CeO2 фазы, причем последние достаточно четко наблюдаются во всех случаях. Термическая обработка при 1200 °С в течение 2 часов не приводила к растворению CeO2 в матрице шпинельной фазы. Однако присутствие фазы CeO2 влияет на процесс спекания, с ростом содержания CeO2 увеличиваются размеры наночастиц (табл. 1).
Таблица 1
Размер термически обработанных наночастиц
|
Состав фазы |
Размер частиц (нм), при температурах |
||
|
800 °С |
1000 °С |
1200 °С |
|
|
MgAl2O4 |
9,95 |
10,50 |
12,50 |
|
Се0,05 Mg0,95Al2O4 |
10,20 |
15,40 |
22,50 |
|
Се0,1 Mg0,9Al2O4 |
10,50 |
16,40 |
25,00 |
|
СеO2 |
20,50 |
32,00 |
33,43 |
Таблица 2
Значения полос пропускания в ИК-спектрах для CexMg1-xAl2O4
|
Состав фазы |
Тем. термич. обработки, Т, °С |
Предполагаемые группы |
|||
|
-ОН |
О–Н |
N=O |
Me–O |
||
|
Се0.05Mg0.95Al2O4 |
300 |
3418 |
1643 |
1404 |
650–548–482 |
|
1000 |
3437 |
1639 |
1400 |
683–509–417 |
|
|
Се0.1Mg0.9Al2O4 |
300 |
3456 |
1636 |
1385–850 |
675–421 |
|
400 |
3449 |
1632 |
1412–849 |
683–455 |
|
|
500 |
3441 |
1632 |
1416–849 |
675–475–421 |
|
|
600 |
3437 |
1636 |
1416 |
675–471–409 |
|
|
800 |
3452 |
1639 |
1462 |
698–525 |
|
|
1000 |
3441 |
1639 |
1396 |
683–505–420 |
|
Инфракрасные спектры (ИК) сняты в диапазоне частот 400–4000 см-1. В ИК-спектрах обнаруженные полосы пропускания при 3437–3456 см-1 и 1632–1639 см-1 относятся к адсорбированной воде и поверхностно гидроксильным группам или кристаллической воде соответственно. Полосы пропускания при 850–1385–1462 см-1 могут быть отнесены к колебаниям 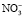 или NOx. Интенсивность этих полос пропускания постепенно уменьшается с повышением температуры отжига. Обнаруженные полосы пропускания в ИК-спектрах для термически обработанных образцов CexMg1-xAl2O4 приведены в табл. 2.
или NOx. Интенсивность этих полос пропускания постепенно уменьшается с повышением температуры отжига. Обнаруженные полосы пропускания в ИК-спектрах для термически обработанных образцов CexMg1-xAl2O4 приведены в табл. 2.
Растяжение полос, отмеченное в пределах 698–525 и 683–505–420 cм-1, соответствует AlO6 и MgO4 группам в шпинельной решетки. Эти полосы поглощения появляются в порошках отожженных при 800 °С и 1000 °С соответственно. Они подтверждают формирование MgAl2O4 шпинели с октаэдрическими и тетраэдрическими полиэдрами [1, 7]. Спектры поглощения в УФ и видимой области спектра представлены на рис. 3. Все образцы плохо поглощают свет с длинами волн больше 500 нм, т.е. в видимой части спектра они сильно поглощают цветные материалы. Это характерно для большинства оксидов металлов с жесткой связью Ме–О и большой шириной запрещенной зоны (как у MgAl2O4).
Поглощение видимого света может возникнуть в результате наблюдаемого поглощения, вызванного переходом заряда O2- > Al3+. Как известно, край собственного поглощения чистого магния алюминиевой шпинели в зависимости от размера наночастиц соответствует длинам волн 330–360 нм. С увеличением содержания CеO2 в составе приготовленных порошков край собственного поглощения смещается в более длинноволновую область, при этом соответственно меняются значения ширины запрещенной зоны. Ширина запрещенной зоны определяется по краю поглощения, который меняется для MgAl2O4 в пределах от 3,76 до 2,95 эВ, для Ce0,05Mg0,95Al2О4 от 2,95 до 2,61 эВ и для Ce0,1Mg0,9Al2О4 от 2,82 до 2.43 эВ. Таким образом, значения ширины запрещенной зоны наночастиц зависят от размеров и способа приготовления образцов [3, 19].
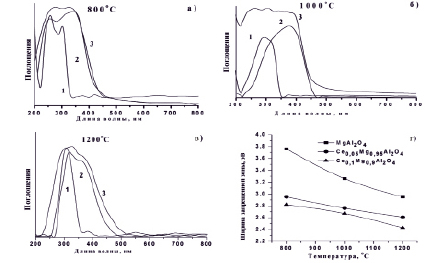
Рис. 3. Спектры поглощения (а, б, в и г), зависимость ширины запрещенной зоны от температуры термически обработанных образцов MgAl2O4 (1), Ce0,05Mg0,95Al2O4 (2) и Ce0,Mg0,90Al2O4 (3) при различных температурах отжига
Согласно [10], превращение метанола на цеолитсодержащих катализаторах идет по схеме:
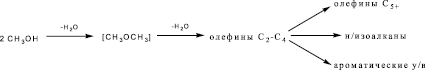
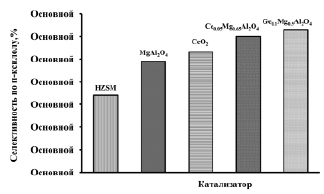
Рис. 4. Влияние природы модификатора на селективность образования п-ксилола из метанола. Содержание модификатора 1,0 мас. % (Т = 400 °С, v = 2 ч-1). Примечание. *Селективность по п-ксилолу, % – отношение содержания п-ксилола к общему содержанию ксилолов
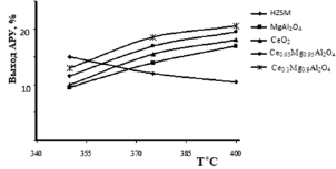
Рис. 5. Влияние природы модификатора на выход ароматических углеводородов (АРУ) в зависимости от температуры
В интервале температур 350–400 °С степень конверсии метанола составляет 100 % как на Н-форме цеолита, так и на модифицированных образцах. Основными продуктами превращения метанола являются олефиновые углеводороды С2-С4 (30–40 %), алифатические углеводороды С5+ (15–25 %) и ароматические углеводороды С6-С10 (25–40 %). Выход ароматических углеводородов С6-С18 зависит от природы и концентрации модифицирующего металла (рис. 4 и 5).
Как видно из рис. 4, модифицирование Н-ZSM-5 нанопорошками CeO2, СeхMgAl2O4 и СeхMg1-хAl2O4 приводит к изменению каталитических свойств катализаторов. Введение 1,0 мас. % модификаторов в состав Н-ZSM-5 способствует повышению селективности по п-ксилолу. При содержании 1,0 мас. % модификаторов в составе Н-ZSM-5 селективность по п-ксилолу по сравнению с Н-ZSM-5 возрастает с 34 % до 63 %.
При модифицировании НZSM-5 модификаторами селективность катализатора по п-ксилолу (рис. 4) и выход ароматических углеводородов (рис. 5) возрастает в следующей последовательности
HZSM-5 < MgAl2O4 < CeO2 <
< Ce0.05Mg0.95Al2O4 < Ce0.1Mg0.9Al2O4.
Среди исследуемых образцов наиболее высокую селективность по п-ксилолу проявляет образец, модифицированный нанопорошком Сe0.1Mg0.9Al2O4.
На рис. 6 представлено влияние концентрации нанопорошка Сe0.1Mg0.9Al2O4 в составе НZSM-5 на выход ксилолов и селективность по п-ксилолу. Видно, что на НZSM-5 при 400 °С выход ароматических углеводородов составляет 10,1 мас. %, а селективность по п-ксилолу – 34,0 %. Введение 1,0 мас. % модификатора в состав НZSM-5 приводит к увеличению выхода ксилолов с 10,1 % до 20,2 % а селективности по п-ксилолу с 34,0 до 63,0 %. Увеличение содержания модификатора до 10,0 мас. % в составе НZSM-5 приводит к заметному снижению выхода ксилолов (с 20,2 до13,2 %), но существенно повышает селективность по п-ксилолу (с 63,0 до 80,5 %). Оптимальное содержание нанопорошка Ce0.1Mg0.9Al2O4, в составе НZSM-5 при котором наблюдаются хорошие выходы ксилолов (17,0 мас. %) и высокая селективность по п-ксилолу (75,0 %), соответствует 5,0 мас. %.
По-видимому, проявление высокой селективности по п-ксилолу на композиции Ce0.1Mg0.9Al2O4, с НZSM-5 содержащем, обусловлено уменьшением силы бренстедовских кислотных центров [4], а также изменением адсорбционно-десорбционных и диффузионных характеристик катализаторов [4]. Действительно, модифицирование сопровождается химическим взаимодействием модификатора с цеолитом, что приводит к воздействию модификатора на доступность каналов структуры цеолитных катализаторов. Это подтверждается уменьшением сорбционной емкости образцов с увеличением содержания в их составе нанопорошка Ce0.1Mg0.9Al2O4 (табл. 3).
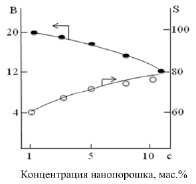
Рис. 6. Влияние концентрации нанопорошка Ce0.1Mg0.9Al2O4 в композиции с НZSM-5 на выход ксилолов (В, мас. %) и селективность по п-ксилолу (S, мас. %) (T = 400 °C, P = 1 атм, v = 1,0 ч-1)
Таблица 3
Адсорбция паров воды н-гептана и бензола на ZSM-5, модифицированным нанопорошком Ce0.1Mg0.9Al2O4
|
№ образца |
Содержание Ce0.1Mg0.9Al2O4 в цеолите, мас. % |
Адсорбция, см3 г-1 |
||
|
вода |
н-гептан |
бензол |
||
|
1 |
0 |
0,078 |
0,167 |
0,080 |
|
2 |
1 |
0,073 |
0,156 |
0,071 |
|
3 |
3 |
0,063 |
0,130 |
0,062 |
|
4 |
5 |
0,054 |
0,086 |
0,051 |
|
5 |
10 |
0,048 |
0,069 |
0,043 |
Из данных табл. 2 видно, что HZSM-5 имеет две формы десорбции аммиака: низкотемпературную форму I десорбции аммиака с температурой максимума Тмакс пика 200 °С и высокотемпературную форму II с Тмакс пика 4180С, концентрации кислотных центров составляют 630 и 554 мкмоль·г-1 соответственно.
Таблица 4
Кислотные свойства катализаторов
|
№ образца |
Тмакс, С |
Концентрация кислотных центров, мкмоль·г-1 |
||
|
форма I |
форма II |
форма I |
форма II |
|
|
1 |
200 |
418 |
630 |
554 |
|
2 |
194 |
368 |
400 |
301 |
|
3 |
187 |
316 |
282 |
171 |
|
4 |
178 |
283 |
182 |
104 |
|
5 |
172 |
261 |
121 |
49 |
Введение нанопорошка Ce0.1Mg0.9Al2O4 в количестве 1,0 мас. % в состав HZSM-5 снижает концентрацию сильных кислотных центров с 554 мкмоль·г-1 до 301 мкмоль·г-1, т.е. почти в 1,8 раза. При повышении содержания циркония в цеолите до 5,0 мас. % происходит резкое снижение концентрации кислотных центров катализатора: уменьшение концентрации кислотных центров нанопорошка Ce0.1Mg0.9Al2O4 более чем в 4,5 раза и смещение низкотемпературного и высокотемпературного пиков десорбции аммиака соответственно до 178 и 283 °С. Увеличение содержания в цеолите до 10,0 мас. % сопровождается дальнейшим уменьшением силы и концентрации кислотных центров. При этом наиболее резкому снижению подвергаются сильные кислотные центры. Концентрация сильных кислотных центров на цеолите, содержащем 10,0 % нанопорошка Ce0.1Mg0.9Al2O4, минимальна и составляет всего 49 мкмоль·г-1 (табл 4).
Таким образом, модифицированные нанопорошками Сe0.1Mg0.9Al2O4, цеолиты типа HZSM-5 являются активными катализаторами синтеза ксилолов из метанола при атмосферном давлении. Путем модифицирования HZSM-5 нанопорошком Ce0.1Mg0.9Al2O4 в количестве 5,0 мас. % получен катализатор обладающий повышенной пара-селективностью (75 %). Повышение пара-селективности катализатора связано c уменьшением концентрации сильных кислотных центров и адсорбционной емкости цеолитов. Нанопорошки состава Се0.05Mg0.95Al2O4, и Се0.1Mg0.9Al2O4 прошедшие термическую обработку при 800–1000 °С в композиции с НZSM-5 можно использовать в качестве катализаторов для получении п-ксилола из ненефтяного сырья- метанола.
Выводы
1. Синтезированы наноразмерные кристаллики порошков состава MgAl2O4, Се0.05Mg0.95Al2O4, Се0.1Mg0.9Al2O4.
2. С помощью дериватографического и рентгенографического анализов установлено, что температура горения металлокомплексных композиций происходит при 350 °С, а кристаллизация начинается с 700 °С.
3. Изучено влияние нанопорошков шпинельной фазы CexMg1-xAl2O4 на физико-химические и каталитические свойства цеолита типа НZSM-5 в превращении метанола в ароматические углеводороды.
4. Нанопорошки состава Се0.05Mg0.95Al2O4 и Се0.1Mg0.9Al2O4 прошедшие термическую обработку при 800–1000 °С в композиции с НZSM-5 можно использовать в качестве катализаторов при получении п-ксилола из ненефтяного сырья- метанола.
Библиографическая ссылка
Махмудова Н.И., Вердиева Л.Р., Ильяслы Т.М., Бабаева Т.А., Мамедов С.Э. СИНТЕЗ НАНОЧАСТИЦ CEXMG1-XAL2O4 И ИССЛЕДОВАНИЕ ИХ ФИЗИКО-ХИМИЧЕСКИХ И КАТАЛИТИЧЕСКИХ СВОЙСТВ В КОМПОЗИЦИИ С ЦЕОЛИТОМ ZSM-5 В ПРЕВРАЩЕНИИ МЕТАНОЛА В П-КСИЛОЛ // Фундаментальные исследования. 2017. № 10-3. С. 483-491;URL: https://fundamental-research.ru/ru/article/view?id=41862 (дата обращения: 15.02.2026).



