Сложные оксидные системы со структурой шпинели на основе катионов переходных элементов обладают уникальным комплексом свойств, важных для технического использования. В частности, применение хромита меди (II) CuCr2O4 связано с его разнообразными каталитическими свойствами [2, 5], феррит никеля (II) NiFe2O4 относится к магнитомягким материалам с умеренной намагниченностью, низкой проводимостью и высокой магнитной проницаемостью [6], может быть использован как высокочувствительный сенсор при низких температурах эксплуатации [9], как электрод при восстановлении оксидов азота [10]. Синтез твердых растворов на основе феррита никеля (II) и хромита меди (II) может позволить получить материал с набором новых свойств – электрических, магнитных, каталитических.
Ранее для системы NiFe2O4–CuCr2O4–NiCr2O4 было показано [3, 4] существование морфотропных областей, содержащих при комнатной температуре несколько шпинелеподобных фаз. Наличие в образце нескольких шпинельных фаз может привести к получению материала с необычными свойствами, связанными с наличием межкристаллитных дефектных прослоек.
В настоящее время особую остроту приобретают вопросы повышения экологической безопасности производств. В частности, до сих пор не решена проблема очистки сточных вод, содержащих катионы тяжелых металлов. Катионы кадмия относятся к ядам кумулятивного действия, поэтому разработка новых материалов, обладающих высокой поглощающей способностью по катионам кадмия, является актуальной технологической задачей. В этой связи целью исследования являлось изучение процессов формирования структуры в системе 0,3NiO–0,7CuO–0,3Fe2O3–0,7Cr2O3 и ее свойств в процессах адсорбции катионов кадмия из водных растворов.
Материалы и методы исследования
Для приготовления образцов были использованы оксиды NiO, CuO, Fe2O3, Cr2O3 квалификации хч. Фазовый состав изучали с помощью РФА, использовали Cu-Kα излучение. Уточнение структуры фаз, входящих в образцы, проводили по рефлексам 220, 311 для фазы кубической шпинели, 312 и 321 для фазы тетрагональной шпинели, 006 и 012 для хромита меди (I). Фотографии образцов были получены на сканирующем электронном микроскопе, изотермы физической адсорбции азота на аппарате Quantachrome Autosorb 1c. Определение площади поверхности проводили, используя уравнение ВЕТ (p/p0 = 0,05–0,2).
Эксперимент по изучению поглощающей способности шпинелей проводили при комнатной температуре. Адсорбционную активность шпинелей оценивали по сорбции катионов кадмия (II) из нитратных растворов. К 50 мл модельного раствора добавляли определенное количество подготовленного образца шпинели и выдерживали в течение 1,5 ч, периодически помешивая. Содержание катионов кадмия (II) в исследуемом растворе определяли комплексонометрическим методом титрованием раствором трилона Б в присутствии аммиачно-буферной смеси и индикатора – эриохрома черного.
Величину удельной адсорбции N (мг/г) рассчитывали по уравнению
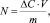
где ΔС – уменьшение концентрации ионов металла в растворе, мг/л; V – объем раствора, мл; m – масса шпинели, г.
Результаты исследования и их обсуждение
Для изучения условий формирования твердых растворов со структурой шпинели были приготовлены образцы двумя способами.
1. По керамической технологии из оксидов NiO, CuO, Fe2O3, Cr2O3 квалификации хч, в количестве, отвечающем стехиометрическому соотношению компонентов Ni0,3Cu0,7Fe0,6Cr1,4O4 в твердом растворе по методике, описанной в [8]. Термообработку проводили при температуре 900 °С циклами по 7–8 ч.
2. Из оксидов металлов аналогично описанному в п. 1 в присутствии 0,5–1,5 % (мас.) хлорида калия (сверх 100 %). Введение хлорида калия проводили на стадии гомогенизации смеси оксидов. Более подробно методика синтеза шпинелей описана в [7].
На рентгенограмме образца 1 (рис. 1, а) выявлены линии, соответствующие твердому раствору, кристаллизующемуся в структуре кубической шпинели, и линии, характеризующие фазу состава CuCrO2, кристаллизующуюся в ромбоэдрической симметрии, ее содержание не превышает 6 %.
В соответствии с результатами гармонического анализа сложных профилей линий, можно предположить следующий фазовый состав образца 1: 3 % – фаза делафоссита CuCrO2, 97 % – твердый раствор примерного состава Ni0,31Cu0,66 0,03Fe0,62Cr1,38O4, содержащий, по-видимому, вакансии (обозначены
0,03Fe0,62Cr1,38O4, содержащий, по-видимому, вакансии (обозначены  ) в решетке шпинели. Фазовый состав образца приведен в табл. 1.
) в решетке шпинели. Фазовый состав образца приведен в табл. 1.
На микрофотографии образца (рис. 2) можно различить кристаллы, максимальный и минимальный размер кристаллитов приведен в табл. 2. В табл. 2 приведены также значения площади поверхности образца.
Таблица 1
Состав и характеристика фаз образцов
|
№ п/п |
Параметры решетки, нм |
|||||
|
кубическая |
тетрагональная |
ромбоэдрическая |
||||
|
aк |
aт |
cт |
cт/aт |
aр |
cр |
|
|
1 |
0,8326 |
– |
– |
– |
0,2982 |
1,7111 |
|
2 |
0,8318 |
0,5991 |
0,8016 |
0,946 |
0,2983 |
1,7093 |
Таблица 2
Характеристика образцов
|
№ п/п |
Площадь поверхности, м2/г |
Размер кристаллов, мкм |
Удельная адсорбция, мг/г |
|
|
максимальный |
минимальный |
|||
|
1 |
0,74 |
2 |
0,140 |
248 |
|
2 |
1,06 |
10 |
0,214 |
326 |
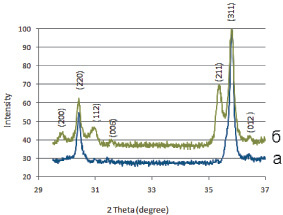
Рис. 1. Фрагмент рентгенограммы шпинелей Ni0,3Cu0,7Fe0,6Cr1,4O4, полученных: а – по керамической технологии; б – в присутствии хлорида калия
Материал, полученный с применением классической керамической технологии, содержит хорошо окристаллизованные фазы. Вследствие этого его адсорбционная активность невысокая (табл. 2). С целью создания образцов с повышенной дефектностью были изменены технологические условия и осуществлен синтез материалов в присутствии хлорида калия. В настоящее время считается установленным фактом ускорение протекания процесса формирования структуры кристаллических материалов в присутствии небольших добавок (до 5 % (мас.)) галогенидов щелочных металлов. Кроме того, введение такой добавки приводит к формированию более рыхлого продукта реакции, что может свидетельствовать об образовании материала с повышенной дефектностью.
Смесь исходных оксидов переходных элементов NiO, CuO, Fe3O3, Cr2O3 и хлорид калия в количестве 0,5–1,0 % (мас.) тщательно гомогенизировали и формовали в виде таблетки диаметром 20 мм под давлением 15 МПа. Термообработку проводили при температуре 900 °С. По окончании термообработки образцы измельчали и отмывали от хлорида калия в дистиллированной воде до отрицательной реакции на хлорид-ионы.

Рис. 2. Микрофотография образца, полученного из оксидов NiO–CuO–Cr2O3–Fe2O3 по керамической технологии
При анализе данных РФА, в образце 2 даже после 23 ч термообработки присутствуют фазы: кубическая и тетрагональная шпинель, делафоссит (рис. 1, б). Можно предположить следующий фазовый состав образца 2:5 % – фаза делафоссита CuCrO2, 23 % – хромит меди (II) примерного состава 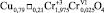 , содержащий, по-видимому, вакансии в октаэдрической подрешетке шпинели (тетрагональная шпинель), 72 % – твердый раствор примерного состава Ni0,42Cu0,58Fe0,84Cr1,16O4 (кубическая шпинель). Фазовый состав образца приведен в табл. 1.
, содержащий, по-видимому, вакансии в октаэдрической подрешетке шпинели (тетрагональная шпинель), 72 % – твердый раствор примерного состава Ni0,42Cu0,58Fe0,84Cr1,16O4 (кубическая шпинель). Фазовый состав образца приведен в табл. 1.
На рис. 3 приведена микрофотография шпинелей, полученных в присутствии хлорида калия. На рисунке видны оплавленные кристаллы различной формы. Значения площади поверхности приведены в табл. 2.

Рис. 3. Микрофотография образца, полученного из оксидов NiO–CuO–Fe2O3–Cr2O3 в присутствии KCl
Из рис. 3 видно, что кристаллы оплавлены, что может свидетельствовать о протекании реакции формирования структуры с участием расплава. Образование расплава возможно по реакции KCl(т) 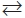 KCl(ж) при температуре 772 °C.
KCl(ж) при температуре 772 °C.
Формирование в системе NiO–CuO–Fe2O3–Cr2O3 в присутствии небольшого количества KCl шпинельных твердых растворов с повышенной дефектностью может быть связано с изменением механизма протекания реакции. Известно, что, если в зоне контакта фаз исходных оксидов образуется микрорасплав, покрывающий зерна компонентов, диффузионные процессы значительно облегчаются (за счет увеличения значений коэффициента диффузии в жидкой фазе, который может на несколько порядков превышать значение коэффициента диффузии в твердой фазе того же состава [1]). Следовательно, механизм формирования структуры материала уже не твердофазный, а в присутствии жидкой фазы. Дополнительным аргументом в пользу данного предположения может служить экспериментально установленный факт ускорения большого числа реакций шпинелеобразования в присутствии галогенидов щелочных металлов. Вероятно, увеличение скорости формирования структуры связано с тем, что диффузия протекает одновременно во всех направлениях и не связана с природой диффундирующего атома.
Исходя из предположения, что в реакции принимает участие расплав хлорида калия, можно предположить следующий механизм формирования структуры. Расплав, покрывающий поверхности зерен, способствует облегчению массопереноса вещества в реакционную зону. При этом активируются все возможные в системе процессы, что должно способствовать увеличению суммарной скорости реакции. В результате образуются фазы шпинели на основе имеющихся в системе катионов – хромит меди (II), легированный Ni2+, и феррит никеля (II), содержащий катионы меди и хрома.
Проведение термообработки при температуре 900 °С делает возможным протекание параллельно реакции образования делафоссита:
CuCr2O4 + CuO = 2•CuCrO2 + 1/2•O2.
В ходе этого процесса расходуется некоторое количество сформировавшегося хромита меди (II), что повышает дефектность шпинельных твердых растволров.
Согласно полученным данным, значение площади поверхности образца 2, полученного в присутствии хлорида калия, превышает эту величину для синтезированного по керамической технологии образца 1 на 30 %. Полученный результат может быть связан с более высокой дефектностью поверхности кристаллов образца 2.
Для синтезированных ферритов-хромитов никеля (II) – меди (II) состава была исследована адсорбционная активность N в процессах поглощения катионов кадмия (II) из водных растворов (табл. 2). Для проведения эксперимента образцы измельчали до размера зерен 0,3 мм, помещали в раствор нитрата кадмия с концентрацией 1 моль/л, выдерживали в течение 1,5 ч, периодически перемешивая.
Согласно результатам исследования, значение N для образца 2 превышает эту величину для шпинелей того же состава, синтезированных по классической керамической технологии, на 24 %. Полученные данные свидетельствуют об увеличении адсорбционной активности шпинелей состава 0,3NiO–0,7CuO–0,3Fe2O3–0,7Cr2O3 при изменении технологических условий. Эти результаты могут быть полезны для разработки материалов, пригодных в процессах очистки сточных вод промышленных предприятий от катионов тяжелых металлов.
Выводы
Изучен процесс образования шпинелей в системе 0,3NiO–0,7CuO–0,3Fe2O3–0,7Cr2O3. Показано, что для формирования твердых растворов шпинельного типа с повышенной дефектностью может быть использована методика синтеза из оксидов переходных металлов с введением хлорида калия. Выявлено, что значение площади поверхности для образца, полученного в присутствии хлорида калия, превышает эту величину для синтезированного по керамической технологии образца на 30 %.
Для полученных материалов выявлено наличие адсорбционной активности в процессах поглощения катионов кадмия из водного раствора. При этом установлено, что адсорбционная активность для образца, полученного в присутствии хлорида калия, превышает эту величину для шпинелей того же состава, полученных по классической керамической технологии, на 24 %.
Синтезированные твердые растворы могут быть полезны в качестве материалов для очистки сточных вод промышленных предприятий, использующих в производственных циклах катионы кадмия.
Библиографическая ссылка
Шабельская Н.П., Чернышев В.М., Хентов В.Я., Яценко Н.Д., Каган Е.Ш., Кузьмина Я.А. СИНТЕЗ И СВОЙСТВА ШПИНЕЛЕЙ СИСТЕМЫ 0,3NIO–0,7CUO–0,3FE2O3–0,7CR2O3 // Фундаментальные исследования. 2016. № 12-4. С. 784-788;URL: https://fundamental-research.ru/ru/article/view?id=41169 (дата обращения: 13.01.2026).



