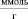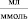В настоящее время серьезной проблемой является загрязнение природных вод промышленными стоками, что ухудшает экологическую обстановку. Сточные воды, как правило, представляют собой сложные гетерогенные системы, содержащие неорганические и органические вещества, находящиеся в растворенном, коллоидном и нерастворенном состояниях. Основной вклад в загрязнение вносят гальванические и травильные производства. Эти производства требуют большого количества воды [5] для промывки обрабатываемых деталей, в результате чего происходит сброс большого количества отходов [6]. В связи с этим ведется поиск эффективных и экологически выгодных методов очистки сточных вод от цветных и тяжелых металлов.
Каолинит как природный минерал известен давно [1], является главным составляющим всех глин. Основа – это водные алюмосиликаты Al4[Si4O10][OH]8 с небольшими примесями железа (III), магния, кальция, натрия, калия. Для каолинита характерна триклинная сингония а0 = 5,14; b0 = 8,90; c0 = 14,45; β = 100 °12’ [1]. Цвет минерала от белого, нередко с желтым, буроватым, красноватым, иногда зеленоватым или голубоватым оттенком. Твердость около 1 по десятибалльной шкале. Удельный вес в пределах 2,58–2,60 г/см3. Каолинит не плавится, устойчив к HCl и HNO3, но при нагревании с H2SO4 легко разлагается. При нагревании выше 300 ° каолинит полностью разрушается.
В последнее время глинистые минералы являются объектами многочисленных исследований [3–6, 9] с целью использования их как местного сырья для решения региональных экологических проблем. Это связано с очисткой сточных вод различного происхождения. Использование местного сырья для извлечения цветных металлов из сточных вод характеризуется высокой экономичностью и малым расходом сорбента.
Цель – настоящей работы результаты исследований структуры и сорбционных свойств каолинитовой глины, которая может быть применена для очистки сточных вод от ионов меди.
Материалы и методы исследования
Природный сорбент каолинитовая глина представляет собой легкий порошок белого цвета с размерами частиц 2–20 мкм и насыпной плотностью 0,3 г/см3. На рис. 1 представлена СЭМ-микрофотография образца сорбента, полученная на сканирующем электронном микроскопе. По полученным данным основными его компонентами являются оксиды в количествах, представленных в табл. 1.
Атомное отношение алюминия к кремнию по представленным данным составляет ~ 1/2,4 и это соответствует максимальному числу и силе кислотных центров поверхности алюмосиликатного каркаса каолинитовой глины [8]. Активными центрами являются подвижные ионы Na+ и K+, принимающие участие в обмене на ионы тяжелых металлов.
Минералогический состав каолинитовой глины определяли рентгенофазовым анализом. На рис. 2 представлена рентгенограмма, снятая на дифрактометре «ДРОН-7» с медным анодом (λ = 1,5406 A).
Результаты рентгенофазового анализа дают дополнительные основания для предположения о высокой подвижности и обменной способности катионов Na+ и K+, удерживаемых на поверхности каолинитовой глины.
Изучение сорбции ионов меди (II) на каолинитовой глине проводили в статических условиях из сульфатных растворов с концентрациями от 0,01 до 0,24 ммоль/мл. Сорбент в солевой форме (обработанный раствором NaCl) в количестве 1 г заливали 50 мл растворами. Контакт сорбента с раствором продолжался до установления равновесия в течение 7 суток. Затем сорбент и раствор отделяли и анализировали на содержание ионов меди и измеряли рН среды. Концентрацию катионов меди в растворе определяли комплексонометрическим титрованием с трилоном Б в присутствии индикатора ПАН [10].
Результаты исследования и их обсуждение
По полученным экспериментальным данным рассчитали статическую емкость каолинитовой глины в солевой форме по меди (II) (ммоль/г)
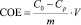 ,
,
коэффициент распределения Кd, мл/г
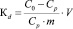 , мл/г,
, мл/г,
и степень сорбции α ( %)
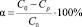 ,
,
где C0 – концентрация меди в исходном растворе, ммоль/мл; Cp – равновесная (остаточная) концентрация извлекаемого иона в растворе, ммоль/мл; V – объем раствора, мл; m – масса сорбента, г. Результаты расчетов представлены в табл. 2.
Таблица 1
Содержание компонентов в составе каолинитовой глины
|
Содержание |
SiO2 |
Al2O3 |
Na2O |
K2O |
CaO |
Fe2O3 |
|
% мас. |
43,98 |
18,73 |
0,96 |
0,80 |
0,06 |
6,32 |
|
Число молей |
0,732 |
0,180 |
0,015 |
0,007 |
0,009 |
0,057 |

Рис. 1. СЭМ-микрофотография каолинита
Рис. 2. Рентгенограмма образца каолинитовой глины
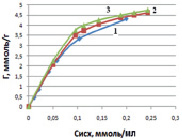
Рис. 3. Зависимость величины сорбции ионов меди на модифицированной солевой форме каолинитовой глины при температурах, К: 298 (1); 313 (2); 333 (3)
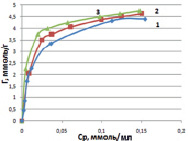
Рис. 4. Изотермы сорбции ионов меди на каолинитовой глине в солевой форме (Na) при температурах, К: 298 (1), 313 (2), 333 (3)
Таблица 2
Коэффициент распределения, степень сорбции и статическая обменная емкость каолинитовой глины при извлечении ионов меди (II) из растворов при температуре 298 К
|
Co, ммоль/мл |
0,01 |
0,02 |
0,04 |
0,06 |
0,10 |
0,20 |
0,24 |
|
Cp, ммоль/мл |
0,0025 |
0,0040 |
0,0065 |
0,0120 |
0,0365 |
0,1130 |
0,1545 |
|
Кd, мл/г |
510,00 |
340,50 |
265,38 |
189,58 |
91,78 |
38,27 |
28,48 |
|
α, % |
99,65 |
93,33 |
87,80 |
79,13 |
64,73 |
43,36 |
36,29 |
|
СОЕ, ммоль/г |
0,45 |
0,85 |
1,73 |
2,28 |
3,35 |
4,33 |
4,40 |
Модифицированная каолинитовая глина, обработанная раствором NaCl, изменяет физико-химические свойства. При переводе природной формы каолинитовой глины в солевую форму происходит значительное увеличение положительного заряда поверхности. Последующие эксперименты показали, что выявленные изменения физико-химических свойств каолинитовой глины позволяют резко увеличить эффективность сорбции ионов меди на поверхности. На рис. 3 видно, что количество поглощенных ионов меди закономерно увеличивается с ростом концентрации в исходном растворе.
Более полную характеристику равновесия процесса сорбции можно получить с помощью изотерм. Вид изотерм показывает степень сродства сорбируемых ионов к сорбенту. Изотерма сорбции позволяет определить максимальную обменную емкость сорбента и рассчитать некоторые энергетические характеристики процесса. На изотермах сорбции, приведенных на рис. 4, виден резкий подъем в области малых равновесных концентраций меди. На этом отрезке наблюдается линейная зависимость количества сорбированных ионов меди от равновесной концентрации в растворе (отрезок Генри).
Для описания сорбционного процесса было использовано несколько моделей:
Ленгмюра:
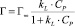
или в линейной форме
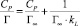
где Г – количество сорбированной меди и Г∞ – величина предельной сорбции (ммоль/г), Cp – равновесная концентрация ионов меди в растворе (ммоль/мл), kL – концентрационная константа сорбционного равновесия, характеризующая интенсивность процесса сорбции, мл/ммоль;
Фрейндлиха:
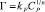
или в логарифмической форме

где kF и n – константы Фрейндлиха;
Темкина:
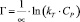
или
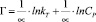
где kT и ∞ – константы Темкина.
Модель изотермы Ленгмюра основана на том, что на поверхности катионита образуется мономолекулярный сорбционный слой и все активные места обладают равной энергией и энтальпией сорбции [2]. Модель Фрейндлиха используется для описания сорбции на гетерогенной поверхности [2]. Относительную сорбционную способность отражает константа kF, а интенсивность сорбционного процесса и распределение активных центров характеризует константа n. Если n = 1, то все сорбционные центры в сорбенте будут эквивалентны, при n > 1 энергия связи между сорбентом и сорбируемым ионом уменьшается по мере заполнения поверхности, а при n < 1 энергия связей возрастает. В этом случае в первую очередь происходит заполнение активных сорбционных положений с наименьшей энергией, что сопровождается непрерывным изменением энергии сорбции [7]. Энергия сорбции в изотерме Фрейндлиха находится в логарифмической зависимости от степени заполнения поверхности, в отличие от модели Темкина, в которой данная зависимость линейна.
Линейная обработка изотерм сорбции ионов меди из водных растворов на Na+ – форме каолинитовой глины представлены в табл. 3.
Результаты табл. 3 показывают, что наилучшим образом экспериментальные данные описываются моделью Ленгмюра. Полученные результаты подтверждают, что при сорбции ионов меди на солевой форме каолинитовой глине предельная сорбция Г∞ равна 5,0 ммоль/г, а константа сорбционного равновесия К равная 67,0 мл/ммоль (298 К), которая характеризует энергию взаимодействия ионов меди с поверхностью сорбента.
Значение константы n в уравнении Фрейндлиха больше 1, что свидетельствует о благоприятных условиях связанных с уменьшением энергии связи сорбент – сорбат по мере заполнения поверхности. Значение константы kF подтверждает легкость перехода сорбируемых ионов меди из раствора в фазу сорбента.
Таблица 3
Обработка изотерм сорбции ионов меди (II) по моделям
|
Т, К |
Ленгмюра |
Фрейндлиха |
Темкина |
||||||||
|
|
|
|
К,
|
Коэффициент корреляции |
lgkF |
1/n |
Коэффициент корреляции |
lgkT |
1/α |
Коэффициент корре-ляции |
|
|
298 |
0,003 |
0,201 |
5,00 |
67,00 |
0,999 |
0,916 |
0,286 |
0,985 |
6,099 |
1,964 |
0,991 |
|
313 |
0,002 |
0,202 |
4,95 |
101,0 |
0,999 |
0,790 |
0,150 |
0,998 |
5,814 |
1,446 |
0,999 |
|
333 |
0,001 |
0,203 |
4,93 |
203,0 |
0,999 |
0,768 |
0,112 |
0,998 |
5,657 |
1,123 |
0,995 |
Свободную энергию Гиббса, кДж/моль, рассчитали по формуле
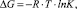
где R – универсальная газовая постоянная, равная 8,314 Дж/моль•К; Т – температура, К; К – константа адсорбционного равновесия. Полученные значения энергии Гиббса имеют отрицательный знак – 10,25 (298 К); – 12,01 (313 К); – 14,71 (333 К) кДж/моль, что соответствует устойчивому закреплению ионов меди на поверхности каолинитовой глины.
Заключение
На основании приведенных исследований и полученных результатов можно сделать следующие выводы:
Изотермы сорбции ионов меди хорошо описываются различными моделями сорбции.
Определены значения предельной статической сорбционной емкости каолинитовой глины, которая составляет 5,0 ммоль/г, вычислены коэффициенты распределения, значения которых уменьшаются с увеличением концентрации ионов меди в растворе.
Рассчитаны значения энергии Гиббса 10,25 (298 К); 12,01 (313 К); 14,71 (333 К) кДж/моль.
Каолинитовая глина, переведенная в солевую форму, представляет собой перспективный природный сорбент для извлечения ионов меди из водных растворов.
Библиографическая ссылка
Пимнева Л.А., Лебедева А.А. ИССЛЕДОВАНИЕ СОРБЦИИ ИОНОВ МЕДИ (II) ПРИРОДНЫМ СОРБЕНТОМ // Фундаментальные исследования. 2016. № 12-2. С. 329-333;URL: https://fundamental-research.ru/ru/article/view?id=41092 (дата обращения: 06.02.2026).




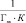
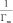
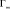 ,
,