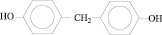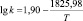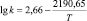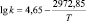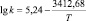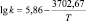Введение атомов галогенов, в частности хлора, в состав полимеров является одним из перспективных способов повышения их огнестойкости [1, 5].
Для синтеза хлорсодержащих диоксисоединений использованы дифенолы, приведенные в табл. 1, а также доступный и дешевый промышленный продукт – гексахлорбензол.
Исследования проведены в среде апротонного диполярного растворителя диметилсульфоксида при равных начальных концентрациях (0,14 экв/л) и температурах 333–373 К, а для о-замещенных дифенолов, содержащих аллильные группы в интервале 333–393 К. Выбор ДМСО в качестве реакционной среды обусловлен тем, что благодаря специфической сольватации катионов, моно- и дифеноксидные анионы дифенолов остаются относительно свободными. Это приводит к значительному увеличению их активности в реакциях нуклеофильного замещения.
Контроль за ходом реакции осуществлялся методом обратного потенциометрического титрования аликвотных проб реакционной смеси с последующим определением количества непрореагировавших функциональных групп феноксидных анионов.
Таблица 1
Исходные соединения, используемые для синтеза хлорсодержащих диоксисоединений*
|
№ п/п |
Название |
Структурная формула |
Сокращенное обозначение |
|
бисфенолы (пара – производные фенола) |
|||
|
1 |
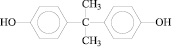
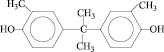
2,2-бис(4-оксифенил) пропан |
|
ДОФП |
|
2 |
2,2-бис(4-оксифенил) метан |
|
ДОФМ |
|
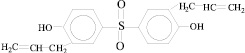
3 |
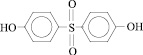
2,2-бис(4-оксифенил) сульфон |
|
ДОФС |
|
4 |
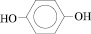
1,4-диоксибензол |
|
ГХН |
|
бисфенолы (орто –, пара- производные фенола) |
|||
|
5 |
2,2-бис(3-метил-4-оксифенил)пропан |
|
ДОМФП |
|
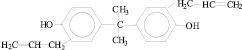
6 |
2,2-бис(3-аллил- 4-оксифенил)пропан |
|
ДАД |
|
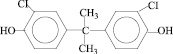
7 |
2,2-бис(3-хлор -4- оксифенил)пропан |
|
ДХДОФП |
|
8 |
2,2-бис(3-аллил-4-оксифенил)сульфон |
|
ДАДОФС |
Примечание. *данные для дифенолов под номерами 1–4 взяты из литературы [2].
Диоксисоединения получали двумя способами – переводом исходных дифенолов в монофеноксидные и дифеноксидные анионы. Реакции, протекающие в системе в случае использования монофеноксидного аниона дифенола, можно представить следующим образом:
1-я стадия:

2-я стадия
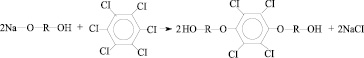
В качестве R выступают остатки бисфенолов, приведенные в табл. 1.
Использование монофеноксидных анионов дифенолов для реакции получения хлорсодержащих диоксисоединений обусловлено большей растворимостью в диметилсульфоксиде в отличие от дифеноноксидных анионов. Высокая растворимость монофеноксидных анионов дифенолов позволяет проводить реакции конденсации в более концентрированных растворах, кроме того, снижение концентрации в растворе приводит к необходимости увеличения времени проведения реакции. Так, если концентрация монофеноксидного аниона дифенола в растворе может варьироваться в интервале 1–2 моль/л, то концентрация дифеноксидного аниона дифенола не могла быть выше 0,6 моль/л. В более концентрированных растворах в условиях проведения процесса конденсации наблюдалась кристаллизация натриевой соли с образованием двух фаз. Эти факторы определили выбор нижнего температурного предела проведения реакции. Минимальная температура проведения синтеза соответствовала температуре, которая на 10 °С превышала температуру начала кристаллизации натриевой соли дифенола.
Исследование зависимости содержания гидроксильных групп и выхода хлорсодержащих диоксисоединений от продолжительности процесса – фактора, имеющего непосредственное отношение, как к скорости реакции, так и к глубине его протекания, показало, что выход и глубина протекания реакции конденсации сильно зависят от температуры, времени взаимодействия реагентов, концентрации и природы исходных дифенолов (рис. 1).
Из полученных данных следует, что увеличение концентрации и температуры приводит к значительному повышению скорости реакции.
Активность дифенолов в реакциях нуклеофильного замещения зависит от их химического строения. Наличие в молекуле ДОДФС мостиковой электроноакцепторной –SO2 – группы значительно снижает его нуклеофильность, что, по-видимому, связано с сопряжением π-электронов бензольных колец с вакантными d-орбиталями атома серы (π-d сопряжение). Снижение активности дифенолов с аллильными заместителями в о-положении (ДАД, ДАДОФС) к гидроксильной группе по сравнению с соответствующими незамещенными дифенолами в реакциях нуклеофильного замещения связано как с создаваемыми ими стерическими препятствиями, так и их электронодонорным действием.
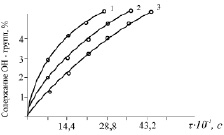
Рис. 1. Зависимость количества гидроксильных групп от времени взаимодействия монофеноксидного аниона ДОФМ с ГХБ при различных концентрациях. Температура – 343 К: 1 – 2 моль/л; 2 – 1,5 моль/л; 3 – 1 моль/л
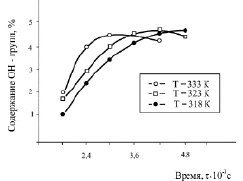
Рис. 2. Зависимость количества гидроксильных групп от времени реакции дифеноксидного аниона ДОФП с ГХБ. Концентрация – 0,6 моль/л
На рис. 2 приведены в качестве примера кривые зависимости количества гидроксильных групп от времени реакции дифеноксидного аниона ДОФП с ГХБ.
Наблюдаемый перегиб на кривых можно связать с протеканием последовательно-параллельных реакций, в которых исходные мономеры принимают участие как в реакциях образования промежуточных монофеноксизамещенных димеров, так и в реакциях расходования промежуточных продуктов. Из характера кривых зависимости количества гидроксильных групп от времени взаимодействия при различных температурах видно, что на них имеются максимумы.
Сравнительный анализ полученных данных показал, что скорость реакции и выход целевых продуктов при использовании монофеноксидных анионов дифенолов в реакциях синтеза диоксисоединений несколько ниже, чем в случае применения дифеноксидных анионов, из-за наличия явления гомосопряжения типа
~ –Ar–О– –1/2…Н–1/2…О–Аг–~.
Ранее А.К. Микитаевым с сотрудниками [4, 3] было показано, что в реакциях нуклеофильного замещения строение дифенола существенно влияет на его реакционную способность. В табл. 2 приведены значения относительных показателей кислотности и суммарных Σσ–констант Гаммета дифенолов, измеренные в диметисульфоксиде, определяющие их реакционную способность.
Наибольшую активность в реакциях нуклеофильного замещения проявляют те дифенолы, которые имеют наибольшие значения относительных показателей кислотности и наименьшие значения суммарных σ-констант Гаммета. Увеличению реакционной способности дифенолов способствует наличие электронодонорных групп между ароматическими ядрами.
Таблица 2
Некоторые физико-химические свойства дифенолов
|
№ п/п |
Дифенолы |
ΔрК1 |
Σσ(НО – С6Н4 – М –) |
|
1 |
ДОФС |
2,20 |
0,66 |
|
2 |
ДОФП |
5,48 |
–0,11 |
|
3 |
ДОФМ |
5,39 |
–0,14 |
|
4 |
ГХН |
9,96 |
–0,89 |
|
о – замещенные дифенолы |
|||
|
5 |
ДАДОФС |
3,46 |
0,48 |
|
6 |
ДАДОФП |
3,56 |
0,39 |
|
7 |
ДХДОФП |
3,90 |
0,27 |
|
8 |
ДОМФП |
6,33 |
–0,20 |
Полученные нами результаты хорошо согласуются с вышеприведенными утверждениями – реакции взаимодействия монофенолятов с гексахлорбензолом заканчиваются быстрее при использовании более основных дифенолов.
Из полученных результатов следует, что исследованные реакции в ДМСО подчиняются второму порядку при температурах 333–393 К. На рис. 3 в качестве примера приведены изменения обратных концентраций исходных соединений от продолжительности реакции ГХБ с дифенолятами при различных температурах. Во всех случаях имеет место линейная зависимость от времени.
Полученные значения констант скоростей показывают, что при взаимодействии с ГХБ активность дифенолов убывает слева направо в ряду
ГХН > ДОФМ > ДОФП > ДОДФС.
Для о-замещенных дифенолов наблюдается следующий порядок активности в реакциях нуклеофильного замещения:
ДОМФП > ДХДОФП > ДАДОФП > ДАДОФС.
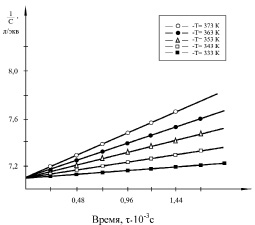
Рис. 3. Зависимость обратной концентрации феноксидных групп от времени реакции дифеноксидного аниона ДАДОФП при взаимодействии с ГХБ при различных температурах
Таблица 3
Уравнения Аррениуса и значения энергий активаций в реакциях ГХБ с дифенолами
|
Исходный дифенол |
Уравнения Аррениуса |
Энергия активации, КДж/моль |
|
Гидрохинон |
|
34,90 |
|
2,2-бис(4-оксифенил)пропан |
|
41,87 |
|
2,2-бис(4-оксифенил)сульфон |
|
56,82 |
|
2,2-бис(3-аллил- 4-оксифенил)пропан |
|
71,78 |
|
2,2-бис(3-аллил-4-оксифенил)сульфон |
|
78, 64 |
Корреляционный анализ реакции дифенолов с гексахлорбензолом дает основание утверждать, что зависимость между реакционной способностью бисфенолов и их химическим строением носит закономерный характер и указывает на нуклеофильный характер данной реакции. Корреляционное уравнение, связывающее реакционную способность бисфенолов с Σσ-константами Гаммета при синтезе хлорсодержащих диоксисоединений в среде ДМСО, имеет следующий вид:
lg k343 = –0,375Σσ(НО – С6Н4 – М –) – 3,78,
где k343 – константа скорости при 343 К; М – мостиковая группа.
Коэффициент корреляции равен 0,98–0,99, стандартное отклонение 0,035; число точек – 5.
Анализ полученного уравнения Гаммета указывает, что абсолютное значение реакционной константы ρ при 343 К меньше единицы и имеет отрицательное значение. Это говорит о невысокой полярности лимитирующей стадии, а также, что в процессе реакции осуществляется нуклеофильная атака молекул гексахлорбензола.
Строение полученных хлорсодержащих диоксисоединений подтверждают данные функционального и элементного анализов, ИК и ЯМР-С13 спектроскопии.
До данным ЯМР-С13 спектроскопии сигналы 154,2; 154,1 и 148 м. д. подтверждают образование простой эфирной связи, а сигналы 125; 04; 127; 01; 128; 66 и 132; 24 м. д. образование в полученных соединениях структуры
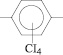
Таким образом, из результатов проведенных исследований следует, что общими для данных реакций являются следующие положения: константы скоростей возрастают при введении в нуклеофил электронодонорных заместителей; электроноакцепторные и о-заместители (за счет стерических препятствий) снижают активность нуклеофила, при этом существенное влияние может оказать строение мостиковых группировок между фенильными ядрами дифенолов; введение в молекулы дифенолов мостиковых электроноакцепторных группировок между фенильными ядрами снижает, а электронодонорных – повышает их активность в реакциях нуклеофильного замещения с перхлорбензолом.
Библиографическая ссылка
Вологиров А.К., Беев А.А., Микитаев А.К., Кумышева Ю.А., Тхазеплова Р.З., Саламов А.Х. О РЕАКЦИЯХ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ В ГЕКСАХЛОРБЕНЗОЛЕ АРОМАТИЧЕСКИМИ ДИОЛАМИ В БЕЗВОДНЫХ УСЛОВИЯХ // Фундаментальные исследования. 2016. № 7-2. С. 218-223;URL: https://fundamental-research.ru/ru/article/view?id=40487 (дата обращения: 02.01.2026).