В последнее время наблюдается увеличение спроса на селен, что обусловлено расширением его применения в наукоемких областях промышленности. Однако объемы производства селена остались на прежнем уровне [5].
Ключевыми промышленными источниками селена служат шламы, образующиеся при электролитическом рафинировании анодной меди. При этом степень извлечения селена из сульфидного медного полиметаллического рудного сырья в шламы составляет менее 40 % [6]. Основная часть потерь селена приходится на долю сернистых газов пирометаллургических переделов [1].
При проведении мокрой очистки печных газов медно-никелевого производства в промывных башнях образуются два типа жидкофазных селенсодержащих промышленных полупродуктов – промывная серная кислота электрофильтров и сильнокислые конденсаты. В настоящее время весь объем конденсатов сбрасывается на шлакоотвал для нейтрализации, куда также вывозятся и избыточные объемы промывной кислоты, невостребованные в основной технологии [4].
В печные газы в случае переработки сульфидных полиметаллических ренийсодержащих руд, а затем и в промывную кислоту совместно с селеном переходят рений и осмий. С целью извлечения рения из промывной кислоты применяют жидкостную экстракцию третичными аминами. При этом до 80 % селена остается в рафинате, что негативно сказывается на дальнейших процессах электролиза тяжелых металлов. Полученный реэкстракт направляют на сорбционное извлечение рения, эффективность которого снижается ввиду присутствия в растворах селена [8]. Однако заметное количество селена наряду с рением концентрируется в твердофазных продуктах экстракционной переработки промывной кислоты и, не извлекаясь, теряется со сбросными сернокислыми растворами осмиевого передела [3]. Вследствие использования в осмиевой технологии хромсодержащих реагентов сбросные растворы, концентрирующие в себе рений и селен, содержат также значительные количества хрома.
С учетом вышесказанного актуальным является изучение особенностей восстановления селена в сернокислой хромсодержащей среде, что позволит исключить каналы потерь селена с промежуточными продуктами сернокислого производства при комплексной переработке сульфидного полиметаллического сырья и тем самым увеличить объемы его производства и так же повысить степень извлечения рения.
На основе анализа литературных и патентных данных в качестве наиболее перспективных методов извлечения селена (IV) и (VI) из сернокислых растворов были выбраны восстановительные и цементационные методы [1, 2, 7]. Проведенная термодинамическая оценка возможности выделения селена из сернокислых растворов при температурах 298–348 К с использованием сернистого газа, сульфита натрия и медного порошка по реакциям
подтвердила высокую вероятность восстановления селенит-ионов 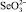 и в меньшей степени селенат-ионов
и в меньшей степени селенат-ионов 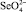 (изменение энергии Гиббса реакций (1)–(7) находится в интервале от –112 до –592 кДж/моль).
(изменение энергии Гиббса реакций (1)–(7) находится в интервале от –112 до –592 кДж/моль).
H2SeO3 + 4Cu + 2H2SO4 = Cu2Se + 2CuSO4 + 3H2O; (1)
H2SeO3 + 2Na2SO3 = Se + 2Na2SO4 + H2O; (2)
H2SeO3 + 4Na2SO3 + 2CuSO4 + H2O = Cu2Se + 2H2SO4 + 4Na2SO4; (3)
H2SeO3 + 2SO2(г) + H2O = Se + 2H2SO4; (4)
H2SeO4 + 5Cu + 3H2SO4 = Cu2Se + 3CuSO4 + 4H2O; (5)
H2SeO4 + 3Na2SO3 = Se + 3Na2SO4 + H2O; (6)
H2SeO4 + 2SO2 + H2O = H2SeO3 + 2H2SO4 (7)
Эксперименты по осаждению селена осуществлялись на синтетических сернокислых растворах, содержащих, (г/л): 5–15 Se(IV), 5 Se(VI), 60 Cr (III), 5 Cr(VI), 20–200 H2SO4. Контроль redox-потенциала исследуемых систем осуществлялся с помощью платинового и насыщенного хлорсеребряного электродов с использованием рН-милливольтметра (pH-673). Определение концентрации селена и хрома в растворах проводили с использованием масс-спектрометрии с индукционно-связанной плазмой на спектрометре (ICAP-6300Duo).
Осаждение селена (IV) сернистым газом при постоянной скорости его продувки сопровождается снижением redox-потенциала системы (рис. 1). Началу процесса восстановления селенистой кислоты до селена соответствует первый скачок redox-потенциала, горизонтальные участки свидетельствуют о протекании процесса восстановления селена (IV), второй скачок потенциала – об окончании восстановления селена (IV), когда его концентрация в растворе близка к нулю. Потенциалы, соответствующие выделению селена (IV) из раствора, свидетельствуют о весьма низком содержании в нем сернистого газа (5?10–16 г/л) – cернистый газ, попадая в раствор, сразу же расходуется на восстановление селена (IV), что обуславливает ограничение скорости процесса восстановления селена (IV) скоростью растворения SO2. C ростом концентрации H2SO4 повышается redox-потенциал горизонтального участка кривой (рис. 2), что отвечает уменьшению квазистационарной концентрации сернистого газа и согласуется с данными работы [9].
Анализ кинетических кривых (рис. 1) также подтверждает, что лимитирующей стадией процесса является растворение сернистого газа: прямолинейные участки кинетических кривых свидетельствуют о том, что скорость реакции восстановления не зависит от концентрации халькогена в растворе, и реакция имеет при данных условиях нулевой порядок по концентрации селена.
Рассчитанные отрицательные значения кажущейся энергии активации процесса восстановления селена (IV) сернистым газом (–8,21; –15,22; –22,4 и –28,9 кДж/моль) в диапазоне кислотности 100–250 г/л H2SO4 свидетельствуют о сложности формального описания процесса традиционным уравнением Аррениуса.
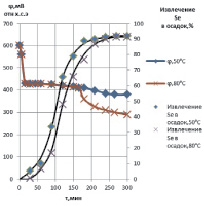
Рис. 1. Кинетика осаждения селена (IV) сернистым газом в сернокислых растворах. Состав раствора (г/л): Se(IV) – 5, H2SO4 – 100, температура опытов – 50 и 80 °С, максимальное время осаждения – 5 часов
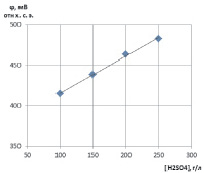
Рис. 2. Зависимость потенциала восстановления селена (IV) сернистым газом от концентрации серной кислоты (80 °C, концентрация селена 7,5 г/л)
Установлено, что повышение температуры отрицательно сказывается на процессе восстановления селена сернистым газом, что обусловлено снижением растворимости сернистого газа. Следовательно, найденные отрицательные значения кажущихся энергий активаций формально характеризуют зависимость скорости диффузии сернистого газа от температуры. Процесс восстановления селена протекает преимущественно во внешнедиффузионной области.
В растворах Cr (III) образует нейтральные, отрицательно и положительно заряженные комплексы с координационным числом 6 и октаэдрической конфигурацией, относительные количества которых зависят от состава растворов. К таким комплексам относится комплекс с анионами 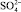 [10]. Заметного влияния Cr(III) на показатели извлечения из сернокислого раствора Se (IV) не обнаружено.
[10]. Заметного влияния Cr(III) на показатели извлечения из сернокислого раствора Se (IV) не обнаружено.
В кислых средах преобладающей формой хрома (VI) является 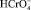 . Восстановление
. Восстановление 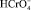 в кислых средах сопровождается поглощением H+ (8), поэтому на снижение потенциала влияет не только снижение концентрации хрома, но и понижение кислотности среды.
в кислых средах сопровождается поглощением H+ (8), поэтому на снижение потенциала влияет не только снижение концентрации хрома, но и понижение кислотности среды.
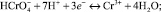 (8)
(8)
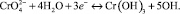 (9)
(9)
Присутствие в растворе шестивалентного хрома в относительно низкой концентрации существенно не изменяет начальный окислительно-восстановительный потенциал исследуемой системы (равновесный redox-потенциал колеблется в интервале 550–620 мВ отн. вод. эл.). Продувка сернистым газом синтетического сернокислого раствора, содержащего 60 г/л Cr (III), 5 г/л Cr (VI), 5 г/л Se (IV) и 1 г/л Se (VI), при температуре 50 °С в течение 3 часов (общий расход восстановителя до 300 %) обеспечивает полное восстановление шестивалентного хрома и выделение до 90 % селена в виде склонного к комкованию черно-серого осадка.
При использовании сульфита натрия независимо от кислотности среды в первый момент времени наблюдается резкое снижение концентрации селена (IV) в синтетическом растворе с 15 до 0,5–1,0 г/л, что говорит о значительно большей скорости процесса восстановления селена сульфитом натрия, по сравнению с сернистым газом (рис. 3). Большая скорость выделения селена с применением сульфита натрия обусловлена снятием диффузионных ограничений, связанных с растворением сернистого газа. При этом увеличение кислотности среды способствует более глубокому осаждению селена из раствора.
Выявлено, что применение сульфита натрия для выделения селена в осадок обеспечивает восстановление до 92,5 % четырехвалентной формы селена и не менее 48 % Se (VI) при температуре 50 °С за 30 мин при кислотности 200 г/л H2SO4, и 1,5-кратном расходе восстановителя. При наличии в синтетическом растворе хрома (VI) высокое извлечение селена в кек сохраняется при оптимальных параметрах восстановительного процесса. При этом степень восстановления шестивалентного хрома до трехвалентного состояния достигает 95–97 %.
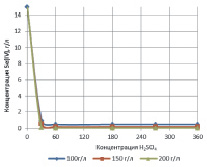
Рис. 3. Осаждение селена (IV) сульфитом натрия. Состав раствора (г/л): Se(IV) – 5, H2SO4 – 100, 150 и 200 г/л, температура – 50 °С, максимальное время осаждения – 6 часов, расход сульфита натрия 150 %
Однако, несмотря на полученные удовлетворительные результаты по выделению селена с использованием описанных выше методов, их применение сдерживается интенсивным вспениванием сернокислого раствора в процессах восстановления сернистым газом или сульфитом натрия и получением селена в виде высокодисперсного порошка наряду с большим расходом реагентов.
Проведенные эксперименты по цементации селена (IV) и селена (VI) из раствора медным порошком показали, что скорость перехода селена в цементат повышается с увеличением кислотности среды (рис. 4). Влияние концентрации кислоты на кинетику процесса обусловлено сдвигом потенциала системы с ростом кислотности раствора и переходом от более инертных гидроксокомплексов к более лабильным формам [2].
Установлено, что селен (IV) удовлетворительно цементируется только при повышенных температурах (80–90 °С). Увеличение расхода медного порошка в два раза позволяет повысить степень извлечения селена на 20–25 %. Дальнейшее увеличение расхода цементатора не оказывает существенного влияния на показатели цементации.
Найденное значение энергии активации процесса цементации при концентрации серной кислоты 100 г/л равно 26,32 кДж/моль, свидетельствует о протекании процесса преимущественно в диффузионной области.
В ходе экспериментальных исследований получено, что оптимальными параметрами цементации селена медным порошком, обеспечивающими практически полное извлечение селена (IV) и не менее 60 % селена (VI), являются: температура 80–90 °С, кислотность более 200 г/л H2SO4, продолжительность 100 мин, расход медного порошка – двукратный. Присутствующий в синтетических растворах хром (VI) по окончании цементации полностью восстанавливается до хрома (III) (рис. 5).
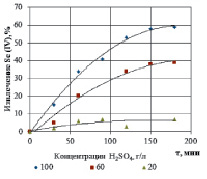
Рис. 4. Извлечение селена (IV) в цементат. Состав раствора (г/л): Se(IV) – 5, H2SO4 – 20, 40 и 60 г/л, t – 25°С, τ – 3 часа, расход мед. пор. – 2 кр.
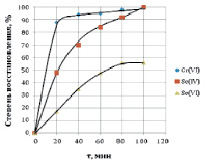
Рис. 5. Цементация Сr (VI), Se (IV) и Se (VI) из сернокислого раствора медным порошком. Состав раствора (г/л): Se(IV) – 5, Se(VI) – 5, Cr(VI) – 60, H2SO4 – 200, t – 80–90 °С, расход мед. пор. – 2 кр.
Согласно результатам рентгено-дифракционного анализа основными формами селена в цементатах являются селениды меди: берцеллианит (Cu2-xSe, структура с дефицитом атомов меди: х @ 0...0,2), умангит Cu3Se2 и CuSe. Полученные осадки подлежат дальнейшему разделению на медь и селен.
Заключение
При использовании всех изученных восстановителей в оптимальных условиях обеспечивается практически полное восстановление селена (VI), селен (IV) при этом восстанавливается в количестве не более 60 %.
Присутствующий в растворах хром (III) не влияет на показатели восстановления селена. Хром (VI) практически нацело восстанавливается до трехвалентного состояния, что в свою очередь исключает его негативное воздействие на показатели последующей сорбции рения из очищенных от селена растворов.
Выбор метода восстановления в значительной степени определяется конкретными особенностями предприятия. Процесс восстановления сульфитом натрия (сернистым газом) сопровождается интенсивным вспениванием сернокислого раствора, а также получением высокодисперсного селена. Высокий расход сернистого газа, продолжительность процесса и необходимость аппаратурных решений также в определенной степени может осложнить промышленную реализацию данного варианта. Использование медного порошка для выделения селена в процессе цементации определяется в первую очередь его доступностью на металлургических предприятиях.
Библиографическая ссылка
Мардарь И.И., Петров Г.В., Фокина С.Б. ОСОБЕННОСТИ ВОССТАНОВЛЕНИЯ СЕЛЕНА В СЕРНОКИСЛОЙ ХРОМСОДЕРЖАЩЕЙ СРЕДЕ // Фундаментальные исследования. 2016. № 1-1. С. 43-47;URL: https://fundamental-research.ru/ru/article/view?id=39790 (дата обращения: 01.02.2026).



