Халконы представляют значительный интерес для химиков и биохимиков, что обусловлено несколькими факторами: легкостью их синтеза, высокой фармакологической активностью синтетических и природных халконов, а также возможностью использования в качестве ценных синтетических интермедиатов, например в синтезе различных гетероциклических соединений.
Соединения с халконовым фрагментом проявляют различные виды биологической активности. Например, они проявляют значительную активность в отношении разнообразных опухолей и имеют хемопротекторные свойства. Это можно связать с их антиоксидантной активностью [32, 45, 48, 49]. Другими важными свойствами халконов являются способность ингибировать рост бактерий [46], а также проявление противогрибковой и антивирусной активности [13]. Кроме того, они обладают способностью укреплять капилляры и могут использоваться в качестве противовоспалительных средств [20]. Помимо указанных видов активности выявлены противомалярийная [3, 11, 27, 28, 34], противораковая [1, 17, 40], ларвицидная [7], иммуномодулирующая [6], антигипергликемическая, антитуберкулезная [43], антипротозойная и антимитотическая активности [30], а также возможность применения их в качестве антибактериальных [9,18] и противогрибковых [5, 26] средств. Показано также ингибирующее действие на ферменты, особенно на альфа-амилазы млекопитающих [35], циклооксигеназы (ЦОГ) [52], моноаминоксидазы (MAO) [12], лейкотриен В4 [14], тирозиназы [25], редуктазы альдозы [44] и др.
Высокая биологическая активность, проявляемая халконами, способствовала развитию исследований по взаимодействию этих соединений с различными биологическими мишенями.
Основная часть
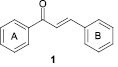
Халконы – это 1,3-дифенил-2-пропен-1-оны (1), в которых два ароматических ядра связаны тремя атомами углерода a,b-ненасыщенной карбонильной системы.
Халконы с хинолиновым фрагментом обладают значительной активностью в отношении ряда микроорганизмов (E. Coli, Aspergillus niger, Bacillus subtiles, Staphylococcus albus, Candida albicans, Rhodolorulla rubera и др.) [4, 19]. Авторы статьи [3] конденсацией замещенных 2-хлор-3-формилхинолинов с различными ароматическими кетонами синтезировали ряд новых халконов, содержащих хлорхинолиновый фрагмент 2, при этом найдено, что некоторые из них проявляют достаточно высокую антималярийную и антиамёбную активность.
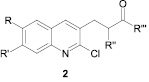
R = H, Me; R′ = H, Me; R″ = H; R‴ = 3-BrC6H4, 4-BrC6H4, 4-ClC6H4, 2-пиридил
S.K. Awasthi с сотрудниками [3] синтезировали несколько новых функционально замещенных халконов и исследовали их в качестве противомалярийных средств. Антималярийные свойства некоторых производных халконов зависят от их способности ингибировать у паразитов фермент цистеинпротеазу [11, 33, 38, 47]. Халконы, являясь a, β-ненасыщенными кетонами, имеют линейную или близкую к планарной структуру. Данная структура является стабильной в условиях действия цистеинпротеазы. Конформация халкона обеспечивает его легкий подход к активному центру фермента.
Соединения с электронодонорными заместителями, например метокси-, гидрокси-группами, показывают наибольшую противомикробную активность [23]. Халконы, содержащие один-два атома хлора или фтора, проявляют высокую противогрибковую и противомикробную активность.
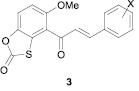
Среди халконов 3, содержащих фрагмент оксатиолона [39], найдены соединения, проявляющие цитотоксичность в отношении раковых клеток человека, а также в отношении Micrococcus luteus, Staphylococcus aureus, Micobacterium tuberculosis H37Rv.
Авторы статьи [16] показали, что основания Манниха, полученные из халконов, проявляют цитотоксичность против линий Р338 и L1210 клеток лейкемии мышей, а также некоторых линий раковых клеток человека. Основания Манниха халконов с гетероциклическим фрагментом исследованы на цитотоксическую активность в отношении четырех линий раковых клеток человека (РС-3, MCF-7, KB, KB-VIN), при этом производные с морфолиновым заместителем при С3 или С5 и с пиридиновым или фенильным ядрами при С2 проявляют высокую цитотоксическую активность.
К интересным свойствам халконов также относятся инициирование апоптоза раковых клеток [42], угнетение их митохондриального дыхания. Авторами статьи [36] отмечено, что халконы с меньшим количеством гидроксильных групп в кольцах А и В являются более эффективными в этом отношении по сравнению с халконами, содержащими больше гидроксильных групп. Такую разницу в активности объясняют кислотностью фенольных ОН-групп. Одним из широко известных механизмов, согласно которому халконы проявляют цитотоксическую активность, является взаимодействие халконов в фазе митоза. Nam N.H. с соавторами [36] изучили активность производных 2′,5′-дигидроксихалконов и обнаружили, что большинство халконов проявляют цитотоксическую активность против различных линий опухолевых клеток (B16 меланома мышей, HCT 116 опухоль толстой кишки человека, А31 эпидермоидная карцинома) и др.
G. Achanta с сотрудниками [1] исследовали ряд халконов, содержащих бор, в качестве противораковых средств и выяснили механизм их действия.
Синтезированы халконы, проявляющие цитостатическую активность [15].
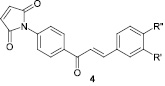
R′ = R″ = H (a), R′ = H, R″ = Cl (б), R′ = H, R″ = Me (в), R′ = R″ = OMe (г), R′ = H, R″ = NO2 (д), R′ = H, R″ = CO2H (e)
Авторами статьи [21, 37] получен ряд халконов, содержащих в бензольном кольце ацетамидную группу в положении 4, среди которых найдены соединения, проявляющие значительную антиноцицептивную активность (в 2 раза больше по сравнению с ацетилсалициловой кислотой и ацетаминофеном).
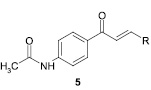
R = Ph, 4-CH3OC6H4, 4-CH3C6H4, 4-ClC6H4, 3,4-Cl2C6H3, 4-NO2C6H4, 4-(CH3)2NC6H4, 2-тиенил, 2-фурил
Дигидроксопроизводные халконов проявляют антиоксидантную активность, которая зависит от структуры соединения [8]. Механизм антиоксидантной активности халконов обсуждается в работе [10]. При взаимодействии молекулы халкона с радикалом образуется феноксидный радикал, при этом орто- и пара-дигидроксилированные системы бензольного кольца являются системами с делокализованными электронами, а поэтому образующиеся из них феноксидные радикалы легко переходят в стабильные семихиноновые радикалы, которые далее превращаются в хиноны. Мета-дигидроксилированная система бензольного кольца менее эффективна для делокализации электронов, вследствие чего феноксидные радикалы не способны вступать в дальнейшие превращения. Установлено, что халконы с орто-(т.е. 2′,3′- и 3′,4′-) и пара- (т.е 2′,5′-) заместителями проявляют очень высокую антиоксидантную активность (80–90 % в сравнении с контролем при концентрации 50 mМ), которая сравнима с активностью аскорбиновой кислоты и a-токоферола. С другой стороны, халконы с мета- (т.е. 2′,4′- и 3′,5′-) заместителями показывают достаточно резкое снижение активности (25 % в сравнении с контролем) при концентрации 200 mМ (IC50 > 200 mМ).
Таким образом, эти данные показывают, что положение двух гидроксильных групп в ядре В является важным структурным фактором их антирадикальной активности, при этом пара-замещенные соединения проявляют большую активность, чем орто-замещенные. Вариация заместителей в пара-положении в кольце А сильно не влияет на антирадикальную активность. Это указывает на то, что электронные эффекты пара-заместителя бензольного кольца не влияют на антирадикальную активность.
Потенциальная антиоксидантная активность некоторых гидроксихалконов была оценена благодаря их способности ингибировать 1,1-дифенил-2-пикрилгидразильные радикалы и свободные гидроксильные радикалы [10]. Для нарингенина и флоретина не обнаружена антипролиферативная активность в отношении клеточной линии рака молочной железы (MCF-7). Но другие халконы (включая 2′-гидроксихалкон) показали антипролиферативную активность при высоких концентрациях (10,50 μМ), а при низких концентрациях (0,01–1 μМ) они ускоряли клеточный рост.
За проявление противовоспалительной активности халконов ответственна α,-β-ненасыщенная карбонильная функциональная группа. H.L. Yadav с сотрудниками [51] синтезировали серию из пяти производных халконов и исследовали их противовоспалительную активность на крысах, у которых был смоделирован каррагениновый отек задней лапы. Производные халконов в дозе 25 мг/кг, введенные перорально, значительно ингибировали развитие отека. Результаты изучения противовоспалительной активности халконов также приведены в статье [50]. Активированные макрофаги играют ключевую роль в противовоспалительных откликах и высвобождении разнообразных медиаторов, включая оксид азота (NO), который является потенциальным сосудорасширяющим агентом, облегчающим миграцию лейкоцитов и образование отека, а также активность лейкоцитов и образование цитокина. NO может также реагировать с супероксидным анионом с образованием пероксинитрита – потенциального окислителя молекул, который способствует нанесению вреда в процессе воспалительного отклика. NO генерируется из L-аргинина под действием NO-синтетазы. Соединения, которые ингибируют избыточное образование NO микрофагами, могут быть полезными для профилактики и лечения автоиммунных заболеваний, септического шока различных воспалительных патологий.
Халконы с заместителями, повышающими электронную плотность В-кольца, например, МеО-, BuO-, Me2N-группы, не проявляют существенной активности в ингибировании процесса образования NO [41]. Триметоксипроизводные халконов с фтором при С4′ являются лучшими ингибиторами образования NO. Трифторметильная группа при С2′ в диметоксихалконах так же хорошо, как и в триметоксихалконах, ингибирует аккумуляцию NO. Трифторметильная группа при С3′ и С4′ в диметоксихалконах проявляет меньшую активность, чем в положении С2′. S.J. Won с соавторами [50] показали, что 2′,4-дигидроксихалкон, 2′-гидрокси-2-тиенилхалкон, 2′-гидрокси-3-тиенилхалкон и 2′,5′-дигидрокси-индол-3-ил-халкон являются потенциальными противовоспалительными агентами.
Гипергликемическая активность халконов исследована в работе [2]. Неинсулинозависимый диабет (диабет II типа) является хроническим метаболическим заболеванием, характеризующимся инсулино-устойчивостью, гипергликемией и гиперинсулинемией. Из Broussonetia papyrifera были выделены замещенные халконы, которые селективно ингибируют ферменты протеинтирозинфосфатазы (PTP1B) и редуктазы альдозы. Их антиоксидантные свойства позволяют рассматривать их в качестве гипергликемических агентов, т.к. окислительный стресс также играет важную роль у диабетиков. 3,4-Диметоксипроизводные проявляют значительный антигипергликемический эффект, в то время как монометоксипроизводные показывают пониженную активность. Соединения вицинально диоксигенированные, например диметокси- и метилендиокси-замещенные, показывают лучшую антигипергликемическую активность по сравнению с соответствующими монометоксипроизводными. Халконы, содержащие цепь пропаноламина в пара-положении показали значительную активность как по сравнению с мета-, так и с орто-замещенными соединениями.
Кроме того, халконы проявляют свойства, схожие с инсулином, что говорит о возможности применения халконов в качестве противодиабетических средств. Так, исследования метилгидроксихалкона, выделенного из корицы, показали, что этот халкон способствует уменьшению темпов развития и осложнений диабета [43].
Авторами статьи [24] была рассмотрена антигепатотоксическая активность халконов. Силимарин, выделенный из семян Silybum marianum, обычно известный как молоко чертополоха, используют в качестве потенциального антигепатотоксичного агента в отношении различных токсикантов. Он представляет собой смесь трех изомеров, а именно силибина, силидианина и силихристина. Силибин – наиболее активный компонент, содержит циклическую систему 1,4-диоксана, в то время как в двух других изомерах эта система отсутствует, и они не играют существенной роли. Производные халконов, содержащие цикл 1,4-диоксана, проявляют антигепатотоксическую активность, которая усиливается наличием в положении 2 диоксанового цикла 2-гидроксиметильной группы. Эта же группа имеется в этом же положении и у силибина. Заместители в ароматическом ядре халконов играют также значительную роль в проявлении данной активности.
Хлорсодержащие халконы проявляют значительную антиплазмодиальную активность, а халконы с триазольным, пиррольным и бензотриазольным кольцами – антипаразитарную активность. Найдено, что хлорпроизводные халконов с морфолиновым циклом обладают наименьшей активностью. Соединения, содержащие триазольное кольцо и хлор, имеют наибольшую антиплазмодиальную активность, подтверждая тот факт, что небольшие по размеру липофильные группы, содержащие один или несколько атомов азота, могут увеличивать антималярийную активность in vitro.
Исследования in vitro антиплазмоидиальной активности замещенных халконов [(4-Cl, 4-MeO, 3,4,5-(MeO)3] показали, что небольшие и средние по размеру липофильные группы, содержащие атомы азота или амин во фрагменте ацетофенона, являются потенциальными противомалярийными агентами. Такие соединения могут обеспечивать дополнительное связывание за счет водородных связей с гистидиновым остатком, присутствующим в активном центре энзима цистеинпротеазы.
Антилейшманиальная активность [22, 29] характерна для халконов с более гидрофильным характером, т.е. для НО-производных халконов, а также для халконов с нафталиновым и пиридиновым фрагментами в ядре А.
Изучена ингибирующая активность тиразиназы ряда халконов в отношении реакций образования меланина и их антиоксидантные возможности [31]. Положение ОН групп в ароматических ядрах А и В имеет очень большое значение, поскольку гидроксилирование по кольцу В приводит к значительно большей способности ингибировать тиразиназу, чем гидроксилирование по кольцу А.
Заключение
В настоящее время имеется достаточно большое количество публикаций, посвященных изучению биологической активности халконов и их производных. В данной статье приведены только лишь некоторые результаты таких исследований. Целенаправленные изменения в структуре халконов могут привести к сужению их спектра биологической активности, но способствовать усилению их фармакологического действия. В этой связи синтез новых функционально замещенных халконов представляет значительный теоретический и практической интерес.
Рецензенты:
Лихтер А.М., д.т.н., профессор, заведующий кафедрой общей физики, ФГБОУ ВПО «Астраханский государственный университет», г. Астрахань;
Алыков Н.М., д.х.н., профессор, заведующий кафедрой аналитической и физической химии, ФГБОУ ВПО «Астраханский государственный университет», г. Астрахань.
Библиографическая ссылка
Степкина Н.Н., Великородов А.В. ЗАВИСИМОСТЬ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ ХАЛКОНОВ ОТ ИХ СТРОЕНИЯ // Фундаментальные исследования. 2015. № 11-3. С. 505-510;URL: https://fundamental-research.ru/ru/article/view?id=39449 (дата обращения: 18.12.2025).
DOI: https://doi.org/10.17513/fr.39449



