Комплексы редкоземельных элементов (РЗЭ) представляют большой практический интерес для современных химических технологий и оптоэлектроники. Полимеризация комплексных соединений РЗЭ приводит к получению новых полимеров и композиций на их основе, полимерные звенья которых содержат эквивалент металла, что обеспечивает не только улучшение многих свойств, присущих мономерам, но и возникновение новых перспективных характеристик. Возможность гомо- и сополимеризации комплексов лантаноидов (III) позволяет получить светотрансформирующие полимеры с заданными свойствами, отличающимися от свойств низкомолекулярных аналогов. Например, установлено, что структура кристаллов акрилата европия (III) и метакрилата тербия (III) представлена бесконечными цепями комплексов РЗЭ, связанных водородными связями и ван-дер-ваальсовым взаимодействием, причем в структуру комплексов входят молекулы воды, участвующие в водородных связях внутри цепи и между бесконечными цепочками полиэдров [2, 3].
В связи с тем, что данные по пространственному и электронному строению полимеров комплексов РЗЭ крайне ограничены, изучение строения кластеров и исходных комплексных соединений очень актуально. Изучение физико-химическими методами особенностей геометрической структуры и электронного строения способствует описанию механизмов электронного возбуждения и фотохимических процессов в молекулярных системах данных классов, что продиктовано необходимостью создания новых наноструктурированных оптоэлектронных материалов для современных устройств мониторинга технологических процессов [6, 7].
Увеличение числа мономерных звеньев в полимерной цепи комплексов РЗЭ приводит к росту влияния дисперсионного взаимодействия, поэтому целью настоящей работы является теоретическое физико-химическое исследование эффекта дисперсионных взаимодействий на геометрическое и электронное строение комплексов M(Acr)3·(H2O)2 (M = Y, La; Acr – акрилат-анион, CH2CHCOO–).
Материалы и методы исследования
Квантово-химические расчеты геометрической структуры и электронного строения комплексов M(Acr)3·(H2O)2 и M2(Acr)6·(H2O)4 проведены в вакуумном приближении методом теории функционала плотности (DFT) с гибридным обменно-корреляционным функционалом PBE0 [1] с помощью программных пакетов GAMESS-US (версия 05.12.2014) [9], FireFly (PC GAMESS) (v8.1, b9035) [4]. Для атомов иттрия и лантана использован Штутгартский псевдопотенциал и базис ECP28MWB(Y) и ECP46MWB(La) [8], для других атомов взят базис 6-31G(d,p). В качестве начального приближения при оптимизации геометрии использованы экспериментальные геометрические параметры комплекса европия(III) аналогичного состава [2]. Условие минимума энергии молекулы проверялось по гессиану. Дисперсионные энергетические поправки в основном состоянии комплексов учтены в рамках эмпирических соотношений Гримме с помощью метода DFT-D3 [5], который позволяет корректно учитывать межмолекулярное взаимодействие комплексных соединений и молекул растворителя. Результаты расчетов визуализировались с помощью программы Chemcraft 1.8 (b436) [10].
Результаты исследования и их обсуждение
Для проведения квантово-химического моделирования звена полимера геометрические параметры биметаллического фрагмента были взяты из экспериментальной геометрической структуры аналогичного комплекса европия (III), содержащей два иона РЗЭ, шесть акрилат-анионов и четыре молекулы воды. Установлено, что оптимизированные геометрические структуры комплексов Y2(Acr)6·(H2O)4 (I) и La2(Acr)6·(H2O)4 (II) подобны (рис. 1).
Акрилат-анионы в изоструктурных комплексах I и II можно разделить на два типа: бидентантные (Б), связанные с одним ионом РЗЭ (например, акрилат-анион с атомами углерода C1–C3), и бидентантно-мостиковые (БМ), связанные с двумя ионами РЗЭ (C4–C6).
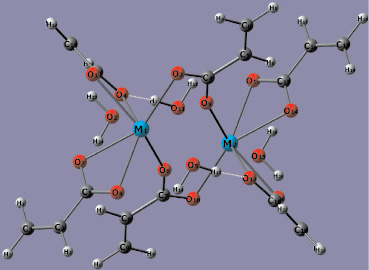
Рис. 1. Оптимизированная геометрическая структура комплексов М2(Acr)6·(H2O)4.
Таблица 1
Рассчитанные длины связей (Å), полная энергия Еполн (а.е.) комплексов М2(Acr)6·(H2O)4
|
Связь Еполн |
Y2(Acr)6∙4H2O |
La2(Acr)6∙4H2O |
||||
|
DFT |
DFT–D3 |
Δ а |
DFT |
DFT–D3 |
Δ |
|
|
М1–М2 |
3,962 |
3,940 |
–0,022 |
4,293 |
4,281 |
–0,012 |
|
М1–O7 |
2,375 |
2,367 |
–0,008 |
2,592 |
2,587 |
–0,005 |
|
М1–O8 |
2,486 |
2,477 |
–0,009 |
2,529 |
2,519 |
–0,010 |
|
O7–C1 |
1,264 |
1,265 |
0,001 |
1,266 |
1,267 |
0,001 |
|
O8–C1 |
1,273 |
1,272 |
–0,001 |
1,276 |
1,275 |
–0,001 |
|
C1–C2 |
1,486 |
1,485 |
–0,001 |
1,486 |
1,485 |
–0,001 |
|
C2–C3 |
1,333 |
1,333 |
0,000 |
1,332 |
1,332 |
0,000 |
|
М1–O3 |
2,377 |
2,375 |
–0,002 |
2,579 |
2,584 |
0,005 |
|
М1-O9 |
2,531 |
2,512 |
–0,019 |
2,653 |
2,633 |
–0,020 |
|
М2–O9 |
2,299 |
2,292 |
–0,007 |
2,503 |
2,500 |
–0,003 |
|
O3–C4 |
1,252 |
1,251 |
–0,001 |
1,253 |
1,252 |
–0,001 |
|
O9–C4 |
1,287 |
1,287 |
0,000 |
1,290 |
1,291 |
0,001 |
|
C4–C5 |
1,478 |
1,477 |
–0,001 |
1,480 |
1,479 |
–0,001 |
|
C5–C6 |
1,333 |
1,333 |
0,000 |
1,333 |
1,333 |
0,000 |
|
Еполн |
–1980, 398798 |
–1980, 451765 |
–0,052967 |
–1966, 879675 |
–1966, 928542 |
–0,048867 |
Примечание. а Δr = r(DFT-D3) – r(DFT), ΔЕполн = Еполн(DFT–D3) – Еполн(DFT).
Таблица 2
Рассчитанные заряды на атомах (по Малликену), дипольный момент µ (Д) и энергии εi (эВ) граничных MO комплексов М2(Acr)6·(H2O)4
|
Атом/µ/ε |
Y2(Acr)6∙4H2O |
La2(Acr)6∙4H2O |
||||
|
DFT |
DFT–D3 |
Δ а |
DFT |
DFT–D3 |
Δ |
|
|
М1 |
0,893 |
0,886 |
–0,007 |
1,401 |
1,400 |
–0,001 |
|
М2 |
0,890 |
0,883 |
–0,007 |
1,400 |
1,399 |
–0,001 |
|
O7 |
–0,537 |
–0,537 |
0,000 |
–0,577 |
–0,578 |
–0,001 |
|
O8 |
–0,597 |
–0,593 |
0,004 |
–0,621 |
–0,618 |
0,003 |
|
C1 |
0,652 |
0,650 |
–0,002 |
0,605 |
0,603 |
–0,002 |
|
C2 |
–0,163 |
–0,160 |
0,003 |
–0,147 |
–0,146 |
0,001 |
|
C3 |
–0,269 |
–0,271 |
–0,002 |
–0,267 |
–0,268 |
–0,001 |
|
O3 |
–0,524 |
–0,523 |
0,001 |
–0,565 |
–0,562 |
0,003 |
|
O9 |
–0,606 |
–0,606 |
0,000 |
–0,703 |
–0,706 |
–0,003 |
|
C4 |
0,709 |
0,709 |
0,000 |
0,665 |
0,663 |
–0,002 |
|
C5 |
–0,160 |
–0,156 |
0,004 |
–0,159 |
–0,157 |
0,002 |
|
C6 |
–0,266 |
–0,267 |
–0,001 |
–0,264 |
–0,265 |
–0,001 |
|
µ |
0,003 |
0,003 |
0,000 |
0,006 |
0,008 |
0,002 |
|
εВЗМО |
–7,763 |
–7,747 |
0,016 |
–7,698 |
–7,698 |
0,000 |
|
εНВМО |
–1,151 |
–1,165 |
–0,014 |
–1,121 |
–1,154 |
–0,033 |
|
Δεб |
6,612 |
6,582 |
–0,030 |
6,577 |
6,544 |
–0,033 |
Примечание. а Δq = q(DFT–D3) – q(DFT), Δµ = µ(DFT–D3) – µ(DFT); б Δε = ε(DFT–D3) – ε(DFT).
При учете дисперсионных поправок полная энергия системы понижается на 0,053 а.е. (I) и 0,049 а.е. (II), наибольшие изменения наблюдаются у длин связей металл-металл и металл-кислород, а связи внутри лигандов изменяются незначительно (табл. 1).
Очевидно, что при моделировании полимерных цепочек комплексов РЗЭ увеличение размера молекулярного кластера приведёт к росту дисперсионного взаимодействия, поэтому его учет необходим для получения корректных геометрических характеристик макромолекулярных систем комплексов РЗЭ.
Учет дисперсионного взаимодействия приводит к незначительному перераспределению электронной плотности в молекулярных системах I и II, причем заряд иона с меньшим ионным радиусом (иттрий) изменяется больше, как и длина связи металл-металл (табл. 2). Изменение дипольного момента в I и II также незначительно, поскольку рассмотренные системы характеризуются низкой полярностью, дипольный момент равен 0,003 и 0,008 Д соответственно.
Согласно проведенным расчетам, при учете дисперсионных поправок верхняя занятая молекулярная орбиталь (ВЗМО) (номер 142) дестабилизируется, а нижняя вакантная МО (НВМО) (143) стабилизируется, в результате чего разность энергий граничных МО уменьшается на 0,03 эВ для обеих систем (табл. 2).
При учете дисперсионного взаимодействия вклады атомных орбиталей (АО) акрилат-анионов в МО комплекса изменяются намного больше для комплекса II по сравнению с комплексом I (рис. 2). Включение дисперсионных поправок в схему расчета приводит к значительному перераспределению вкладов АО в МО и увеличивает вклады АО бидентантных акрилат-анионов в граничные МО комплексов. Большой рост вкладов АО бидентантно-мостиковых акрилат-анионов в НВМО приводит к её стабилизации. Таким образом, увеличение ионного радиуса РЗЭ связано с увеличением числа электронов и с ростом влияния дисперсионного взаимодействия в молекулярной системе.
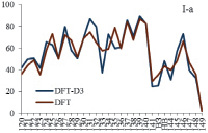

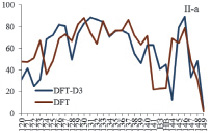
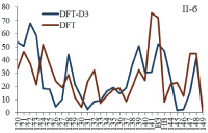
Рис. 2. Вклады АО бидентантных (а) и бидентантно-мостиковых (б) акрилат-анионов в МО (номера 120–149) комплексов М2(Acr)6·(H2O)4 (M = Y (I), La (II))
Выводы
Методом функционала плотности DFT/PBE0/ECPMWB в вакуумном приближении рассчитаны геометрическая структура и электронное строение комплексов иттрия и лантана М2(Acr)6·(H2O)4. Показано, что учет дисперсионных поправок в квантово-химических расчетах акрилатов данных РЗЭ позволяет получить более корректные геометрические характеристики комплексов, при этом длины связей внутри лигандов практически не изменяются. Включение дисперсионного взаимодействия в схему расчета не приводит к значительному перераспределению электронной плотности в рассмотренных слабополярных молекулярных системах. Энергия ВЗМО возрастает, а НВМО снижается, энергетическая щель уменьшается на 0,03 эВ. При квантово-химическом моделировании наноструктурированных молекулярных систем на основе комплексов РЗЭ для корректного описания физико-химических свойств и технологических процессов необходим учет дисперсионной поправки, поскольку увеличение ионного радиуса РЗЭ и рост размеров молекулярного кластера приводят к увеличению дисперсионного взаимодействия в системе.
Работа проводилась при финансовой поддержке «Стипендии имени Гензо Шимадзу» и Министерства образования и науки Российской Федерации в рамках государственного контракта № 2015/36 с Дальневосточным федеральным университетом (проект № 1137).
Рецензенты:
Кавун В.Я., д.х.н., заведующий лабораторией химической радиоспектроскопии, ФГБУН «Институт химии» ДВО РАН, г. Владивосток;
Мирочник А.Г., д.х.н., заведующий лабораторией светотрансформирующих материалов, ФГБУН «Институт химии» ДВО РАН, г. Владивосток.
Библиографическая ссылка
Харченко В.И., Курбатов И.А., Чередниченко А.И. ВЛИЯНИЕ ДИСПЕРСИОННОГО ВЗАИМОДЕЙСТВИЯ НА ЭЛЕКТРОННОЕ СТРОЕНИЕ АКРИЛАТОВ ИТТРИЯ И ЛАНТАНА: КВАНТОВО-ХИМИЧЕСКОЕ ИССЛЕДОВАНИЕ // Фундаментальные исследования. 2015. № 10-1. С. 102-106;URL: https://fundamental-research.ru/ru/article/view?id=39131 (дата обращения: 23.01.2026).



