На протяжении нескольких десятилетий коллаген, его строение и свойства являются весьма популярной темой исследований российских и зарубежных ученых. Он получил широкое применение в медицине, полиграфии, пищевой, комбикормовой и микробиологической промышленностях [1, 4]. Во всем мире традиционно получение коллагена из спилка шкур крупного рогатого скота (КРС). Однако из-за болезни бешенства и угрозы передачи вируса человеку встал вопрос о поиске альтернативных источников. В 2000 г. в Европе стартовал большой проект, объединивший семь компаний и научных институтов по изучению коллагена из отходов переработки морских рыб.
В России в связи с санкциями Евросоюза, США и других сторонников существенно сократился импорт рыбного сырья и продуктов. Поэтому актуален поиск замены зарубежного сырья на отечественное. По мнению авторов [3, 10, 9], источниками коллагена могут служить побочные продукты и отходы при глубокой переработке прудовых рыб. Использование таких источников содействует охране окружающей среды и отвечает принципам ресурсосбережения и инновационности технических решений. Максимальное и рациональное использование рыб внутренних водоемов поддерживается Правительством РФ, об этом свидетельствуют важнейшие стратегические документы: «Водная стратегия Российской Федерации на период до 2020 года», «Стратегия развития рыбохозяйственного комплекса Российской Федерации на период до 2020 года». Обозначенные направления развития отрасли получили должное внимание и на региональных уровнях. Исследования проводили в Воронежском государственном университете инженерных технологий, в рамках Государственного задания № 2014/22 НИР № 3017.
Материалы и методы исследования
В качестве объектов исследования использовали шкуры наиболее распространенных в ЦЧР прудовых рыб: сазана, толстолобика, щуки. Объекты сравнивали со спилком шкур крупного рогатого скота, производимого на территории Тверской области. Рыбы вылавливали в осенней период массой 700–1500 г. Шкуры отделяли вручную в лабораторных условиях при предварительном снятии чешуи, отделении хвоста, головы, жабр, плавников, зачистки внутренней поверхности от жировых тканей и прирезей мышечной ткани.
Гистоморфологические исследования проводили методом получения ультратонких срезов с дальнейшим окрашиванием по методу импрегнации серебром по Шультце в модификации Гольджи [8]. Физико-химические свойства рыбных коллагенов, имеющих практическое значение в получении лекарственных средств (подлинность – качественная реакция; прозрачность, цветность, вязкость, массовая доля сухих веществ – ГФ ХI; рН – ГФ ХI и потенциометрически, массовая доля коллагена – ГОСТ 23401-78 «Метод определения оксипролина» [2, 7, 6]), определяли в соответствии с фармакопейной статьей предприятия (ФСП-42-1221-06 1 ЗАО «Лужский завод «Белкозин») [7]. В коллагеновых дисперсиях определяли фракционный состав белков на основании их растворимости по методам [2], электрофоретическую подвижность и молекулярную массу на установке вертикального электрофореза в денатурирующих условиях с использованием маркерных белков AppliChem (ProductNo.A4402), в соответствии с инструкцией к прибору. Структурные особенности по спектру поглощения в инфракрасной области идентифицировали на аппарате Vertex 70 [5].
Результаты исследования и их обсуждение
При проведении гистоморфологических исследований готовили ультратонкие поперечные срезы шкур рыб с последующим окрашиванием и микроскопированием объектов. Как видно на рис. 1, рыбные шкуры в дермальном слое обнаруживали рыхлые структуры соединительнотканных волокон и меньшую толщину по сравнению со спилком шкур животных (КРС), что объективно связано с видовой принадлежностью объектов исследования.
Данные определения фракционного состава белков (табл. 1) доказывают превалирование щелочерастворимой фракции во всех объектах, что свидетельствует о наличии соединительнотканных волокон белковой природы, отчетливо видных на микроструктурных срезах.
Для предварительной оценки технологической пригодности коллагенов реализовали известную технологию, применяемую в условиях ЗАО «Лужский завод «Белкозин» в лабораторных условиях с учетом авторской коррекции параметров процессов для получения дисперсии [9].
Сравнительные данные по реализации усовершенствованной технологии коллагеновой дисперсии из рыбного сырья и дисперсии, полученной и спилка шкур крупного рогатого скота, представлены в табл. 2.
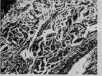



а) б) в) г)
Рис. 1. Микроструктура дермальных слоев шкур в поперечном срезе. Увеличение ×200. Окраска по Гольджи : а) спилок шкуры КРС б) щуки в) сазана г) толстолобика
Таблица 1
Фракционный состав шкур рыб и спилка КРС
|
Сырье |
Массовая доля белковых фракций, % к массе белка |
||
|
Водорастворимая |
Солерастворимая |
Щелочерастворимая |
|
|
Гольевой спилок КРС |
5,5 |
9,5 |
86 |
|
Шкуры рыб |
|||
|
Щука |
5,73 |
9,55 |
84,71 |
|
Сазан |
5,48 |
9,16 |
85,34 |
|
Толстолобик |
3,47 |
5,78 |
90,74 |
Как видно из данных табл. 1, дисперсии близки по свойствам, но имеют и некоторые отличия, связанные, по всей вероятности, с особенностями структуры коллагенов.
Использование аппарата Vertex 70 для идентификации структурных особенностей коллагена по спектру их поглощения в инфракрасной области дает возможность прямого измерения жидких, твердых субстанций без дополнительного выделения или получения таблетки с калием бромидом, что позволяет провести эксперимент быстро, не разрушая анализируемые структуры. Измерение проводили в среднем диапазоне волн в области от 4000 до 400 см-1.
В ходе экспериментальных исследований обнаружены характерные полосы поглощения: 3335 – 2908, 2404 – 16551611,1502,1493,1211,893,611 см-1, что соответствует соединениям типа (CH3,С-H) (3335-2908); (NO2,N-C≡N)(2404-1655); (C=0,NO2)(1611); (C-C-H)(1431,1211); (893-623) (-C-C,≡C-H). Эти данные подтверждают молекулярную природу коллагена (рис. 2).
Таблица 2
Сравнительные характеристики субстанций из спилка КРС и шкуры толстолобика
|
Показатель |
Субстанция 2 %-го раствора (спилок КРС) |
Субстанция 2 %-го раствора (шкура толстолобика) |
|
Подлинность |
Окрашивание в фиолетовый цвет |
Окрашивание в фиолетовый цвет |
|
Прозрачность |
Прозрачный |
Прозрачный |
|
Цветность |
0,1 %-й раствор коллагена в воде бесцветен |
0,1 %-й раствор коллагена в воде бесцветен |
|
рН |
3,2 |
4,8 |
|
Массовая доля сухих веществ |
1,85 % |
1,76 % |
|
Микробиологическая чистота |
Категория 1.2. Б |
Категория 1.2. Б |
|
Массовая доля коллагена |
1,75 |
0,92 |

Рис. 2. ИК-спектроскопия коллагена
Результаты электрофоретической подвижности (рис. 3) указывают на отличие в структуре, а следовательно, в функциях коллагенов различного происхождения. На элетрофореграммах видно, что миграция белков из спилка шкур крупного рогатого скота находится на границе 212 КДа и выше с небольшим содержанием компонентов при значениях молекулярной массы 60–212 кДа. Рыбные коллагены также характерны наличием высокомолекулярных фракций на уровне 212 КДа с более выраженным содержанием белков при значениях молекулярной массы 40–212 кДа. Такая характеристика рыбных коллагенов совпадает с данными польских и украинских авторов об особенностях строения рыбных коллагенов [3].
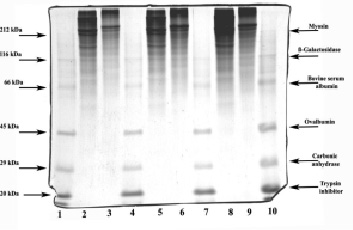
Рис. 3. Электрофореграммы коллагеновых субстанций животного и рыбного происхождения: дорожки 1, 4, 7, 10 – маркеры молекулярной массы; дорожки 2, 5, 8 – образец, полученный из шкуры рыб; дорожки 3, 6, 9 – образец, полученный из спилка шкуры КРС
Таблица 3
Скорость выплавления желатина
|
Виды отходов |
Выплавленный желатин, % от сухого вещества |
|||
|
время обработки, мин |
||||
|
15 |
30 |
45 |
60 |
|
|
Гольевой спилок шкур КРС (по Сапожниковой А.И., Месроповой Н.В.) |
36,28 |
55,63 |
73,89 |
88,02 |
|
Шкуры рыб |
42,89 |
72,11 |
84,97 |
86,0 |
Особенности структуры проявляются в более глубокой выплавке желатина, протекающей в более короткий временной период, в случае объектов рыбного происхождения (табл. 3).
Заключение
Проведенные гистоморфологические исследования и анализ фракционного состава вторичного сырья животного и рыбного происхождения, показал наличие коллагена в обоих случаях.
Были получены коллагеновые дисперсии, близкие по свойствам, но имеющие и различия, связанные с особенностями строения.
В ходе проведения ИК-спектроскопии коллагена, были обнаружены характерные полосы, соответствующие соединениям типа (CH3,С-H); (NO2,N-C≡N); (C=0,NO2); (C-C-H); (-C-C,≡C-H), что подтверждает его молекулярную структуру.
Электрофоретическое фракционирование показало, что белки коллагеновых субстанций представляют собой гетерогенные системы с различной подвижностью фракций под действием электрического поля. Рыбные коллагеновые субстанции состоят из белковых фракций, молекулярная масса которых находится в диапазоне от 212 до 20 кДа.
Структурные особенности влияют на химические свойства. Выплавка желатина протекает быстрее в случае рыбного сырья, что говорит о коллагене, полученном из шкуры рыб, как о достойном конкуренте животному аналогу.
Рецензенты:
Попова Т.Н., д.б.н., профессор, зав. кафедрой медицинской биохимии и микробиологии, ФГБОУ ВПО «ВГУ», г. Воронеж;
Дерканосова Н.М., д.т.н., профессор, зав. кафедрой товароведения и экспертизы товаров, декан факультета технологии и товароведения, ФГБОУ ВПО «Воронежский ГАУ», г. Воронеж.
Библиографическая ссылка
Антипова Л.В., Сторублевцев С.А., Болгова С.Б., Сухов И.В. ПОЛУЧЕНИЕ, ИДЕНТИФИКАЦИЯ И СРАВНИТЕЛЬНЫЙ АНАЛИЗ РЫБНЫХ КОЛЛАГЕНОВ С АНАЛОГАМИ ЖИВОТНОГО ПРОИСХОЖДЕНИЯ // Фундаментальные исследования. 2015. № 8-1. С. 9-13;URL: https://fundamental-research.ru/ru/article/view?id=38837 (дата обращения: 12.02.2026).



