Планарии являются классической модельной системой для изучения регенерации и биологии стволовых клеток [17, 18, 23]. Предлагается даже использовать планарий в качестве удобного объекта для изучения биологии стволовых клеток студентами [26]. Однако данные о потенциальной способности к регенерации разных частей тела планарии фрагментарные и часто противоречивые [9, 11, 23]. Известно, что после травмы необласты фагоцитируют, пролиферируют и мигрируют, образуя непигментированный бутон регенерирующей ткани – бластему [11, 20], но мнения исследователей расходятся в вопросах оптимизации условий эксперимента, изменения размеров регенерирующего фрагмента в процессе регенерации, взаимовлияния головных и хвостовых бластем и т.д. [7, 9, 11, 18, 21, 23, 26]. Другими словами, надежные количественные оценки регенеративных возможностей различных фрагментов тела Girardia tigrina отсутствуют.
Целью работы было сравнение бластем, формирующихся на отдельных частях тела планарии Girardia (Dugesia) tigrina. Ниже будет показано значение размеров и позиционных различий отдельных фрагментов тела планарии в их способности к регенерации, а также принципиальное различие в механизмах формирования головных и хвостовых бластем. Предложенная схема регенерации включает две популяции плюрипотентных стволовых клеток – необластов, различающихся как ролью, так и распределением вдоль тела планарии.
Материалы и методы исследования
В экспериментах использовали бесполую расу пресноводных червей – планарий D. (Girardia) tigrina. Планарий содержали в аквариумной воде при жесткости dH ≈ 1,0–2,0 мг экв/л, рH ≈ 6,5 и температуре 26 °С. Кормили личинками двукрылых. Для экспериментов отбирали животных длиной 10–11 мм после недельного голодания [2, 5]. Регенерацию вызывали ампутацией некоторой части тела планарии. В каждой серии экспериментов обычно использовали по 30 особей, помещаемых в пластиковую чашку Петри (d = 40 мм), содержащую 13 мл аквариумной воды. Для количественной оценки результата регенерации использовали метод прижизненной компьютерной морфометрии, основанный на регистрации фотоконтраста между старыми и новыми частями тела регенерирующей планарии [2, 5, 6, 7]. Площади проекции бластем измеряли через 72 ч после операции. Изображения планарий получали с помощью бинокулярного микроскопа Stemi 2000-C, оснащенного цифровой видеокамерой AxioCamMRc (фирма Carl Zeiss). Оцифрованные изображения регенерирующих планарий обрабатывали в программе Plana 5.0 [3, 4]. Значения длин и площадей проекции бластемы и регенерирующего фрагмента обрабатывали в программе Microsoft Office Excel 2010. Для каждой модели регенерации (М1–М11), представляющей группу из 22–28 регенерирующих фрагментов, определяли среднее значение параметра и стандартное отклонение от среднего.
Схематические изображения моделей регенерации (М1–М11) и планарии G. tigrina (рис. 1) позволяют оценить размеры и положение каждого регенерирующего фрагмента относительно головного конца.
На основании значений длин и площадей проекций регенерирующих фрагментов вычисляли координаты раневых поверхностей относительно головного конца. В качестве количественного критерия развития бластемы использовали абсолютное значение площади проекции бластемы s или относительное значение размера бластемы, введенное ранее как коэффициент регенерации R = (s/S) 100 %, где S – площадь проекции бластемы, s – площадь проекции регенерирующего фрагмента [2, 5]. При этом было показано, что увеличение площади проекции бластемы является результатом пролиферации и миграции плюрипотентных стволовых клеток через раневую поверхность. [2, 5]. Экспериментальные результаты и дальнейшие рассуждения приведены в предположении о пропорциональности объемов бластем и регенерирующих фрагментов соответствующим регистрируемым площадям проекций [3, 4]. Модели М1 и М9, М2 и М10, а также М3 и М11 получали из одной особи одним рассечением. Для получения моделей М4–М8 на первом этапе ампутировали хвостовой конец, а затем у продолжающей равномерное движение планарии удаляли головной конец. Для получения моделей М4 и М5, а также М7 и М8 также использовали по одному фрагменту. При этом в экспериментах вместо 330 использовали только 180 планарий, из которых удалось получить 277 качественных изображений регенерирующих фрагментов (рис. 1).
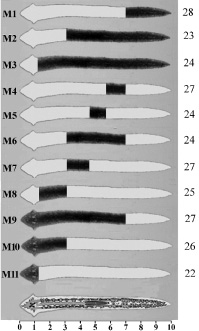
Рис. 1. Модели регенерации планарий. Цифры справа от изображений означают количество фрагментов, использованных в экспериментах на соответствующих моделях. Номера моделей от М1 до М11 проставлены слева перед схематическими изображениями фрагментов. Регенерирующие фрагменты окрашены в тёмные цвета, а ампутированные части – в светлые. Внизу рисунка представлена схема строения планарии, включающая глаза, нервные ганглии, нервные стволы, ветви кишечника и глотку, а также линейка, позволяющая оценивать расстояния от головного конца до места отсечения
Результаты исследования и их обсуждение
Определены регенерационные возможности 11 фрагментов, полученных посредством пяти сечений тела планарии на разных расстояниях от головного конца. Площади проекции регенерирующих фрагментов, представленных на рис. 1, составляли относительно интактной особи от 83 % у модели М3, до 11 % у модели М5, площадь проекции бластемы не превышала 2,7 %. Площади проекции головных бластем sг у всех фрагментов были больше площадей хвостовых бластем sх. Минимальная площадь хвостовой бластемы sх составила 0,2 % у модели М5, а максимальная площадь головной бластемы sг достигала 2,7 % в модели М3.
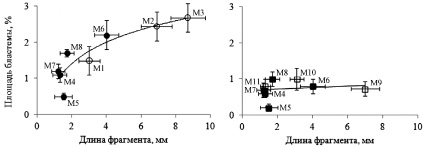
Максимальная сумма площадей головной и хвостовой бластем составила 3,0 % у модели М6. У фрагментов, имеющих одну головную бластему (М1–М3), площади бластем были пропорциональны площадям соответствующих регенерирующих фрагментов, а у фрагментов, имеющих одну хвостовую бластему (М9–М11), площади бластем не зависели от площадей регенерирующих фрагментов. У модели М6 сумма площадей двух бластем составляла абсолютный максимум развития бластем. Эта модель обладала самой большой площадью регенерирующего фрагмента из моделей, имеющих две раневые поверхности. Площади головных бластем как у однобластемных, так и у двухбластемных регенерирующих фрагментов существенно менялись вдоль тела планарии. Максимальный размер головной бластемы был зарегистрирован вблизи головного конца, а минимальный – у хвостового конца. Размеры головных бластем у всех регенерирующих фрагментов (М1–М8) увеличивались по мере увеличения длин соответствующих регенерирующих фрагментов, а размеры хвостовых бластем у всех регенерирующих фрагментов (М4–М11) были одинаковыми и не зависели от величины фрагментов. Зависимости площадей головных sг и хвостовых бластем sх от длин регенерирующих фрагментов представлены на рис. 2.
а б
Рис. 2. Зависимости площадей головных (а) и хвостовых (б) бластем от длин регенерирующих фрагментов: ○ – площади головных бластем sг, □ – площади хвостовых бластем sх. Площади головных и хвостовых бластем, развивающиеся на двухбластемных фрагментах, обозначены залитыми маркерами. M1–M11 – номера соответствующих моделей
Таким образом, результаты измерений свидетельствуют о том, что размеры головных бластем увеличивались по мере увеличения размеров соответствующих регенерирующих фрагментов, а размеры хвостовых бластем практически не зависели от размеров регенерирующих фрагментов и не имели позиционных различий. Эти результаты указывают на различные механизмы формирования головных и хвостовых бластем. Для объяснения полученных результатов необходимо рассмотреть строение планарии и последовательность событий, приводящих к развитию бластем в процессе регенерации.
Планария на 70–80 % состоит из нескольких типов дифференцированных клеток, в частности нескольких типов нейронов, нейросекреторных клеток, рецепторных клеток, различных мышечных клеток, эпителиальных клеток поверхности, клеток кишечного эпителия и клеток выделительной системы – нефридий. Остальные 20–30 % клеток в теле планарии составляют стволовые клетки – необласты [17, 19, 23], которые являются источником всех без исключения клеток взрослого организма планарии. Все необласты способны к пролиферации и, в частности, экспрессируют ген smedwi-1, который кодирует белок семейства PIWI. Этот ген служит каноническим маркером всех необластов [19, 23]. Кроме того, в некоторых необластах экспрессировались и гены тканеспецифических факторов транскрипции, в частности гены, специфичные для мышечной ткани, различных нейронов, зрительных рецепторов, нефридий и т.д. Идентифицирована большая коллекция факторов транскрипции (более 40 генов), экспрессирующихся в небольших подмножествах необластов, участвующих в регенерации [20, 23, 25]. Нервная система планарии состоит из головного ганглия и двух нервных стволов, проходящих вдоль всего тела и соединённых перемычками, образуемыми аксонами нейронов периферических ганглиев. В головном ганглии сосредоточены тела эффекторных нейронов, аксоны которых проходят внутри нервных стволов и оканчиваются на мышцах во всём объёме планарии. Необласты, мышечные клетки, поверхностные эпителиальные клетки, клетки кишечного эпителия, а также клетки нефридий практически равномерно распределены вдоль тела планарии [1, 17, 23]. Эти особенности анатомического строения планарии во многом, как будет показано ниже, определяют процесс регенерации. Схема первичных этапов регенерации представлена на рис. 3.
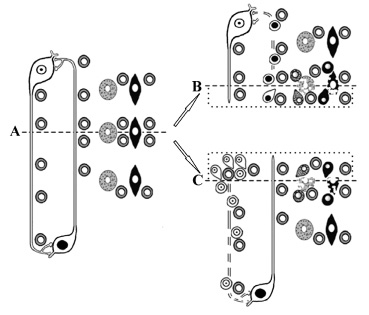
Рис. 3. Схема специализации необластов при поперечном рассечении планарии: А – интактная планария. Головной конец вверху; В – формирование хвостовой бластемы на головном фрагменте; С – формирование головной бластемы на хвостовом фрагменте
Важнейший шаг в процессе регенерации планарий – первичная специализация необластов, формирующих бластему [19, 20, 23, 25]. В процессе регенерации первичные необласты (аналог тотипотентных стволовых клеток) преобразуются, прямо или опосредованно, в специализированные необласты (аналог мультипотентных стволовых клеток) [12, 19].
На рис. 3 интактная планария (А) схематически изображена в виде центрального и периферического нейронов, неспециализированных необластов, клеток нефридий и мышечных клеток. Рассечение по пунктирной линии приводит к повреждению аксонов как центральных, так и периферических нейронов, мембран клеток нефридий и мышечных клеток, расположенных по линии рассечения. При этом образуются фрагменты: головной регенерирующий фрагмент (В) и хвостовой регенерирующий фрагмент (С). На головном регенерирующем фрагменте формируется хвостовая бластема, а на хвостовом регенерирующем фрагменте – головная бластема.
Механическая травма приводит к повреждению плазматических мембран клеток, прилегающих к раневой поверхности, к утечке ионов калия в межклеточную среду и деполяризации неповрежденных мышечных клеток, что вызывает сокращение мышц и закрытие раны в течение нескольких минут [13]. Наличие щелевых межклеточных контактов позволяет деполяризации распространиться на расстояние нескольких размеров клетки [14, 15, 18], что для животных клеток обычно не превышает 0,5 мм [16]. Важность этого типа межклеточной коммуникации показали с помощью блокады щелевых контактов, приводящей к нарушению регенерации [10, 15, 18]. Деполяризация, распространяющаяся через щелевые контакты от механически поврежденных клеток, приводит к изменению ионного состава интактных клеток. Для интактных клеток, соединённых с повреждёнными клетками проницаемыми контактами, рассечение планарии эквивалентно увеличению пассивной проницаемости плазматической мембраны или уменьшению активности Na-K-АТФазы, что приводит к увеличению внутриклеточных активностей ионов натрия и кальция, а также к уменьшению внутриклеточного калия [14, 15, 22]. Развивающийся окислительный стресс модулирует экспрессию генов, связанных с травмой, индуцирует гибель повреждённых клеток, пролиферацию и первичную специализацию необластов [12, 13, 23]. Клетки, механически поврежденные при фрагментировании тела планарии, гибнут по механизму некроза или апоптоза. Некроз проявляется в набухании, денатурации и коагуляции цитоплазматических белков, разрушении клеточных органелл и, наконец, всей клетки. Клетки, следующие механизму программируемой клеточной гибели, фрагментируются на отдельные апоптотические тельца, ограниченные плазматической мембраной, а затем уничтожаются по механизму каспаза – независимого апоптоза, называемого аутофагией. Фрагменты погибших клеток фагоцитируются близлежащими необластами в течение 1–3 часов [19, 23].
Отметим, что любая поперечная перерезка тела планарии создает асимметрию регенерирующих фрагментов по некоторым типам повреждённых клеток. На границе раневой поверхности головного регенерирующего фрагмента (В) имеются повреждённые клетки нефридий, мышечные клетки и необласты, а в глубине регенеранта располагаются тела центральных нейронов с повреждёнными аксонами и аксоны периферических нейронов, лишённые клеточных тел. Вблизи раневой поверхности хвостового регенерирующего фрагмента (С) также находятся повреждённые клетки нефридий, мышечные клетки и необласты, а в глубине – повреждённые аксоны центральных нейронов, а также тела и повреждённые аксоны периферических нейронов. Некоторая часть клеток нефридий, мышечных и эпителиальных клеток, а также необластов в глубине обоих фрагментов (В и С) не повреждается. Нарушение целостности плазматических мембран центральных и периферических нейронов, необластов, клеток нефридий, мышечных и эпителиальных клеток приводит к деполяризации мембран этих клеток и развитию окислительного стресса. Через щелевые контакты или межклеточную среду будут активированы необласты, расположенные на расстоянии до 0,5 мм [14, 16, 22] от поврежденных брюшных нервных стволов, т.е. практически необласты будут активироваться во всем объеме обоих регенерирующих фрагментов, что и наблюдается в эксперименте [25].
Неспециализированные необласты в головном регенерирующем фрагменте (В), фагоцитируют повреждённые эпителиальные и мышечные клетки, специализируются, пролиферируют и мигрируют в хвостовую бластему. В формировании хвостовой бластемы принимают участие также необласты, получившие первичную специализацию в процессе фагоцитоза аксонов периферических нейронов, прорастающие аксоны центральных нейронов, а также неспециализированные необласты. В хвостовом регенерирующем фрагменте (С) неспециализированные необласты фагоцитируют повреждённые эпителиальные и мышечные клетки, а также повреждённые аксоны центральных нейронов, специализируются, пролиферируют и мигрируют в головную бластему. В головную бластему также мигрируют неспециализированные необласты и прорастают аксоны периферических нейронов.
Результаты наших экспериментов, представленные на рис. 2, убедительно показали, что объём головной бластемы в значительной степени зависит от длины регенерирующего фрагмента. Если допустить, что объём необластов, мигрирующих в бластему пропорционально объёму фагоцитированных клеточных фрагментов, следует признать, что в формировании головной бластемы (рис. 3, С) существенный вклад вносят необласты, получившие первичную специализацию при фагоцитировании повреждённых клеточных элементов в глубине регенерирующего фрагмента, т.е. аксонов центральных нейронов. Отметим, что только объём повреждённых аксонов центральных нейронов, в отличие от всех других тканей, растёт с увеличением длины регенерирующего хвостового фрагмента, а размеры хвостовой бластемы, формирующейся на головном регенерирующем фрагменте (В), не зависят от количества повреждённых аксонов периферических нейронов и количества прорастающих аксонов центральных нейронов.
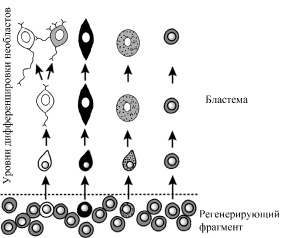
Рис. 4. Схема специализации и дифференцировки необластов в бластеме
Дальнейшая специализация необластов происходит в бластеме. Недифференцированные клетки бластемы являются потомством разных необластов. Как в головной, так и в хвостовой бластеме присутствуют необласты, прошедшие первичную специализацию на нервные клетки, мышечные клетки, клетки нефридиев и неспециализированные необласты (рис. 4).
Очевидно, что только головная бластема содержит специализированные необласты, участвующие в формировании центральной нервной системы или глаз. Другие специализированные необласты, необходимые, в частности, для формирования мышечной, пищеварительной и выделительной систем, а также неспециализированные необласты, должны содержаться как в головной, так и в хвостовой бластемах (рис. 4). Эти плюрипотентные клетки в бластеме при определенных условиях преобразуются в полностью дифференцированные клетки [19, 25]. При этом некоторые факторы транскрипции могут экспрессироваться под влиянием локального клеточного окружения, в частности, благодаря проницаемым межклеточным контактам [10, 14, 18, 22].
Уже в ранних исследованиях по морфологии регенерирующих планарий отмечалось, что после удаления головного конца необласты скапливались вдоль остаточных нервных волокон центральных нейронов и двигались в сторону раневой поверхности, где окружали нервные волокна периферических нейронов, прорастающие из регенерирующего фрагмента, и формировали нервные ганглии [1, 8]. Более того, уже тогда было высказано предположение, что контакт с нервными стволами индуцирует в необластах дифференцировку в нервные клетки [8]. Действительно, специализация необластов начинается в процессе фагоцитоза поврежденных дифференцированных тканей, т.е. необласты, фагоцитирующие дегенерирующие нервные стволы центральных нейронов, после митоза экспрессируют нейронные факторы транскрипции, а необласты, фагоцитирующие поврежденные мышечные клетки, получают первичную мышечную специализацию. Другими словами, первичная специализация необластов определяется фагоцитируемыми клетками [24].
Таким образом, головная бластема формируется двумя популяциями необластов: необластами, фагоцитирующими и пролиферирующими вблизи раневой поверхности, и необластами, фагоцитирующими поврежденные центральные аксоны вдоль всего регенерирующего фрагмента, а затем мигрирующими к раневой поверхности (рис. 3), а хвостовая бластема – только из необластов, фагоцитирующих и пролиферирующих вблизи раневой поверхности. Это заключение сделано на основании следующих экспериментальных результатов (рис. 2):
● размеры головных бластем у всех фрагментов были больше, чем у хвостовых бластем;
● размеры головных бластем увеличивались по мере увеличения размеров соответствующих регенерирующих фрагментов;
● размеры хвостовых бластем практически не зависели от размеров регенерирующих фрагментов и от расстояния до головного конца;
● максимальный размер головной бластемы у однобластемных фрагментов был зарегистрирован вблизи головного конца (М3), а минимальный – у хвостового конца (М1).
Отметим, что благодаря применению метода прижизненной компьютерной морфометрии выявлено принципиальное различие в механизмах формирования головных и хвостовых бластем регенерирующих планарий. На основании этих результатов предложена схема регенерации планарии, включающая две популяции необластов, различающихся как ролью, так и распределением вдоль тела планарии.
Проведенные исследования подтвердили, что преобразование площади проекции регенерирующего фрагмента в площадь проекции бластемы отражает миграцию плюрипотентных стволовых клеток. При этом регенерационные возможности 11 фрагментов, полученных посредством пяти сечений тела планарии на разных расстояниях от головного конца, были весьма разнообразны.
Максимальный размер головной бластемы обнаружен у фрагмента, полученного после отсечения головного фрагмента на уровне глаз, а максимальная часть всех плюрипотентных стволовых клеток, мигрирующих в две бластемы, обнаружена у фрагмента, полученного перерезкой планарии на уровне выше ротового отверстия с последующим отсечением головного фрагмента на уровне глаз.
Полученные результаты могут использоваться для картирования экспрессии факторов транскрипции необластов вдоль тела планарии.
Работа поддержана грантами РФФИ № 15-29-01135 и Госзадания Министерства образования и науки РФ, № 2912.
Рецензенты:
Зинченко В.П., д.б.н., заведующий лабораторией внутриклеточной сигнализации, ФГБУ «Институт биофизики клетки» Российской академии наук, г. Пущино;
Буданцев А.Ю., д.б.н., профессор, главный научный сотрудник, ФГБУН «Институт теоретической и экспериментальной биофизики» Российской академии наук, г. Пущино.
Библиографическая ссылка
Тирас Х.П., Петрова О.Н., Мякишева С.Н., Асланиди К.Б. ФОРМИРОВАНИЕ РЕГЕНЕРАЦИОННОЙ БЛАСТЕМЫ У ПЛАНАРИИ GIRARDIA TIGRINA // Фундаментальные исследования. 2015. № 7-3. С. 493-500;URL: https://fundamental-research.ru/ru/article/view?id=38766 (дата обращения: 04.03.2026).



