Процессы восстановления в печени у млекопитающих часто протекают по механизму заместительной или атипичной регенерации, которая также именуется фиброзом. Она сопровождается замещением функциональной ткани соединительнотканными волокнами. Фиброз возникает в ответ на повреждение печени и обратим лишь на начальных этапах. На заключительных этапах фиброз является причиной 90 % летальных исходов при хронических заболеваниях печени. В связи с этим поиск путей терапии фиброза печени является актуальной медицинской и социальной проблемой [8].
Структурные изменения в печени начинаются с изменения состава и чрезмерного накопления белков внеклеточного матрикса (ВКМ). Например, формирование фиброзных септ обусловлено увеличением синтеза коллагена, в основном клетками Ито, и связано с активацией клеток Купфера, которые усиливают экспрессию фибриногенных цитокинов и факторов роста. Активация звездчатых клеток приводит к накоплению соединительнотканного матрикса, что влечет за собой потерю микроворсинок гепатоцитами и нарушение их функции. Фиброгенез характеризуется угнетением ВКМ-деградирующих ферментов – матриксных металлопротеиназ. Таким образом, при фиброзе происходит функциональное изменение практически всех клеточных популяций печени [10, 12].
Для моделирования фиброза печени в эксперименте применяют четыреххлористый углерод (CCl4), который, действуя специфически на гепатоциты, вызывает их некроз и жировую дистрофию [13, 15].
Существует несколько подходов к терапии фиброза печени: лечение основного заболевания, ослабление воспалительного и иммунного ответа, торможение активации клеток Купфера, нейтрализация ответа звездчатых клеток, стимуляция апоптоза звездчатых клеток, усиление деградации ВКМ [8].
Ранее была изучена группа мембранотропных гомеостатических тканеспецифических биорегуляторов (МГТБ), которые в сверхмалых дозах оказывали влияние на восстановительные процессы в различных тканях [5]. Эти биологически активные вещества были выделены в отдельную группу на основании общности физико-химических свойств и характера биологического действия. Они характеризуется наличием тканевой, но не видовой специфичности и представляют собой пептидно-белковые комплексы, локализованные внеклеточно. Было показано, что МГТБ могут влиять практически на все биологические процессы: адгезия, миграция, направленность и темп дифференцировки, апоптоз клеток, а также они способны стимулировать клеточные источники регенерации, таким образом восстанавливая нормальные функцию и строение поврежденной ткани [5].
Целью данной работы явилось изучение влияния МГТБ, выделенных из печени и сыворотки крови млекопитающих на регенерацию печени мыши на фоне ее токсического повреждения CCl4. В работе описана характеристика двух пептидно-белковых комплексов – МГТБ, выделенных из сыворотки крови и печени млекопитающих, а также было изучено их влияние на развитие индуцированного фиброза печени у мышей.
Материалы и методы исследования
Для выделения биорегулятора из печени использовали крыс Wistar обоего пола, весом 220–260 г. Содержание и манипуляции с животными проводили в соответствии с директивой 86/609/EEC по обращению человека с лабораторными животными. После декапитации животных под эфирным наркозом печень перфузировали через портальную вену 10 мл раствора Рингера (0.15 М NaCl; 1 мM CaCl2; 5 мM KCl; 1 мM HEPES), удаляя основную массу крови. Печень извлекали, разрезали на фрагменты размером приблизительно 1,5–2,0 см3 и помещали на 2–2,5 ч в р-р Рингера при 4–8 °С. Тканевой экстракт центрифугировали и далее осаждали белки сульфатом аммония (Реахим, Россия). Биорегулятор сыворотки крови получали из сыворотки крови крупного рогатого скота (БиолоТ, Россия).
К сыворотке крови и экстракту печени крыс добавляли при перемешивании сульфат аммония (780 г/л), образовавшийся раствор оставляли на 5 суток при 4 °С, центрифугировали (12000 g; 30 мин), супернатанты и осадки собирали отдельно и диализовали против воды до полного удаления следов соли. Фракции супернатантов концентрировали в вакуумном роторном испарителе при 40 °С.
Электрофорез в 12,5 %-м полиакриламидном геле проводили в денатурирующих условиях по методу Лэмли (толщина геля – 0,75 мм, размер 8х10 см). Окрашивание гелей проводили с помощью красителя Кумасси G-250 (Sigma, Германия) [11].
Исследование пептидно-белковых комплексов осуществляли на времяпролетном MALDI-TOF масс-спектрометре UltraFlex 2 (Bruker, Германия), оснащенном азотным лазером 337 нм с частотой импульса до 20 Гц. Все измерения проводили в линейном и рефлекторном режиме, определяя положительные ионы. Для накопления масс-спектров мощность лазерного излучения устанавливали на уровне минимального порогового значения, достаточного для десорбции-ионизации образца. Внешнюю калибровку проводили с использованием точных значений молекулярных масс известных белков. Образец наносили на три ячейки планшета, для каждой из которых записывали спектр, полученный в результате суммирования 10 серий спектров по 50 импульсов лазера для каждой. Для записи, обработки и анализа масс-спектров использовали программное обеспечение (Bruker, Германия): flexControl 2.4 (Build 38) и flexAnalysis 2.4 (Build 11). Точность измерения масс составляла ± 2 Да. В качестве матрицы использовали насыщенный раствор α-циано-4-гидроксикоричной кислоты (Sigma, Германия) в смеси 50 %-го ацетонитрила и 2,5 %-й трифторуксусной кислоты. Все использованные реактивы, включая воду, были аналитической или специальной для масс-спектрометрии чистоты.
Подготовка образцов, содержащих белки-модуляторы, для масс-спектрометрии проводилась следующим образом: на мишени смешивали по 0,5 мкл раствора образца и раствора 2,5-дигидроксибензойной кислоты (Sigma, Германия) 20 мг/мл в 20 %-м ацетонитриле в воде с 0,5 % ТФУ, полученную смесь высушивали на воздухе.
Масс-спектры были получены на MALDI-времяпролетном масс-спектрометре Ultraflex II (Bruker, Германия), оснащенном УФ-лазером (Nd) в режиме положительных ионов с использованием рефлектрона и в тандемном режиме (MS/MS); точность измеренных масс после докалибровки по пикам автолиза трипсина составляла 0,005 % (50 ррм), точность измеренных моноизотопных масс фрагментов была в пределах 2 Да.
Триптический гидролиз белка в полиакриламидном геле проводили следующим образом: кусочек геля размером около 2×2 мм дважды промывали для удаления красителя в 100 мкл 40 %-го раствора ацетонитрила в 0,1 М NH4HCO3 в течение 20 мин при комнатной температуре. После удаления раствора для дегидратации геля добавляли 100 мкл ацетонитрила. Удалив ацетонитрил и высушив кусочек геля, прибавляли к нему 4 мкл раствора модифицированного трипсина (Promega, США) в 0,05 М NH4HCO3 с концентрацией 15 мкг/мл. Гидролиз проводили в течение 18 ч при 37 °С, затем к раствору добавляли 7 мкл 0,5 % ТФУ в 10 %-м растворе ацетонитрила в воде и тщательно перемешивали. Раствор, образующийся над гелем, использовали для получения MALDI-масс-спектров.
Идентификацию белков осуществляли при помощи программы Mascot (www.matrixscience.com). Поиск проводился в базе данных NCBI среди белков всех организмов с указанной точностью с учетом возможного окисления метионинов кислородом воздуха и возможной модификации цистеинов акриламидом. Кандидатные белки, имеющие параметр достоверности score > 83 в базе данных NCBI считали определенными надежно (p < 0,05).
Эксперименты по определению гидродинамического радиуса частиц в растворах комплексов выполняли методом динамического рассеяния света на приборе PhotoCor Complex (ФотоКор, Россия), снабженном автоматическим гониометром, мультивременным коррелятором реального времени PhotoCor-FC и гелий-неоновым лазером Uniphase 1135P мощностью 20 мВт (λ = 633 нм) в качестве источника света. Измерения проводили при угле рассеяния 90 °С и температуре 25 °С. Пыль из растворов удаляли фильтрованием через мембраны Millex-GV с диаметром пор 0,22 мкм (Millipore, Германия).
Спектры кругового дихроизма в УФ-области (195–260 нм) снимали на КД-спектрометре Jasco 720 (Япония) при 20 °С в кварцевых кюветах с длиной оптического пути 1 мм. Скорость сканирования составила 50 нм/мин, шаг – 1 нм, накопление каждого шага – 2 сек. Концентрация исследуемого белка в водном растворе составляла 100 мкг/мл. Итоговый спектр получали по результатам усреднения данных трех сканирований и вычитания спектра базовой линии (контроля). Содержание элементов вторичной структуры оценивали с помощью программы CDNN (Applied Photophysics, Великобритания)
Фиброз печени индуцировали с помощью регулярного внутрибрюшинного введения CCl4 в количестве 1 мкл/г веса животного в 30 %-м растворе персикового масла согласно стандартным методикам [7]. Инъекции проводили в течение 60 дней дважды в неделю.
В эксперименте использовали мышей-самцов гибридов (F1: С57Bl/CBA) в возрасте двух месяцев. Содержание и манипуляции с животными проводили в соответствии с директивой 86/609/EEC по обращению человека с лабораторными животными. В эксперименте использовали 6 групп животных: мыши, получавшие внутрибрюшинные инъекции CCl4 (ООО «Компонент-реактив», Россия) – 1 мкл/г в виде 30 % масляного раствора (персиковое масло, ГаленоФарм) 2 раза в неделю (группа № 1); мыши, получавшие внутрибрюшинные инъекции CCl4 и питьевой раствор биорегулятора, выделенного из печени крыс, в концентрации, соответствующей 10-12 мг белка/мл (группа № 2); мыши, получавшие внутрибрюшинные инъекции CCl4 и питьевой раствор биорегулятора, выделенного из сыворотки крови крупного рогатого скота, в концентрации, соответствующей 10-12 мг белка/мл (группа № 3); мыши, получавшие внутрибрюшинные инъекции CCl4 и Эссенциале Форте (Sanofi-Aventis, Франция) в виде питьевого раствора в концентрации 1,5 мг/мл, согласно рекомендации производителя (группа № 4); интактный контроль (группа № 5); мыши, получавшие внутрибрюшинные инъекции масла (группа № 6). Общее количество мышей в каждой экспериментальной группе было 10 голов.
Растворы биорегуляторов приготавливали путем последовательного 10-кратного разбавления исходного комплекса с концентрацией 0,1 мг/мл. Концентрацию белка в исходном комплексе определяли спектрофотометрически [1].
Для проведения гистологического исследования печени мыши проводили забор биологического материала до начала эксперимента (контроль), на 30-е и 60-е сутки эксперимента. Животных выводили из эксперимента следующим образом: после предварительной наркотизации проводили дислокацию шейных позвонков. Забор гистологического материала проводили от всех долей печени, фиксировали в ФСУ (формалин (Serva, Германия): спирт (Serva, Германия): уксусная кислота (Serva, Германия), в соотношении 9:6:1). Дальнейшую обработку материала проводили по стандартной методике. Окраску полученных срезов проводили по сложному многокрасочному методу Маллори (Serva, Германия), позволяющему специфично окрасить коллаген. Полученные гистологические препараты анализировали с использованием световой микроскопии на микроскопе Leica DM RXA2 (Leica, Германия).
Для проведения качественной оценки степени развития фиброза использовали шкалу METAVIR. Оценка проводится по развитию септ в порто-портальном и порто-центральном направлениях (F-fibrosis; F0-F4): F0 – фиброз отсутствует; F1 – звездчатое расширение портальных трактов без образования септ; F2 – расширение портальных трактов с единичными порто-портальными септами; F3 – многочисленные порто-портальные септы без цирроза; F4 – цирроз (формирование ложных долек) [2].
Результаты исследования и их обсуждение
В настоящей работе были изучены 2 представителя группы МГТБ, представляющие собой пептидно-белковые комплексы фракций супернатантов, полученные из сыворотки крови и экстракта печени. Согласно разработанному подходу [5] исследуемые комплексы были охарактеризованы с помощью ряда физико-химических и биологических методов. Было показано, что в данных комплексах присутствуют как биологически активные пептиды, так и белки, модулирующие их активность – белки-модуляторы.
Методом электрофореза в полиакриламидном геле было показано, что в обоих комплексах присутствуют белки, с мол. массами приблизительно 66000 Да, которые соответствуют сывороточному альбумину (рис. 1).
Ранее было показано, что белком-модулятором для биорегулятора, выделенного из сыворотки крови, является изоформа сывороточного альбумина, молекулярная масса которого составила 67855 Да [3]. Молекулярная масса зрелого сывороточного альбумина быка составляет 66397 Да. Использование алгоритма PROPSEARCH (база данных SwissProt) показало, что белок-модулятор сыворотки крови относится к группе преальбуминов сыворотки крови млекопитающих. Физиологическая функция преальбуминов до сих пор остается недостаточно ясной [6]. При «созревании» молекулы бычьего сывороточного альбумина происходит протеолитическое отщепление фрагмента из 23 аминокислотных остатков с N-концевой части молекулы преальбумина. Молекула преальбумина обладает сформировавшейся вторичной структурой, которая характеризуется высоким содержанием α-спиралей (около 80 %). Высокое содержание α-спиралей (79 %) было выявлено и в структуре молекулы модулятора сывороточного и печеночного биорегулятора методом кругового дихроизма: на это указывало наличие характерных минимумов при длинах волн 208 и 222 нм, соответственно [9]. Также вторичная структура белка-модулятора представлена β – складчатой структурой (2 %) и статистическим клубком (19 %).
Ранние данные по результатам секвенирования показали, что N-концевая аминокислотная последовательность молекулы сывороточного модулятора содержит 10 аминокислотных остатков и отличается от N-концевого мотива молекулы бычьего сывороточного альбумина: Ала-Про-Лиз-Лиз-Сер-Глу-Иле-Ала-Лей-Фен [3].
Для более точного определения молекулярных масс изоформ сывороточного альбумина в комплексе супернатанта печени был применен метод масс-спектрометрии после предварительного проведения триптического гидролиза. Расчетная молекулярная масса, согласно пептидам триптического гидролизата для изоформы сывороточного альбумина, выделенного из печени составила 68674 Да. В базе данных uniprot название белка gi|55628 соответствует белку семейства сывороточных альбуминов, находится в плазме крови rattus norvegicus. Соответственно, исходя из этого, белки-модуляторы, полученные из сыворотки крови и печени представляют собой малоизученные изоформы сывороточного альбумина.
Исследование комплексов фракций супернатантов печени и сыворотки крови методом MALDI-TOF масс-спектрометрии показало, что в них присутствуют небольшие пептиды (таблица).
Исследование комплексов фракций супернатантов печени и сыворотки крови методом кругового дихроизма показало преобладание во вторичной структуре изучаемых комплексов β-структур и статистического клубка (таблица).
Исходя из данных метода кругового дихроизма, наличие незначительного количества спиралей указывает на присутствие в комплексах небольшого количества изоформ альбумина. Методом лазерного динамического светорассеяния было показано наличие крупных наноразмерных частиц в водных растворах МГТБ печени (100 ± 4,6 нм) и сыворотки крови (62,05 ± 3,0 нм) соответственно.
Далее оба МГТБ исследовали на модели индуцированного фиброза у млекопитающих. Исследование показало, что МГТБ, выделенные из печени и сыворотки крови, по-разному влияют на его развитие.
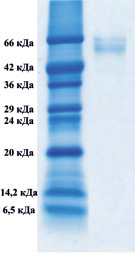
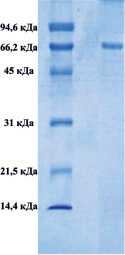
А) Б)
Рис. 1. Электрофорез в 12,5-м % полиакриламидном геле комплекса супернатанта тканевого экстракта печени крысы (А), комплекса супернатанта сыворотки крови (Б)
Физико-химические свойства исследуемых комплексов
|
Название комплекса |
Молекулярные ионы (m/z) |
Элементы вторичной структуры |
||||
|
α-спираль |
β-структуры |
Статистический клубок |
||||
|
Антипараллельные складки |
Параллельные складки |
β-изгибы |
||||
|
Комплекс супернатанта сыворотки крови |
1132, 1338, 1447, 1498, 1627, 1665, 1794, 2430, 2553, 2592, 2619, 2755, 2943, 2961, 3108 |
8,0 ± 0,5 |
40,0 ± 0,5 |
2,0 ± 0,5 |
18,0 ± 0,5 |
33,0 ± 0,5 |
|
Комплекс супернатанта экстракта печени крыс |
1510, 1677, 1734, 1871, 1996, 2215, 2299, 2908, 3007, 3640 |
5,0±0,4 |
55,3±2,6 |
2,4±0,4 |
17,3 ± 1,0 |
19,8 ± 2,4 |
A) Б)
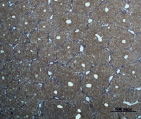
Рис. 2. Состояние ткани печени контрольных мышей. А – интактный контроль (группа № 5); Б – группа мышей, получавших внутрибрюшинные инъекции масла в течение 60 дней (группа № 6); окраска по методу Маллори. Увеличение 100х
Проведенный анализ гистологической картины ткани печени показал, что на протяжении всего эксперимента не было выявлено различий между интактным контролем (группа № 5) и группой, получавшей инъекции масла без CCl4 (группа № 6) (рис. 2).
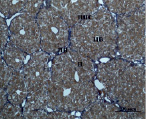
На 30-е сутки эксперимента в группе мышей с индуцированным фиброзом (группа № 1) нам удалось выявить очаги коллагеновых тяжей в области портальных трактов. Тяжи коллагена начинают распространяться по периферии дольки печени, образуя множественные порто-портальные септы. В перицентральных областях дольки коллагеновых волокон не было обнаружено. Такая гистологическая картина соответствует стадии F2-F3 по шкале METAVIR. Аналогичная картина была выявлена в группах мышей с индуцированным фиброзом, получавших с питьевой водой биорегулятор, выделенный из сыворотки крови (группа № 3), и Эссенциале Форте (группа № 4) (рис. 3). В контрольной группе (группа № 5) животных такой картины отмечено не было (рис. 2).
На 30-е сутки эксперимента в группе мышей с индуцированным фиброзом, получавших с питьевой водой МГТБ, выделенный из печени (группа № 2), были выявлены очаги коллагеновых тяжей и единичные порто-портальные септы. Такая гистологическая картина соответствует стадии F2 по шкале METAVIR (рис. 3).
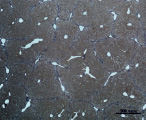
A) Б)
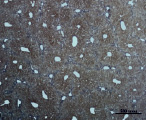
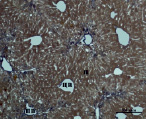
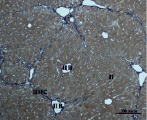
В) Г)

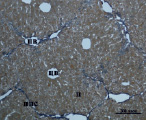
Д) Е)
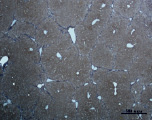
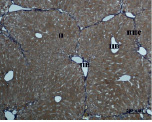
Ж) З)
Рис. 3. Состояние ткани печени мыши на 30-е сутки эксперимента. Окраска по методу Маллори. А, Б – группа мышей с индуцированным фиброзом (группа № 1); В, Г – группа мышей с индуцированным фиброзом, получавшая питьевой раствор МГТБ, выделенного из печени (группа № 2); Д, Е – группа мышей с индуцированным фиброзом, получавшая питьевой раствор МГТБ, выделенного из сыворотки крови (группа № 3); Ж, З – группа мышей с индуцированным фиброзом, получавшая раствор препарата Эссенциале Форте (группа № 4). Окраска по методу Маллори. А, В, Д, Ж – увеличение 40х; Б, Г, Е, З – увеличение 100х; пв – портальная вена, цв – центральная вена, ппс – порто-портальная септа, п – паренхима
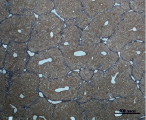
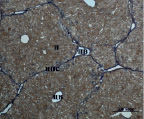
A) Б)
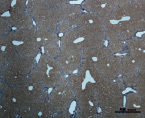
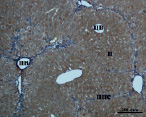
В) Г)
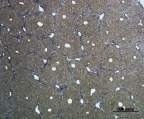
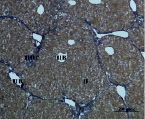
Д) Е)
Ж) З)
Рис. 4. Состояние ткани печени мыши на 60-е сутки эксперимента. А, Б – группа мышей с индуцированным фиброзом (группа № 1); В, Г – группа мышей с индуцированным фиброзом, получавшая питьевой раствор МГТБ, выделенного из печени (группа № 2); Д, Е – группа мышей с индуцированным фиброзом, получавшая питьевой раствор МГТБ, выделенного из сыворотки крови (группа № 3); Ж, З – Группа мышей с индуцированным фиброзом, получавшая раствор препарата Эссенциале Форте (группа № 4). Окраска по методу Маллори. А, В, Д, Ж – увеличение 40х; Б, Г, Е, З – увеличение 100х; пв – портальная вена, цв – центральная вена, ппс – порто-портальная септа, п – паренхима
На 60-е сутки эксперимента анализ гистологической картины показал, что в группе мышей с индуцированным фиброзом (группа № 1) на многих участках паренхимы печени произошло объединение порто-портальных септ, образовались порто-портальные мосты, и видны единичные участки в области центральных вен дольки, где начинает образовываться коллаген. Такая картина соответствует стадии F3 по шкале METAVIR. Аналогичная картина была выявлена в группах мышей с индуцированным фиброзом, получавших с питьевой водой биорегулятор, выделенный из сыворотки крови (группа № 3), и Эссенциале Форте (группа № 4) (рис. 4). В контрольной группе животных таких изменений не наблюдалось, гистологическая картина была аналогична таковой на 30-е сутки эксперимента (рис. 2).
На 60-е сутки эксперимента в группе мышей с индуцированным фиброзом, получавших с питьевой водой МГТБ, выделенный из печени (группа № 2), были выявлены множественные порто-портальные септы, которые, однако, практически не образовывали порто-портальные мосты. В областях центральных вен долек коллагеновых волокон выявлено не было. Такая гистологическая картина соответствует стадии F2-F3 по шкале METAVIR (рис. 4).
Ранее на модели роллерного органотипического культивирования печени тритонов было показано, что МГТБ сыворотки крови стимулировал митозы соединительнотканных клеток. Очевидно, данный МГТБ способен поддерживать процессы кроветворения в капсулярной области печени амфибий [4].
В настоящем исследовании было показано, что МГТБ, выделенный из сыворотки крови, не проявлял гепатопротекторную активность. Это можно объяснить тем, что у тритонов, в отличие от млекопитающих, во взрослом состоянии продолжается кроветворение в печени. Поскольку исследуемые биорегуляторы обладают тканеспецифичным действием, то, соответственно, он влиял на клетки кроветворения у тритона, но не влиял на клетки паренхимы печени у мыши.
Ранее было показано, что, в отличие от МГТБ сыворотки крови, МГТБ печени активировал меланомакрофаги и угнетал процессы кроветворения в печени амфибий [4]. Согласно литературным источникам, эти клетки являются рекрутированными макрофагами, относящимися к мононуклеарно-фагоцитарной системе, способны автономно синтезировать меланин [14]. Суммируя представленные литературные данные, а также результаты исследования специфической активности МГТБ печени, можно предположить, что он проявлял гепатопротекторное свойство [4].
Результаты проведенного исследования подтвердили это предположение. В данной работе было показано, что при пероральном приеме МГТБ, выделенного из печени, на фоне токсического повреждения печени мыши снижаются темпы развития фиброза.
Гепатопротекторное действие МГТБ, выделенного из печени, можно объяснить его действием на клеточные источники регенерации в данной ткани, поскольку для МГТБ, выделенных из других тканей, была продемонстрирована способность МГТБ стимулировать процессы восстановления и репарации в патологически измененных тканях [5].
Заключение
Таким образом, исходя из данных исследования обоих биорегуляторов (МГТБ), показано, что они присутствуют в растворе в виде наноразмерных пептидно-белковых комплексов.
На модели CCl4 индуцированного фиброза печени мыши изучено протекторное действие исследуемых комплексов. Показано, что биорегулятор, выделенный из сыворотки крови, не проявлял гепатопротекторную активность, а биорегулятор, выделенный из печени, снижал темпы развития фиброза на фоне токсического повреждения печени мыши.
Рецензенты:
Александрова М.А., д.б.н., заведующий лабораторией экспериментальной нейробиологии ФГБУН «Института биологии развития им. Н.К. Кольцова» РАН, г. Москва;
Шарова Н.П., д.б.н., заместитель директора по научной работе, заведующий лабораторией биохимии процессов онтогенеза ФГБУН «Института биологии развития им. Н.К. Кольцова» РАН, г. Москва.
Библиографическая ссылка
Налобин Д.С., Мальцев Д.И., Ильина А.П., Краснов М.С., Алипкина С.И., Сырчина М.С., Рыбакова Е.Ю., Ямскова В.П., Ямсков И.А. ИССЛЕДОВАНИЕ ВЛИЯНИЯ БИОРЕГУЛЯТОРОВ, ВЫДЕЛЕННЫХ ИЗ ПЕЧЕНИ И СЫВОРОТКИ КРОВИ МЛЕКОПИТАЮЩИХ, НА РАЗВИТИЕ ФИБРОЗА ПЕЧЕНИ МЫШИ // Фундаментальные исследования. 2015. № 7-1. С. 48-56;URL: https://fundamental-research.ru/ru/article/view?id=38724 (дата обращения: 01.01.2026).



