Аморфный кремнезем находит широкое применение в отраслях промышленности: строительной, химической, резинотехнической, медицинской, косметической и других и пользуется большим спросом на внутреннем российском рынке и в странах ближнего и дальнего зарубежья. Сырьем для производства аморфного кремнезема могут быть различные минералы и химические вещества. Наиболее распространенным кремнеземсодержащим сырьем являются кварцевые пески, которые содержат небольшое количество вредных примесей. Известные способы получения аморфного кремнезема связаны с использованием сложных многоступенчатых процессов, требуют специфического исходного сырья, применения дорогостоящих реагентов и оборудования [1, 2 и другие].
Цель исследований – разработка эффективного экономически рентабельного метода получения наночастиц аморфного кремнезема с заданными физико-химическими свойствами из доступного и дешевого кремнеземсодержащего сырья – кварцевых песков.
Материалы и методы исследования
В качестве объекта исследования использовался кварцевый формовочный песок, дробленный до размеров менее 0,01см, состава (масс. %): SiO2 – 95,80; Al2O3 – 2,26; Fe2O3 – 0,17; TiO2 – 0,23; Na2O – 0,09; K2O – 0,97; п.п.п. – 0,40 из Чалганского месторождения кварц-каолин-полевошпатового сырья (Амурская область).
В качестве фторирующего реагента применялся гидродифторид аммония (NH4HF2) марки ч.д.а. В нормальных условиях он представляет собой инертное, кристаллическое вещество ромбической структуры, которое в отличие от других фторирующих реагентов (фтор, фтористый водород, плавиковая кислота), не представляет существенной экологической опасности, но при нагревании он становится более энергичным реагентом, чем газообразный фтор [7]. Гидродифторид аммония плавится при температуре 126,8 °С, температура его разложения – 238 °С, растворимость в воде – 370 г/см3 при 70 °С.
Фторирование кварцевых песков осуществлялось на лабораторной установке специальной конструкции с реактором из никелевого сплава, в котором исходное сырье спекалось с гидродифторидом аммония и полученные смеси термически обрабатывались до получения гексафторсиликата аммония (NH4)2SiF6). Для разделения и сбора летучих продуктов применялся конденсатор, изготовленный из нержавеющей стали и фторопласта. Поглощение газообразного аммиака происходило в сосуде с водой. Синтез наночастиц аморфного кремнезема проводился в гидролизном аппарате, выполненном из фторопласта. Регенерация NH4HF2 осуществлялась в лабораторном выпаривателе-кристаллизаторе.
Исходное сырье, промежуточные фазы и конечные продукты исследовались химическим, рентгенофазовым, спектральным и электронномикроскопическим методами анализов, применяемыми в Аналитическом центре минералого-геохимических исследований ИГиП ДВО РАН [5].
Расчеты термодинамических параметров, констант скорости и энергии активации химических реакций осуществлялись с применением приложения Microsoft Excel 2007 и программы, разработанной на основе приложения Microsoft Access 2007. Изображения наночастиц аморфного кремнезема получены с использованием программы NOVA, IMAGE ANALYSIS и приложения Microsoft Windows Paint.
Результаты исследования и их обсуждение
Фторидная переработка кварцевых песков проводилась в четыре этапа. На первом этапе исходное сырьё спекалось с NH4HF2 при температурах 100–200 °С с образованием порошкообразного спека. На втором этапе в результате термообработки полученного спека при температурах 300–500 °С сублимировал гексафторсиликат аммония. На третьем этапе проводился синтез наночастиц аморфного кремнезема при температурах 20–90 °С путем гидролизации (NH 4)2 SiF6 под действием аммиачной воды (NH4OH). На четвертом этапе осуществлялось восстановление дополнительных реагентов – NH4HF2 и NH4OH.
Механизм взаимодействия при спекании кварцевого песка с гидродифторидом аммония следует рассматривать как многоступенчатый. Взаимодействие начинается с образования гептафторсиликата аммония ((NH4)3SiF7) по реакции
2SiO2 + 7NH4HF2 = 2(NH4)3SiF7 + 4H2O↑ + NH3↑. (1)
Далее при температурах выше 100 °С начинается образование гексафторсиликата аммония по реакции
2SiO2 + 7NH4HF2 = (NH4)3SiF7 + (NH4) 2SiF6 + 4H2O↑ + 2NH3↑ + HF↑, (2)
и при температуре 200 °С образуется (NH4) 2SiF6 по реакции
SiO2 + 3NH4HF2 = (NH4) 2SiF6 + 2H2O↑ + NH3↑. (3)
Термодинамические расчеты показывают, что изменения энергии Гиббса (ΔG) для реакций (1) и (2) при нормальных условиях составляют –39 кДж и –36 кДж соответственно и уменьшаются до –306,1 и –354,5 при 200 °С соответственно. Для реакции (3) ΔG при 200 °С составляет –49,9 кДж и уменьшается с повышением температуры: ΔG300 = –1464,7 кДж.
По данным рентгенофазового, химического и спектрального анализов образовавшийся порошкообразный спек, полученный в восстановительных или инертных условиях при 200 °C и времени выдержки 3,5 ч, состоит из (NH4)2SiF6 и примесных компонентов: гексафторалюмината аммония ((NH4)3AlF6), фторидов щелочных металлов (NaF, KF) и других соединений. Пары аммиака и воды взаимодействуют между собой с образованием аммиачной воды (NH4OH), которая затем поступает на стадию гидролизации гексафторсиликата аммония.
Очистку (NH4)2SiF6 от примесей проводили методом термической обработки, в результате которой происходит сублимация гексафторсиликата аммония, начинающаяся при температуре 204 °C и преобладающая при температурах выше 300 °C, что согласуется с ранее установленными данными [3]. Процесс характеризуется высокими значениями констант скоростей и низкой энергией активации; температура 500 °C является наиболее благоприятной для образования гексафторсиликата аммония, которое происходит за короткие промежутки времени, и через 0,5 ч достигается рассчитанное теоретическое количество этого продукта. Летучий (NH4)2SiF6 улавливался и собирался в конденсаторе. Соединения фторидов Al, Na, K не подвергаются сублимации и остаются в нелетучем осадке.
Электронномикроскопические исследования показывают, что гексафторсиликат аммония состоит из микроразмерных пластин толщиной менее 100 nm, которые образуют кристаллические агрегаты волокнистой, пирамидальной и дендритовидной форм (рис. 1). По данным спектрального анализа (NH4)2SiF6 имеет высокую химическую чистоту – содержание металлических примесей (Al, Fe, Mn, Mg, Cu) не превышает 10–3–10–5 масс. %. Повторная сублимационная очистка позволяет получить (NH4)2SiF6 с содержанием примесей менее 10–6 –10–8 масс. %.

Рис. 1. Кристаллические агрегаты (NH4)2SiF6, состоящие из микроразмерных пластин
Синтез наночастиц аморфного кремнезема осуществлялся в водном растворе гексафторсиликата аммония концентрацией от 3 до 33 масс. % (NH4)2SiF6 и температурах 20–90 °C при взаимодействии с аммиачной водой (25 масс. % NH3) до образования суспензии при РН = 8–9, которую выдерживали при заданной температуре в течение 0, 5–1, 5 ч.
Гексафторсиликат аммония гидролизуется в воднощелочном растворе по реакции
(NH4)2SiF6 + 4NH4ОН = SiO2↓ + 6NH4F + 2H2O. (4)
Реакция (4) происходит при комнатной температуре: ΔG25 = –48,7 кДж, а с повышением температуры значения изменений энергии Гиббса увеличиваются: ΔG100 = –19,1 кДж.
При выпаривании водного раствора NH4F кристаллизуется гидродифторид аммония по реакции
2NH4F = NH4HF2 + NH3↑, (5)
который поступает в начало технологического процесса обработки исходного сырья.
Использование растворов гексафторсиликата аммония концентрацией ниже 3 масс. % нецелесообразно, так как способствует образованию труднофильтруемой суспензии SiO2. Повышение концентрации гексафторсиликата аммония выше 33 масс. % ведет к уменьшению выхода конечного продукта и ухудшению его качества. Применяемый температурный интервал 20–90 °C обусловлен тем, что повышение температуры больше 90 °C ведет к интенсивному испарению раствора, а при температуре ниже 20 °C нет возможности получить продукт необходимого качества. Выдерживание полученной суспензии в течение 1 ч при температурах 20–90 °C способствует её стабилизации и значительному улучшению фильтруемости. Затем суспензию отфильтровывают, промывают дистиллированной водой с механическим перемешиванием и осадок на фильтре высушивают до постоянного веса.
На рис. 2 показана зависимость степени извлечения аморфного кремнезёма от концентраций исходного водного раствора гексафторсиликата аммония, которая рассчитывалась по формуле
а = ап/ао, (6)
где ап – масса образовавшегося SiO2; ао – его теоретическое количество.
Как видно из рис. 2, в разбавленных растворах, близких к идеальным, при концентрации 3 масс. % (NH4)2SiF6 и температуре 80 °C достигается максимальное извлечение аморфного кремнезёма, равное 92,36 масс. %, которое уменьшается до 71,47 масс. % при концентрации 33 масс. % (NH4)2SiF6 для аналогичной температуры. При концентрации 3 масс. % (NH4)2SiF6 и температуре 25 °C степень извлечения аморфного кремнезёма составляет 82,35 масс. %, и она уменьшается до 68,53 масс. % с повышением концентрации (NH4)2SiF6 до 20 масс. % для аналогичной температуры. При температуре 25 °C исследование извлечения аморфного кремнезема ограничивалось предельной растворимостью (NH4)2SiF6, равной 20 масс. %.
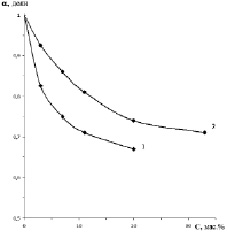
Рис. 2. Зависимость степени извлечения аморфного кремнезёма от концентрации исходного раствора гексафторсиликата аммония и температуры в (°С): 1 – 25, 2 – 80
Математическая обработка результатов экспериментов проводилась в предположении о том, что массовая степень извлечения аморфного кремнезема зависит от температуры по уравнению Аррениуса [6]:
а = аоехр(–Еа/RT), (7)
а энергия активации вычислялась по формуле
Eа = R∆lnа/∆(1/Т), (8)
для каждой пары точек на рис. 2. Средняя величина Eа составляет 1,6 кДж/моль, что свидетельствует о протекании реакции (4) в диффузионной области.
Определение размера наночастиц аморфного кремнезема проводилось на атомно-силовом микроскопе SOLVER R47 (г. Владивосток). Суспензия из наночастиц готовилась на основе изопропилового спирта высокой степени очистки в одноразовой пластиковой емкости. Для нанесения суспензии на подложку из слюды применялась механическая пипетка со сменными носиками, что позволяло избежать смешивания различных наночастиц. Для анализа использовался зонд NSG 03 со стандартным радиусом закругления 10 nm.
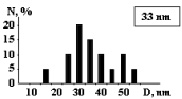
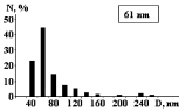
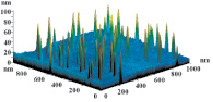
На рис. 3 показаны трехмерные изображения групп наночастиц и гистограммы распределения количества наночастиц (N) по размерам (D) в зависимости от условий гидролиза (реакция (4)). Наименьшего среднего значения (17 nm) размер наночастиц достигает в условиях синтеза при исходной концентрации 3 масс. % (NH4)2SiF6 и температуре 80 °C (рис. 3, б), и наночастицы увеличиваются до средних размеров 61 nm (рис. 3, в) и 89 nm (рис. 3, г) при концентрациях 20 и 33 масс. % соответственно для аналогичной температуры. При концентрации 3 масс. % (NH4)2SiF6 понижение температуры синтеза до 25 °C способствует увеличению среднего размера наночастиц до 33 nm (рис. 3, а).
Условия синтеза показали, что изменение значений концентрации исходного водного раствора (NH4)2SiF6 от 3 до 33 масс. % и температуры опытов от 25 до 80 °C позволяют контролировать величину удельной поверхности порошков аморфного кремнезема от 92 до 508 м2/г, при этом удельный объем пор увеличивается от 0,096 до 0,225 см3/г.
По данным химического анализа в кремнеземсодержащих порошках обнаружены следы фтора, концентрации воды изменяются в пределах 2,53–7,65 масс. %, потери при прокаливании составляют 3,73–5,76 масс. %, что соответствует ранее полученным данным [4]. Спектральный анализ порошков аморфного кремнезема подтверждает наличие в них минимального количества примесей (менее 10–4 масс. %); на дифрактограммах наблюдается рентгеноаморфное гало с отсутствием кристаллических фаз.
Заключение
Теоретическими и экспериментальными исследованиями установлено, что фторидная переработка кремнеземсодержащего сырья происходит при температурах 20–500 °C с образованием порошкообразного спека, получением гексафторсиликата аммония, синтезом наночастиц аморфного кремнезёма и восстановлением дополнительных реагентов. Выявлено, что условия синтеза определяют физико-химические свойства аморфного кремнезема и степень его извлечения. Определена зависимость размера наночастиц аморфного кремнезема и площади удельной поверхности порошка от концентрации раствора гексафторсиликата аммония и температуры, при которой происходила гидролизация. В результате проведенных исследований разработан экономически рентабельный и экологически безопасный фторидный метод получения наночастиц аморфного кремнезема из доступных и дешевых кварцевых песков с практически полной регенерацией гидродифторида аммония и аммиачной воды.
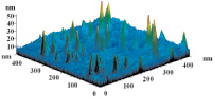
 а
а
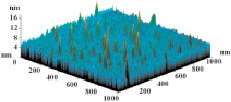
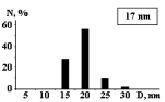 б
б
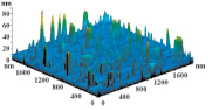
 в
в
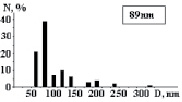 г
г
Рецензенты:
Сорокин А.П., д.г.-м.н., профессор, председатель, ФГБУН «Амурский научный центр» Дальневосточного отделения Российской академии наук, г. Благовещенск;
Остапенко Н.С., д.г.-м.н., доцент, заведующий лабораторией, ФГБУН «Институт геологии и природопользования» Дальневосточного отделения Российской академии наук, г. Благовещенск.
Библиографическая ссылка
Римкевич В.С., Пушкин А.А., Гиренко И.В. ФТОРИДНЫЙ МЕТОД ПОЛУЧЕНИЯ НАНОЧАСТИЦ АМОРФНОГО КРЕМНЕЗЕМА ИЗ КРЕМНЕЗЕМСОДЕРЖАЩЕГО СЫРЬЯ // Фундаментальные исследования. 2015. № 2-27. С. 6055-6060;URL: https://fundamental-research.ru/ru/article/view?id=38618 (дата обращения: 18.01.2026).



