Согласно прогнозным исследованиям ВОЗ, хроническая обструктивная болезнь легких (ХОБЛ) относится к ведущим причинам роста заболеваемости и смертности взрослого населения во всем мире, нанося существенный экономический и социальный ущерб цивилизованному обществу.
Частые обострения ХОБЛ приводят к более быстрому прогрессированию заболевания, значительному снижению качества жизни пациентов, а также к увеличению преждевременной летальности [1]. Наиболее частыми причинами дестабилизации течения ХОБЛ являются вирусные и бактериальные возбудители, основным источником которых может быть флора верхних дыхательных путей [12]. Исследование микробиоты слизистых оболочек верхних дыхательных путей может оказать существенное значение для организации профилактических и реабилитационных мероприятий лицам, страдающим ХОБЛ.
Целью исследования явилось изучение микробиоты слизистых оболочек верхних дыхательных путей у пациентов II и III стадией хронической обструктивной болезни легких.
Материалы и методы исследования
В исследование включено 99 пациентов ХОБЛ II и III стадии заболевания согласно GOLD 2010. В зависимости от периода течения заболевания пациенты разделены на две основные группы. Первую составили 50 пациентов в фазе обострения болезни (40 мужчин и 10 женщин) в возрасте от 51 до 65 лет (средний возраст составил 58,9 ± 4,9 лет), вторую группу 49 пациентов ХОБЛ в фазе стабильного течения (40 мужчин и 9 женщин) в возрасте от 51 до 65 лет (средний возраст составил 58,1 ± 4,6 лет). Контрольная группа представлена 50 условно здоровыми добровольцами, сопоставимыми по возрасту и полу с основной группой, никогда не курившими и не имеющими заболеваний органов дыхания.
Забор материала на исследование из среднего носового хода, глотки, гортани осуществлялся согласно методическим указаниям «Техника сбора и транспортирования биоматериалов в микробиологические лаборатории. МУ 4.2.2039-05» от 2006 года. Выделение чистой культуры проводилось согласно Приказу Минздрава СССР от 22.04.1985 № 535 «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений». Результаты исследования считались значимыми в случае выявления потенциального патогена в титре не менее 105 КОЕ/мл.
При проведении исследования микрофлоры слизистой оболочки полости носа избегали контакта с волосами преддверия. Посев брали из среднего носового хода под контролем 30° риноэндоскопа максимально тонким зондом. Мазок из глотки выполнялся с поверхности миндалины, не касаясь корня языка или мягкого нёба. Учитывая сложности взятия прицельных мазков из гортани для микробиологического исследования, использовалось приспособление, разработанное и примененное впервые в клинике СПб ГМУ им. акад. И.П. Павлова [11].
Статистическая обработка материалов исследования между основными и контрольной группой проводилась с помощью метода трансформации Z Фишера, с последующим анализом двухсторонним t-тестом с поправкой Бонферрони [5]. Достоверными считались различия при Р ≤ 0,01 (фактический Р уровень с учетом поправок Бонферрони на общее число сравнений Р ≤ 0,0000725).
Результаты исследования и их обсуждение
Существует модель «бактериальной нагрузки» у лиц, страдающих ХОБЛ. Под этим определением понимают увеличение концентрации микроорганизмов в дыхательных путях, способствующее переходу от стабильного состояния ХОБЛ к обострению [12, 13]. Таким образом, для изучения микробиоты верхних дыхательных путей (ВДП) важен не только качественный, но и количественный состав микроорганизмов, как потенциального инфекционного резервуара для нижних дыхательных путей.
В первой группе обследуемых по сравнению с контрольной группой микрофлоры в диагностически значимых титрах в полости носа не обнаружено. В глотке у пациентов первой группы в 34,1 ± 3,5 % (n = 17) случаев выделен St. рyogenes, достоверно превышая (рис. 1) содержание прочих возбудителей (Р ≤ 0,01). С высокой частотой (рис. 2) в глотке обнаружена С. albicans (15 пациентов; 30,1 ± 3,2 % по отношению к своей группе и контрольной группе, Р ≤ 0,01). Прочие бактериальные возбудители, St. Sanguinis (n = 2; 4 ± 0,3 %), E. faecalis (n = 2; 4 ± 0,3 %), установлены в единичных случаях без достоверной разницы с контролем (Р ≥ 0,01). Сходное состояние микробиоты обнаружено в указанной группе пациентов при исследовании гортани. Преимущественными возбудителями (рис. 1, 2) явились St. рyogenes (n = 20; 40,1 ± 4,3 %), и С. albicans (n = 18; 36,2 ± 3,7 %). В единичных случаях верифицированы St. sanguinis (n = 1; 2,04 ± 0,2 %), E. faecalis (n = 2; 4,08 ± 0,3 %), E. cloacae (n = 1; 2,04 ± 0,2 %) без достоверной разницы с контролем (Р ≥ 0,01).
В отличие от первой основной группы у трех пациентов ХОБЛ стабильного течения из среднего носового хода в диагностически значимом титре выделен E. faecalis (6,1 ± 0,5 %) без достоверной разницы с контролем и внутри своей группы (Р ≥ 0,01). Состав микробиоты глотки у пациентов второй основной группы имел незначительные отличия от первой группы и характеризовался преобладанием St. pyogenes, который был выделен у 31 лица, что составило 63,2 ± 6,6 % и было достоверно выше, чем в контрольной группе (Р ≤ 0,01), в то время как частота встречаемости С. albicans снижалась до 8 случаев, но встречалась чаще, чем в группе контроля (16,3 ± 1,05 %, Р ≤ 0,01). Иные бактериальные возбудители, St. sanguinis (n = 2; 4,08 ± 0,3) и K. pneumonia (n = 2; 4,08 ± 0,3) представлены в единичных случаях (Р ≥ 0,01) и соизмеримы с контрольной группой. В гортани у пациентов второй группы, также преимущественными возбудителями явились St. рyogenes (n = 32; 65,3 ± 6,8 %, Р ≤ 0,01) и дрожжеподобные грибы С. albicans (n = 7; 14,2 ± 1,5 %, Р ≤ 0,01). Такие бактерии, как St. sanguinis (n = 3; 6,1 ± 0,5), K. Pneumonia (n = 3; 6,1 ± 0,5) и E. faecalis (n = 4; 8,2 ± 0,7), установлены у 3-х и 4-х лиц соответственно, но достоверных различий по частоте встречаемости с контрольной группой не получено (Р ≥ 0,01).
В контрольной группе обследуемых по сравнению с основными группами (рис. 1–2), в полости носа микрофлоры не обнаружено. В глотке микроорганизмы были выделены у 10 пациентов (20,0 ± 2,09 %) и представлены St. рyogenes (n = 3), St. sanguinis (n = 3), S. aureus (n = 3), С. albicans (n = 1). В гортани 7 лиц (14,0 ± 1,51 %) в единичных случаях без достоверной разницы по отношению к основным группам выделен St. рyogenes (n = 3), St. sanguinis (n = 1), S. aureus (n = 1), E. faecalis (n = 1), С. albicans (n = 1).
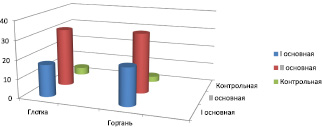
Рис. 1. Количество случаев выделения St. рyogenes из глотки и гортани у лиц в период обострения, стабильного течения ХОБЛ и в контрольной группе. Достоверная разница получена между первой основной группой и контрольной группой в глотке и гортани (Р ≤ 0,01) и второй основной группой и контрольной группой в глотке и гортани (Р ≤ 0,01)
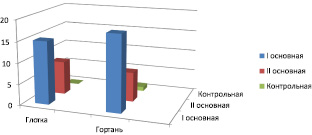
Рис. 2. Количество случаев выделения С. albicans из глотки и гортани у лиц в период обострения, стабильного течения ХОБЛ и в контрольной группе. Достоверная разница получена между первой основной группой и контрольной группой в глотке и гортани (Р ≤ 0,01) и второй основной группой и контрольной группой в глотке и гортани (Р ≤ 0,01)
Фарингомикоз, относящийся к поверхностным микозам [2, 9], у лиц основной группы проявлялся присутствием «творожистого» налета на гиперемированной поверхности задней стенки глотки, мягкого нёба и миндалин. Налеты имели белый, серый или серо-желтый цвет, располагались на слизистой оболочке в виде небольших «островков», в некоторых случаях сливаясь между собой, легко снимались шпателем, слизистая под ними была ровная, но более гиперемированная, по сравнению с той слизистой оболочкой, что окружала кандидозный «островок».
Исходя из цели исследования, авторами проанализировали состояние микробиоты ВДП в зависимости от выявленной патологии (табл. 1).
Таблица 1
Частота выделения значимых возбудителей при различных вариантах патологии глотки и гортани у пациентов в период обострения и стабильного течения ХОБЛ
|
Группа Выделенный возбудитель |
Период обострения ХОБЛ (I группа) |
Период стабильного течения ХОБЛ (II группа) |
||||
|
n = 50 |
n = 49 |
|||||
|
Хронический катаральный фарингит |
Хронический катаральный ларингит |
Хронический гиперпластический ларингит |
Хронический катаральный фарингит |
Хронический катаральный ларингит |
Хронический гиперпластический ларингит |
|
|
(n = 15) |
(n = 29) |
(n = 13) |
(n = 13) |
(n = 23) |
(n = 12) |
|
|
St. рyogenes |
7/46,7 ± 4,8 % Р ≤ 0,01 |
9/31,1 ± 3,2 % Р ≤ 0,01 |
6/46,2 ± 4,8 % Р ≤ 0,01 |
11/84,6 ± 8,8 % Р ≤ 0,01 |
18/78,2 ± 8,2 % Р ≤ 0,01 |
11/91,6 ± 9,8 % Р ≤ 0,01 |
|
С. albicans |
5/ 33,3 ± 3,4 % Р ≤ 0,01 |
8 / 27,5 ± 2,8 % Р ≤ 0,01 |
6 / 43,3 ± 4,8 % Р ≤ 0,01 |
1 / 7,7 ± 0,6 % Р ≥ 0,01 |
4/17,4 ± 1,8 % Р ≥ 0,01 |
1/ 8,3 ± 0,9 % Р ≥ 0,01 |
Как следует из представленных данных, в первой группе пациентов с хроническим катаральным фарингитом (n = 15) St. рyogenes выделен у 7 лиц (46,7 ± 4,8 %), С. albicans у 5 пациентов (33,3 ± 3,4 %). У пациентов с хроническим катаральным ларингитом (n = 29) St. рyogenes выделен у 9 лиц (31,1 ± 3,2 %), С. albicans у 8 пациентов (27,5 ± 2,8). У 13 пациентов с гиперпластическим ларингитом St. рyogenes выделен у 7 лиц (46,2 ± 4,8 %), тогда как частота встречаемости С. albicans составила соответственно 43,3 ± 4,8 % (n = 6). Во всех случаях частота была достоверно выше контрольной группы (Р ≤ 0,01).
Характеристика выявленных хронических заболеваний глотки и гортани во второй группе близка к первой группе. У пациентов со стабильным течением ХОБЛ установлен хронический катаральный фарингит (n = 13), преобладающим возбудителем явился St. рyogenes – выделен у 11 лиц (84,6 ± 8,8 %), С. albicans – у 1 пациента (7,7 ± 0,6 %). В этой же группе был определен хронический катаральный ларингит (n = 23), при котором, также наиболее частым возбудителем был определен St. рyogenes (n = 18; 78,2 ± 8,2 %) и С. albicans у 4 пациентов (17,4 ± 1,8 %), у 12 лиц гиперпластической формой хронического ларингита St. рyogenes выделен у 11 лиц (91,6 ± 9,8 %) и С. albicansу у 1 пациента (8,3 ± 0,9 %). При сравнении с контролем частота идентификации St. рyogenes достоверна (Р ≤ 0,01), в отличие от С. albicans, которая встречалась с практически такой же частотой (Р ≥ 0,01).
В контрольной группе (табл. 2) у трех пациентов обнаружен хронический катаральный фарингит, у двух – хронический катаральный ларингит. В каждой подгруппе был выделен St. рyogenes в диагностические значимых титрах в единичных случаях.
Учитывая постоянство встречаемости при различных вариантах патологии глотки и гортани у пациентов с ХОБЛ С. albicans, авторы посчитали интересным установить связь между приемом ингаляционных глюкокортикостероидов (иГКС) и присутствием С. albicans. Из 33 (66,2 ± 5,9 %) пациентов первой группы, у которых из глотки и гортани была выделена С. albicans, только 6 пациентов (12,1 ± 1,3) получали иГКС. Во второй группе из 15 (30,8 ± 2,8 %) человек получали иГКС только четверо (8,2 ± 0,86 %). Таким образом, полученные данные не позволяют проследить прямую связь между приемом иГКС и присутствием С. albicans в микробиоте глотки и гортани у пациентов основных групп.
В условиях физиологической нормы слизистые ЛОР-органов несут на себе высокую микробную нагрузку, являясь, по сути, первым защитным барьером для вдыхаемого воздуха и пищи. На состав биоценоза верхних дыхательных путей влияют самые различные факторы, к числу которых можно отнести химическое, пылевое загрязнение, резкие температурные колебания, острые и хронические заболевания органов дыхания [12, 13].
Ряд исследований свидетельствует о том, что микрофлора полости носа у пациентов с ХОБЛ представлена H. influenzae в 10 % и St. pneumoniae – 21 %, представителями семейства Еnterobacteriaceae – 3 %, S. aureus – 17 %, P. aeruginosa – 3 %, а воспаление околоносовых пазух встречается в 32,9 % при обострении ХОБЛ. При этом, состав выделенных микроорганизмов полости носа и мокроты имеет большое сходство, что, по мнению авторов исследования, ещё раз подтверждает тезис «единства верхних и нижних дыхательных путей» при ХОБЛ [5, 14]. В ранее проведенном нами исследовании [4] в большинстве случаев диагностированы хронические катаральные формы воспаления слизистой оболочки носа, при отсутствии патологии околоносовых пазух. Исходя из этого, отсутствие выделенной микрофлоры из полости носа во всех трех группах выглядит достаточно закономерным.
Таблица 2
Частота выделения возбудителей при различных вариантах патологии глотки и гортани в контрольной группе
|
Группа Выделенный возбудитель |
Контрольная группа (n = 50) |
|
|
Хронический катаральный фарингит |
Хронический катаральный ларингит |
|
|
(n = 3) |
(n = 2) |
|
|
St. рyogenes |
1/33,3 ± 1,3 % |
1/50 ± 1,6 % |
|
С. albicans |
– |
– |
К условно-патогенной микрофлоре глотки, по мнению ряда исследователей, можно отнести S. viridians, S. еpidermidis, S. aureus, S. рyogenes, нередко выделяемые в ассоциациях, а также дрожжеподобные грибы Сandida [7], что не противоречит данным, полученным у лиц контрольной группы в нашем исследовании. При хроническом фарингите бактериальная флора представлена H. influenzae, M. catarrhalis, стрептококками А, С, G, диполококками, M. pneumoniae, C. рneumoniae [6], тогда как в другом исследовании в 26,7 % случаев выделялся St. viridans, в 16,3 % St. рyogenes [3]. В нашей работе пациенты основных групп были безусловными курильщиками со стажем не менее 20 лет. Они предъявляли жалобы на першение или саднение в горле, чувство «кома», боли или неприятные ощущения в горле при глотании. Слизистая оболочка задней стенки глотки, мягкого нёба была гиперемирована, покрыта мелкими грануляциями, у части пациентов имелся слизистый или слизисто-гнойный налет, инъекция сосудов. В период обострения основного заболевания у 7 лиц (46,7 ± 4,8 %) с хроническим фарингитом выделен St. рyogenes (табл. 1). В период стабильного течения частота выделения этого возбудителя увеличивается до 84,6 % (n = 11). Полученный факт может объясняться курсом антибактериальной терапии, назначаемой пациентам в период обострения ХОБЛ. Повышение частоты выделения St. рyogenes при стабильном течении ХОБЛ свидетельствует о высокой степени контаминации этого возбудителя в глотке и гортани.
По данным исследования А.И. Крюкова и коллег, фарингомикоз занимает первое место, опережая даже отомикоз [8]. В нашем исследовании микотическое поражение глотки дрожжеподобными грибами С. albicans (рис. 2) в первой и второй основной группе встречалось у 33 и 15 лиц (66,2 ± 5,9 и 30,8 ± 2,8 %). У 15 пациентов с хроническим фарингитом (табл. 1) в период обострения ХОБЛ С. albicans выявлена в 33,3 ± 3,4 % (n = 5), в период стабильного течения эта цифра уменьшается до 7,7 ± 0,6 (n = 1). Схожая картина наблюдается в гортани, где выделение С. albicans имеет подобную тенденцию. Нарушение иммунной реактивности, точнее его клеточного звена, особенно отчетливо проявляется в период обострения основного заболевания, увеличивая колонизацию глотки и гортани дрожжеподобными грибами С. albicans. В период стабильного течения наблюдается обратный процесс, что можно связать с наступающими репаративными процессами в слизистой оболочке ВДП.
Исходя из основных функций, присущих гортани, можно заключить что она наиболее подвержена влиянию неблагоприятных факторов внешней среды, производственных и бытовых ирритантов, лекарственных средств, особенно при их ингаляционной доставке. Микрофлора гортани здоровых лиц представлена St. salivarius, St. mitis, St. epidermidis, M. Lacunata [14]. При хроническом ларингите микробный пейзаж значительно трансформируется, на первое место выходят ассоциации S. aureus и St. аnhaemolyticus, St. aureus и St. viridans, а также ассоциации S. aureus и St. рyogenes [10, 11], что совпадает с результатами нашего исследования, когда наиболее частым представителем микроорганизмов явился грамположительный пиогенный стрептококк.
Преобладание St. рyogenes в обеих группах явилось прогнозируемым результатом. Определенной неожиданностью явилось кажущееся снижение выделения St. рyogenes при обострении ХОБЛ по сравнению с ХОБЛ стабильного течения (n = 37 и n = 63; Р ≤ 0,01). На наш взгляд, это связано с использованием парентеральных антибактериальных препаратов в протоколах лечения обследуемых. Заслуживает внимания факт повышения частоты выделения St. рyogenes при гиперпластических ларингитах по сравнению с катаральными формами, как при обострении, так и стабильном течении ХОБЛ (табл. 1). Одной из причин полученного результата может быть формирование биопленок, участвующих в развитии лекарственной устойчивости возбудителей. Однако это предположение носит гипотетический характер и требует проведения дальнейшего исследования.
В настоящее время потенциальными возбудителями микозов являются более 400 видов грибов. Их возникновение тесно связано с нарушениями в составе иммунного ответа. В 80 % случаев возбудителем микоза гортани является С. аlbicans [2]. Пенетрацию С. аlbicans через эпителий и последующую инвазию в подлежащие ткани обеспечивают гидролитические ферменты, которые разобщают и/или разрушают клетки покровных тканей. Помимо этого, антигены грибов имеют относительно низкую иммуногенность: они практически не индуцируют антителообразование, и как следствие, «напряженность» специфического иммунитета при грибковых инфекциях значительно ниже, что затрудняет эффективность лечения [2, 8, 9].
В нашем исследовании клиническая картина кандидоза гортани представлена гиперемией слизистой оболочки гортани, с наличием «творожистых» налётов серого, серо-белого, жёлтого цвета разной толщины, располагавшихся точечно или сливавшихся в виде «островков». Подобные налеты могли одновременно находиться в различных отделах гортани, на голосовых складках, подскладочном пространстве, задней стенки гортаноглотки. У всех больных выявлена катарально-плёнчатая форма кандидоза гортани [2], при которой на фоне «творожистых» налётов различной толщины и площади имелись скопления слизи, а также наличие типичных для хронического воспаления гортани «слизистых мостиков» на границе передней и средней трети голосовых складок. Специфических различий в жалобах пациентов между хроническим бактериальным или кандидозным ларингитом мы не обнаружили. В период обострения основного заболевания частота выделения С. albicans в глотке увеличивается, тогда как в период стабильного течения снижается вдвое. Аналогичная тенденция имеется и в гортани (табл. 1). При гиперпластических формах ларингита в первой основной группе С. albicans выделяется чаще, чем при катаральном ларингите. Не исключено, что подобное проявление местного иммунодефицита связано с повышенной колонизацией слизистой оболочки гортани St. рyogenes, формированием последними биопленок, а также применением ингаляционных кортикостероидов. В 2008 году нами был проведён анализ научных публикаций, представленных в базах медицинских исследований «Медлайн», «Эмбейс», «Кохрановская лаборатория», контролируемых рандомизированных исследований, связанных с включением ингаляционных кортикостероидов в лечение пациентов III и IV стадии ХОБЛ. Рассмотрено 9 научных исследований (с общим числом испытуемых 7992 человек), согласно которым добавление к длительной монотерапии бронходилататорами ингаляционных кортикостероидов уменьшает риск обострений основного заболевания, но увеличивает вероятность развития кандидоза глотки и полости рта в 3 раза [15]. Мы наблюдали несколько случаев распространённого кандидоза полости рта, глотки, гортани и даже начальных отделов трахеи. Интерес данного наблюдения заключается ещё и в том, что подобные изменения мы обнаружили, как у пациентов, длительно пользующихся ингаляционными кортикостероидами, так и у лиц, которые их никогда не применяли.
При анализе микробиоты ВДП у лиц в период обострения и стабильного течения ХОБЛ обращает внимание достоверно чаще выделяемый St. рyogenes и в период обострения дрожжеподобные грибы С. albicans. Данные микроорганизмы являясь, по сути, условно-патогенной микрофлорой, в условиях обострения основного заболевания превалируют в составе нормобиоценоза. Ещё одним немаловажным обстоятельством является то, что при ХОБЛ патологические процессы регистрируются в количественном отношении чаще в глотке и в гортани. Подтверждением этого является скудная микробная флора полости носа, тогда как в наибольшем количестве случаев бактериальная и грибковая микрофлора в глотке и гортани выделяется как в период обострения, так и при стабильном течении.
Заключение
Микробный состав дыхательных путей, это касается не только сапрофитных бактерий, но и видового и серотипового спектра патогенных организмов, в его верхнем отделе может динамично и постоянно меняться в зависимости от возраста, пола пациентов, географической и климатической зон, что обуславливает необходимость постоянного мониторинга видового состава эпидемиологически значимых микроорганизмов.
Планирование рациональной эмпирической стартовой антибактериальной терапии ХОБЛ подразумевает владение врачом знаниями об основных патогенах, вызывающих данное состояние, умением оценивать остроту и тяжесть воспалительного процесса, знанием антимикробных препаратов, чувствительных к наиболее вероятным бактериальным или грибковым возбудителям, а также способность выявлять возможные коморбидные состояния, особенно со стороны верхних дыхательных путей, влияющие на течение основного заболевания и снижающие число обострений ХОБЛ.
Данная научная работа выполнена при поддержке гос. контракта 14.740.11.0186.
Рецензенты:
Иванец И.В., д.м.н., профессор, врач-оториноларинголог, Медицинский центр, Дальневосточный федеральный университет, г. Владивосток;
Кокорина В.Э., д.м.н., профессор, заведующая кафедрой отоларингологии, Дальневосточный государственный медицинский университет, Городская больница № 2 им. Д.Н. Матвеева, г. Хабаровск.
Библиографическая ссылка
Гилифанов Е.А., Невзорова В.А., Артюшкин С.А., Туркутюков В.Б., Тилик Т.В., Вайсеро Н.С., Ардеева Л.Б. ХАРАКТЕРИСТИКА МИКРОБИОТЫ ВЕРХНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ У ПАЦИЕНТОВ С ХРОНИЧЕСКОЙ ОБСТРУКТИВНОЙ БОЛЕЗНЬЮ ЛЕГКИХ В РАЗЛИЧНЫЕ ПЕРИОДЫ ТЕЧЕНИЯ ЗАБОЛЕВАНИЯ // Фундаментальные исследования. 2015. № 1-10. С. 2031-2037;URL: https://fundamental-research.ru/ru/article/view?id=38591 (дата обращения: 03.03.2026).



