Бурное развитие фармацевтической отрасли в последнее десятилетие сопровождается образованием и накоплением фармацевтических отходов. Попадание в окружающую природную среду высокостабильных, токсичных фармполлютантов, которые характеризуются не только необычностью структуры, но и высокой биологической активностью ингредиентов, крайне нежелательно даже в относительно низких концентрациях [7]. Продолжительное выделение фармпрепаратов и их метаболитов в сточные воды может приводить к их аккумуляции и тем самым стимулировать отрицательное воздействие этих химических соединений на окружающую среду [10]. Одним из наиболее часто обнаруживаемых в сточных, грунтовых, поверхностных водах (и даже питьевой воде) лекарственных препаратов является широко применяемый в медицинской практике парацетамол (N–(4-гидроксифенил)ацетамид) [7, 10]. Парацетамол обладает выраженным обезболивающим и антипиретическим действием. Из-за своих физико-химических свойств (наличие бензольного кольца, замещенного гидроксильной группой и ацетаминогруппой в пара (1,4)-положении) парацетамол потенциально персистентен, мобилен в водных и сухопутных экосистемах [10, 13].
В ранее проведённых нами исследованиях установлена способность актинобактерий Rhodococcus ruber разрушать химическую структуру парацетамола [3]. В процессе ферментолиза парацетамола в культуральной среде родококков были идентифицированы п-аминофенол, гидрохинон, пирокатехин, муконовая кислота. Процесс биодеструкции парацетамола сопровождался постепенным приобретением культуральной средой коричневой окраски и последующим образованием гидрофобного темноокрашенного (благодаря присутствию хиноидных соединений) круповидного, оседающего на дно колбы осадка. Массовая доля выхода осадка от исходного количества парацетамола составляла 20 %. Жидкость над осадком оставалась прозрачной. Формирование этого осадка, возможно, связано с высокой адгезивной активностью родококков в отношении парацетамола, усиленным синтезом внеклеточных полимеров, а также полимеризацией интермедиатов (фенольных и хиноидных соединений) бактериальной деструкции парацетамола. С использованием метода солевой агрегации показано, что родококки формируют клеточные агрегаты под действием сравнительно низких (0,2−0,4 М) концентраций сульфата аммония, что свидетельствует о выраженной гидрофобности их клеточной стенки [5]. Возможность полимеризации продуктов деградации парацетамола при участии пероксидазы хрена подтверждена исследованием D.W. Potter с соавт. [12]. В работах P. Kar с соавт. [8, 9] рассмотрена окислительная полимеризация о-, м- и п-аминофенола и представлены результаты определения средней молекулярной массы поли-м-аминофенола [8].
Цель настоящего исследования − определение средней молекулярной массы осадка, образующегося в результате биодеструкции парацетамола клетками R. ruber ИЭГМ 77.
Материалы и методы исследования
В работе использовали штамм R. ruber ИЭГМ 77 из Региональной профилированной коллекции алканотрофных микроорганизмов (официальный акроним коллекции ИЭГМ, номер во Всемирной федерации коллекций культур (WFCC) #768) [14]. Парацетамол в виде фармацевтической субстанции (Аньцю Луань Фармасьютикал Ко., Лтд., Китай) вносили в среду культивирования родококков до конечной концентрации 2000 мг/дм3. Эксперименты по биодеструкции парацетамола проводили в условиях периодического культивирования клеток R. ruber ИЭГМ 77 при 28 °С в течение 20 сут [3]. Образовавшийся осадок (ОО) отфильтровывали, трижды промывали дистиллированной водой и высушивали до постоянной массы.
Содержание воды в ОО определяли на анализаторе влажности МА-30 (Sartorius, Германия). Элементный анализ (С, Н, N) выполняли с помощью элементного анализатора Leco CHNS-9321P (Leco Europe B.V., Нидерланды). Результаты элементного анализа корректировали с учётом влажности и зольного остатка, полученного в результате “мокрой” минерализации ОО [1].
Среднюю молекулярную массу ОО определяли методами гель-проникающей хроматографии и капиллярной вискозиметрии. Для определения средней молекулярной массы ОО вискозиметрическим методом готовили серию растворов ОО в ДМСО в диапазоне концентраций от 0,0125 до 0,0500 г/см3. Полученные растворы фильтровали через стеклянный фильтр с диаметром пор 100–160 мкм. Удельную вязкость (ηуд) растворов и растворителя определяли, измеряя время их истечения в капиллярном вискозиметре с диаметром капилляра 0,56 мм в соответствии с методикой [2] по формуле
ηуд = (t – t0)/t0,
где t – время истечения раствора ОО, с; t0 – время истечения растворителя, с.
Объём растворителя и растворов ОО составлял 10,00 см3 при температуре 20 °С. Расчёт средней молекулярной массы ОО осуществляли по уравнению Марка-Куна-Хаувинка [2]:
[η] = K∙Mα, (1)
где α – константа, характеризующая форму макромолекулы в растворе; K – константа для данного гомологического ряда полимеров и растворителя. Параметры K и α в формуле (1) рассчитывали по данным работ P. Kar с соавт. [8, 9] и N. Naar с соавт. [11].
Для определения средней молекулярной массы ОО методом гель-проникающей хроматографии использовали Sephadex G-100 с диаметром частиц 40–120 мкм (Pharmacia Fine Chemicals, Швеция), имеющий пределы фракционирования 4000–150000 Да. Хроматографическую колонку размерами 30,0×1,5 см заполняли гелем сефадекса, предварительно подготовленным согласно методике [4]. Объём геля сорбента составлял 46,8 см3 при высоте наполнения в колонке 26.5 см. В качестве элюента использовали 0,1 М раствор NaOH. Исследуемым образцом являлся 0,25 % раствор ОО в 0,1 М растворе NaOH. Нанесение образца на гель в объеме 0,20 см3 и хроматографирование осуществляли в соответствии с методиками [4]. Скорость фильтрации составляла 0,1 см3/мин. Для сбора фракций использовали стеклянные пикнометры вместимостью 2,00–10,00 см3. Детектирование фракций осуществляли в диапазоне длин волн 200–700 нм на спектрофотометре Lambda EZ 201 (Perkon Elmer, CША). Полученные данные использовали для построения трехмерного графика, отражающего зависимость между оптической плотностью (A), объемом выхода фракций (Vl) и длиной волны (λ).
Подбор аналитической длины волны, необходимой для определения объема выхода элюата, соответствующего средней молекулярной массе ОО, выполняли по градуировочному графику зависимости A (λ) для серии растворов ОО в 0,1 М растворе NaOH в диапазоне концентраций от 0,0500 до 0,2500 г/см3. Растворы ОО фильтровали через бумажные обеззоленные фильтры.
Расчет средней молекулярной массы ОО осуществляли по стандартной формуле [4]:
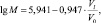 (2)
(2)
где Vl – объем выхода элюата, соответствующий точке максимума на трехмерном графике зависимости A (Vi, λ) при выбранной длине волны, см3; V0 – объем растворителя между гранулами геля («свободный» растворитель), см3. Объем растворителя между гранулами рассчитывали, исходя из характеристик набухания Sephadex G-100 в воде и объема геля в колонке [4].
Результаты исследования и их обсуждение
На рис. 1 представлен график линейной зависимости приведенной вязкости (ηуд/c) от концентрации растворов ОО. Значение характеристической вязкости [η], полученное посредством экстраполяции линии тренда на ось ординат, равно 5,1 см3/г.
Значения K и α в формуле (1) для определения средней молекулярной массы ОО неизвестны. По данным N. Naar с соавт., значение α для полианилина, являющегося своеобразным «химическим каркасом» полиаминофенолов, составляет 0,73 [11]. Значение K зависит от природы полимера и растворителя [6]. Так, по данным P. Kar с соавт., для одного из продуктов полимеризации м-аминофенола получены значения характеристической вязкости [η] его растворов в ДМСО и средней молекулярной массы, равные 203,0 см3/г и 100000 Да, соответственно [8]. На основании результатов исследований P. Kar с соавт. [8] и N. Naar с соавт. [11] нетрудно найти искомое значение K в формуле (1) для определения средней молекулярной массы ОО:
K = 203,0/1000000.73 = 0,0455.
Таким образом, средняя молекулярная масса ОО, рассчитанная по уравнению 5,1 = 0,0455∙M0,73, равна 643,16 Да.
Для определения средней молекулярной массы ОО наряду с капиллярной вискозиметрией использовали метод гель-хроматографии. Как видно из рис. 2, на трехмерном графике зависимости A(Vl, λ) отмечаются два пика при длинах волн 218 и 318 нм, которые соответствуют объему выхода элюата 50,00 см3.
Для выбора аналитической длины волны далее были построены графики зависимости оптической плотности от длины волны растворов ОО в диапазоне концентраций (c) от 0,0500 до 0,2500 г/см3. Как видно из рис. 3, во всех электронных спектрах отмечаются максимумы поглощения при длинах волн 218 и 318 нм.
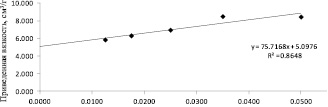
Рис. 1. Зависимость приведённой вязкости от концентрации раствора ОО
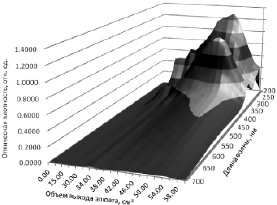
Рис. 2. Трехмерный график зависимости оптической плотности полученных фракций от объема выхода элюата и длины волны
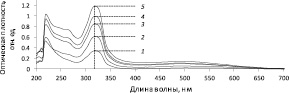
Рис. 3. Спектры поглощения растворов ОО с различными концентрациями: 1 – 0,0500 г/см3; 2 – 0,1000 г/см3; 3 – 0,1500 г/см3; 4 – 0,2000 г/см3; 5 – 0,2500 г/см3
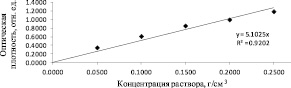
Рис. 4. Градуировочный график зависимости оптической плотности от концентрации раствора ОО при длине волны 318 нм
Линейная зависимость A (c) проявляется при λmax = 318 нм (рис. 4).
Коэффициент перехода (L) от оптической плотности к концентрации раствора ОО при 318 нм равен 5,1025. Содержание ОО (мкг) во фракциях, собранных в процессе гель-фильтрации, рассчитывали, исходя из полученного значения коэффициента L.
Распределение содержания ОО во фракциях № 5–19 представлено на рис. 5.
Как видно из рис. 5, максимальное содержание ОО отмечается во фракции № 14, соответствующей объему выхода элюата 50,00 см3.
По данным гель-фильтрации, средняя молекулярная масса ОО, рассчитанная по формуле (2), составляет 5973,55 Да. Данное значение значительно отличается от результатов (643,16 Да), полученных с использованием метода капиллярной вискозиметрии. Это находит объяснение в использованных нами расчетных формулах. При определении средней молекулярной массы ОО методом гель-хроматографии применяли уравнение для расчета средней молекулярной массы глобулярных белков. Следовательно, для сравнения использованных нами методов необходимо внести поправку в значение α, равное 0,73 [11], использованное нами при определении средней молекулярной массы ОО вискозиметрическим методом, и приблизить его к значению 0,50, соответствующему полимерам со сферической формой молекул [6]. С учетом поправки при K = 0,0455 и M = 5973,55 Да параметр α становится равным 0,5429, что подтверждает результаты определения средней молекулярной массы ОО методом гель-хроматографии.
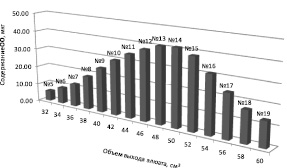
Рис. 5. Распределение содержания ОО во фракциях
Элементный состав ОО и поли-м-аминофенола
|
Объект анализа |
С |
H |
N |
O + S |
|
ОО |
48,45 |
4,83 |
10,17 |
36,56 |
|
Поли-м-аминофенол |
52,75 |
4,85 |
10,25 |
32,20 |
Результаты элементного анализа ОО, представленные в таблице, сопоставимы с теоретическими значениями содержания C, H, N в поли-м-аминофеноле [8].
Заключение
Средняя молекулярная масса (5973,55 Да) осадка, образующегося в культуральной жидкости Rhodococcus ruber ИЭГМ 77 в процессе биодеструкции парацетамола, установленная с помощью методов гель-фильтрации и капиллярной вискозиметрии, свидетельствует о полимерной природе продукта. Исходя из предложенных путей биодеструкции парацетамола [3, 15] и данных элементного анализа, в качестве одного из потенциальных мономеров может рассматриваться производное п-аминофенола.
Дальнейшие исследования осадка, образующегося в результате биодеструкции парацетамола клетками R. ruber ИЭГМ 77, будут посвящены установлению его структуры.
Исследования выполнены при частичной поддержке Программы ОБН РАН № 12 «Живая природа: современное состояние и проблемы развития» (проект № 15-12-4-10) и гранта Российского научного фонда (№ 14-14-00643).
Рецензенты:
Ярыгина Т.И., д.фарм.н., профессор кафедры фармацевтической химии, ГБОУ ВПО «ПГФА» Минздрава России, г. Пермь;
Михайловский А.Г., д.фарм.н., профессор кафедры общей и органической химии, ГБОУ ВПО ПГФА Минздрава России, г. Пермь.
Библиографическая ссылка
Коротаев М.Ю., Рычкова М.И., Вихарева Е.В., Ившина И.Б. ОПРЕДЕЛЕНИЕ СРЕДНЕЙ МОЛЕКУЛЯРНОЙ МАССЫ НЕРАСТВОРИМЫХ ПРОДУКТОВ БИОДЕСТРУКЦИИ ПАРАЦЕТАМОЛА КЛЕТКАМИ RHODOCOCCUS RUBER ИЭГМ 77 // Фундаментальные исследования. 2015. № 2-26. С. 5850-5854;URL: https://fundamental-research.ru/ru/article/view?id=38517 (дата обращения: 21.02.2026).



