В настоящее время для оценки интенсивности физической нагрузки и наличия повреждения мышечной ткани используется множество биомаркеров. В качестве маркеров повреждения рассматривают увеличение: активности в крови ферментов креатинкиназы (КК), лактатдегидрогеназы (ЛДГ), аспартатаминотрансферазы (АСТ), аланинаминотрансферазы (АЛТ) и др., содержания белков – тропонина I (Тн I), миозина, миоглобина и др. Факторами повреждения при мышечной активности могут быть перенапряжение, выброс гормонов стресса, гипоксия, реперфузия и др. В ответ на повреждение происходит изменение структуры внутриклеточных мембран и их проницаемости, нарушение барьерной функции мембран, снижение способности к связыванию ферментов [11], развитие гиперферментемии. В то же время ряд авторов рассматривает ферментемию в качестве адаптивной реакции в ответ на изменение условий жизнедеятельности организма [10]. Доказательством этого положения является временная неоднородность появления в крови метаболически родственных ферментов и очень высокая активность ферментов в крови на фоне благополучия организма [5]. Делается вывод, что можно выделить два вида ферментемии – «функционально оптимальную (адаптивную) и биохимически бессмысленную (истинный цитолиз)» [10]. Возникает вопрос, имеется ли зависимость между ферментемией, определенными мышечными белками в крови и интенсивностью мышечной деятельности и следует ли рассматривать ферментемию только в качестве индикатора повреждения.
Цель исследования – изучение у крыс активности ферментов в крови (ЛДГ, КК, КК-МВ, АЛТ, АСТ), а также содержание молочной кислоты и тропонина I при физических нагрузках различной интенсивности и продолжительности.
Материалы и методы исследования
Исследование проведено на 105 белых беспородных крысах обоего пола массой 250–300 грамм. Все эксперименты выполнены согласно Европейской Конвенции по защите экспериментальных животных (Хельсинкской декларации 1975 г. и ее пересмотра в 1983 г.). Исследуемые животные были разделены на контрольную группу (интактные крысы) опытные – животные, подвергавшиеся физической нагрузке (плаванию) разной интенсивности. Одна группа животных подверглась острой физической нагрузке субмаксимальной мощности (ОФН) [6], вторая – хронической физической нагрузке (ХФН) субмаксимальной мощности, третья – ХФН умеренной мощности [3]. ХФН моделировали ежедневным плаванием 30 минут – 21 день, забор крови производился на 9, 15 и 21 день эксперимента после физической нагрузки. Концентрацию молочной кислоты определяли калориметрическим методом; активность ферментов: лактатдегидрогеназы – оптимизированным кинетическим методом; аланинаминотрансферазы и аспартатаминотрансферазы – унифицированным методом Райтмана – Френкеля в сыворотке крови с помощью наборов реагентов фирмы «Ольвекс Диагностикум», Санкт-Петербург; активность креатинкиназы – оптимизированным кинетическим методом и МВ изозима креатинкиназы (КК-МВ) – оптимизированным кинетическим иммунологическим методом в сыворотке крови с помощью наборов реагентов фирмы «Витал Девелопмент Корпорэйшен», Санкт-Петербург. Активность тропонина I определяли иммуноферментным методом в сыворотке крови с помощью набора реагентов фирмы «ХЕМА», Германия. Рассчитывали коэффициент де Ритиса (АСТ/АЛТ) и индекс повреждения мышечной ткани (КФК/АСТ). Для определения достоверности различий средних величин применяли критерий Манна – Уитни (U), определяли основную тенденцию изменений (тренд) и коэффициент аппроксимации, для оценки силы влияния использовали однофакторный и двухфакторный дисперсионный анализ, корреляционный анализ.
Результаты исследования и их обсуждение
При любом виде физической нагрузки в крови уровень молочной кислоты достоверно выше, чем в контроле (табл. 1). ОФН привела к выраженной лактатемии, содержание молочной кислоты увеличилось на 85,6 % по сравнению с контролем. Однофакторный дисперсионный анализ показал достоверное влияние ОФН (р-0,00004) на уровень молочной кислоты, сила влияния составила 83,8 ± 1,2 %. ХФН умеренной мощности привела к постепенному повышению содержания молочной кислоты во все сроки эксперимента (на 50–73 %), что подтверждается трендом и высоким коэффициентом аппроксимации R2 = 0,9137. ХФН субмаксимальной мощности привела к более сильному повышению концентрации молочной кислоты (на 72–114 %), что также подтверждается восходящим трендом и коэффициентом аппроксимации R2 = 0,8895. Уровень молочной кислоты определяется интенсивностью физической нагрузки. При ОФН уровень молочной кислоты достоверно выше, чем при ХФН умеренной мощности во все сроки наблюдения (9 сутки – р = 0,0016; 15 сутки – р = 0,005; 21 сутки – р = 0,023); при ХФН субмаксимальной мощности достоверно выше относительно ХФН умеренной мощности во все сроки наблюдения (9 сутки – р = 0,034; 15 сутки – р = 0,038; 21 сутки – р = 0,021); при ХФН субмаксимальной мощности уровень молочной кислоты достоверно выше чем при ОФН на 21 сутки (р = 0,044) (табл. 1). Двухфакторный дисперсионный анализ показал, что содержание молочной кислоты определяется как интенсивностью воздействия, так и сроком нагрузки в целом, влияние вариантов их взаимодействия составляет 59,51 %. Общепринятым объяснением продуцирования лактата при субмаксимальных и максимальных нагрузках является недостаточное поступление кислорода к клеткам работающей мышцы. Гипоксия в скелетных мышцах может иметь место даже в состоянии покоя. Также было показано, что лактат производится при максимальной нагрузке, несмотря на относительно высокое содержание кислорода и высокое парциальное напряжение кислорода в крови [2]. При максимальных физических нагрузках давление кислорода 21,7 мм. рт.ст., это давление выше, чем «критическое давление кислорода», необходимое для окислительного фосфорилирования в митохондриях. Недостаточное поступление кислорода не может служить причиной продукции лактата при физической нагрузке. Предполагается, что имеется несоответствие между гликолитической и окислительной способностями клетки [12].
Уровень миокардиального тропонина I достоверно выше, чем в контроле, при всех видах физической нагрузки (табл. 1). ОФН привела к повышению уровня белка в крови на 163 % по сравнению с контролем. ХФН умеренной мощности привела к постепенному повышению содержания тропонина I, с достоверно значимым повышением на 15 и 21 день эксперимента (15 сутки – на 84 %; 21 сутки – 129,9 %), что подтверждается восходящим трендом и высоким коэффициентом аппроксимации R2 = 0,91. ХФН субмаксимальной мощности привела к более сильному повышению концентрации молочной кислоты во все сроки (на 109,15 – 137,1–170,2 % соответственно), что также подтверждается аналогичным трендом и коэффициентом аппроксимации R2 = 0,99. Достоверные различия по содержанию тропонина в крови при различных нагрузках были получены лишь относительно ОФН и ХФН умеренной мощности (9 сутки). Двухфакторный дисперсионный анализ показал, что повышение этого белка не зависит от интенсивности и срока нагрузки. В настоящее время тропонин I и тропонин Т используются в диагностике и оценке не только острого инфаркта миокарда, но и при «неинфарктных» повреждениях сердечной мышцы. Более того, акцентируется внимание на выход тропонинов в кровоток в физиологических условиях. Причины этого явления могут быть связаны с маломасштабным некрозом миоцитов, апоптозом, протеолитической деградацией тропонинов, повышенной проницаемостью мембран кардиомиоцитов при напряжении миокарда или относительной ишемии, образованием и высвобождением мембранных везикул при нормальном метаболизме миоцитов [4].
Динамика активности ферментов при физической нагрузке различной интенсивности представлена в табл. 2. Анализ активности ЛДГ, фермента углеводного обмена, катализирующего одну из важнейших реакций анаэробного гликолиза – взаимопревращение пировиноградной и молочной кислот, являющегося важным биохимическим диагностическим тестом для оценки работы мышечной ткани в условиях анаэробного гликолиза, установил достоверное увеличение активности фермента при физических нагрузках, имеющих анаэробно-аэробный характер: ОФН и ХФН субмаксимальной мощности. При ОФН активность ЛДГ увеличилась в 2 раза по сравнению с контролем. Кроме того, активность ЛДГ при ОФН достоверно выше, чем при хронической физической нагрузке любой мощности. Однофакторный дисперсионный анализ показал достоверное влияние ОФН (р = 0,000085) на активность ЛДГ, сила влияния составила 81,9 ± 1,4 %. Активность ЛДГ при ХФН умеренной мощности постепенно нарастала, хоть и не так значительно (на 21–25 %), и только на 15 сутки стала достоверно выше контрольных значений (р = 0,03). ХФН умеренной мощности является аэробной, следовательно, и активность ЛДГ повышается незначительно, так как основное энергообеспечение происходит за счет аэробного метаболизма глюкозы. ХФН субмаксимальной мощности привела к постепенному повышению содержания ЛДГ во все сроки эксперимента (на 36,3–57,6 %), что подтверждается восходящим трендом при высоком коэффициенте аппроксимации R2 = 0,8547. Двухфакторный дисперсионный анализ показал, что влияние интенсивности физической нагрузки на активность ЛДГ достоверно, но не столь значительно и составляет 21 %. Поскольку при адаптации активность ЛДГ в скелетных мышцах может увеличиться в 2 раза, то и отмеченные нами различные степени увеличения активности ЛДГ в сыворотке крови при ОФН И ХФН субмаксимальной мощности укладываются в рамки физиологической и биохимической адаптации [7, 8].
Таблица 1
Динамика изменения уровня молочной кислоты и тропонина I при физической нагрузке различной интенсивности
|
Показатель |
Контроль (n = 7) |
ОФН (n = 7) |
ХФН умеренной мощности |
ХФН субмаксимальной мощности |
||||
|
9 сутки (n = 7) |
15 сутки (n = 7) |
21 сутки (n = 7) |
9 сутки (n = 7) |
15 сутки (n = 7) |
21 сутки (n = 7) |
|||
|
Молочная кислота, ммоль/л |
3,34 ± 0,35 |
6,2 ± 0,09 *р = 0,0016 |
5,01 ± 0,11 *р = 0,0055 **р = 0,0016 |
5,60 ± 0,12 *р = 0,0016 **р = 0,005 |
5,78 ± 0,12 *р = 0,0016 **р = 0,023 |
5,74 ± 0,28 *р = 0,0016 ^р = 0,034 |
5,96 ± 0,15 *р = 0,0015 ^р = 0,038 |
7,136 ± 0,39 *р = 0,0016 **р = 0,044 ^р = 0,021 |
|
Тропонин I, нг/л |
3,44 ± 0,78 |
9,05 ± 0,77 *р = 0,006 |
5,36 ± 0,64 **р = 0,010 |
6,36 ± 0,99 *р = 0,016 |
7,91 ± 1,06 *р = 0,016 |
7,19 ± 1,24 *р = 0,016 |
8,16 ± 1,63 *р = 0,037 |
9,29 ± 1,04 *р = 0,01 |
Примечания: * – достоверность различий с контролем; ** – с ОФН ; ^ – между ХФН субмакс. мощности и ХФН умеренной мощности по критерию Манна – Уитни.
Таблица 2
Динамика ферментемии при физической нагрузке различной интенсивности
|
Показатель |
Контроль (n = 7) |
ОФН (n = 7) |
ХФН умеренной мощности |
ХФН субмаксимальной мощности |
||||
|
9 сутки (n = 7) |
15 сутки (n = 7) |
21 сутки (n = 7) |
9 сутки (n = 7) |
15 сутки (n = 7) |
21 сутки (n = 7) |
|||
|
ЛДГ, ед/л |
176,79 ± 10,71 |
253,57 ± 21,43 *р = 0,0014 |
214,29 ± 17,77 **р = 0,003 |
218,57 ± 14,77 *р = 0,03 **р = 0,003 ^р = 0,024 |
220,71 ± 19,49 **р = 0,003 *^р = 0,031 |
241,07 ± 21,43 *р = 0,017 **р = 0,009 |
273,21 ± 17,77 *р = 0,0026 **р = 0,022 |
278,57 ± 13,83 *р = 0,0018 **р = 0,015 |
|
КК, ед/л |
421,3 ± 33,88 |
641,02 ± 62,38 *р = 0,008 |
644,24 ± 46,59 *р = 0,006 |
662,24 ± 54,41 *р = 0,006 |
700,49 ± 55,8 *р = 0,003 |
785,35 ± 50,89 *р = 0,0015 |
786,34 ± 94,33 *р = 0,0023 |
859,65 ± 53,42 *р = 0,0016 **р = 0,036 |
|
КК-МВ, ед/л |
22,67 ± 2,05 |
31,84 ± 2,12 *р = 0,014 |
25,33 ± 2,08 |
26,92 ± 2,29 |
26,73 ± 1,94 |
22,67 ± 1,25 **р = 0,008 |
24,07 ± 1,49 **р = 0,019 |
29,04 ± 3,12 |
|
АЛТ, мкмоль/чхл |
0,59 ± 0,058 |
0,96 ± 0,052 *р = 0,036 |
0,71 ± 0,027 **р = 0,006 ^р = 0,026 |
0,72 ± 0,037 **р = 0,009 |
0,806 ± 0,034 *р = 0,015 **р = 0,041 ^р = 0,016 |
0,81 ± 0,022 *р = 0,007 **р = 0,03 |
0,81 ± 0,018 *р = 0,0038 **р = 0,038 |
0,96 ± 0,04 *р = 0,002 |
|
АСТ, мкмоль/чхл |
1,26 ± 0,057 |
1,86 ± 0,072 *р = 0,0014 |
1,886 ± 0,106 *р = 0,0025 |
1,94 ± 0,095 *р = 0,0015 |
2,03 ± 0,091 *р = 0,001 |
1,96 ± 0,097 *р = 0,0015 |
2,03 ± 0,119 *р = 0,0015 |
2,086 ± 0,096 *р = 0,0015 |
Примечания: * – достоверность различий с контролем; ** – с ОФН ^ – между ХФН субмаксимальной мощности и ХФН умеренной мощности по критерию Манна – Уитни.
Однонаправленные изменения активности ЛДГ и концентрации лактата после выполнения физической нагрузки (рис. 1, 2) указывают на стабильность работы звеньев анаэробно-гликолитического механизма энергообеспечения скелетной мускулатуры и системно-адаптивное повышение активности фермента [1, 10].
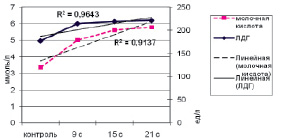
Рис. 1. Изменение уровня молочной кислоты и ЛДГ при ХФН умеренной мощности
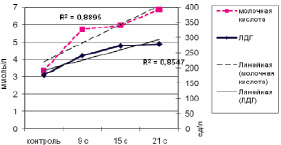
Рис. 2. Изменение уровня молочной кислоты и ЛДГ при ХФН субмаксимальной мощности
Коэффициенты корреляции между содержанием молочной кислоты и активностью ЛДГ подтверждают это положение: при ОФН – R = 0,875 (р ≤ 0,01), при ХФН умеренной мощности – –R = 0,4 (р > 0,05) и при ХФН субмаксимальной мощности – R = 0,721 (р ≤ 0,01).
Оценивая активность КК, выявили достоверное повышение (р ≤ 0,05) при всех видах физической нагрузки. Активность КК при ОФН увеличилась на 52,3 % по сравнению с контролем. Сила влияния ОФН составила 34,5 % (однофакторный дисперсионный анализ, р = 0,021). ХФН умеренной мощности привела к постепенному повышению активности КК во все сроки эксперимента (на 53–66 %), что подтверждается восходящим трендом и высоким коэффициентом аппроксимации R2 = 0,9586. ХФН субмаксимальной мощности привела к более сильному повышению активности КК (на 86–104 %), что также подтверждается аналогичным трендом и коэффициентом аппроксимации R2 = 0,759. Увеличение активности КК лишь в небольшом проценте зависит от интенсивности физической нагрузки, сила влияния которой составила 17,5 % (β ≥ 0,95). Возрастание активности КК при всех видах нагрузки, особенно при ХФН субмаксимальной мощности, отражает тренированность и высокие адаптивные способности организма, обеспечивая транспорт фосфатов с помощью креатинфосфатного челночного механизма из митохондрий к АТФазам в условиях нагрузки и дефицита кислорода. КК – стабильный фермент, определяющий адаптацию к физической нагрузке через креатинфосфокиназный механизм энергообразования. Известно, что чем выше уровень КК, тем выше спортивная тренированность и гиперферментемия по КК является благоприятным признаком [1]. У спортсменов активность КК и ЛДГ значительно превосходит таковую у обычных людей. Данный факт отражает адаптацию организма спортсмена к физическим нагрузкам высокой интенсивности. Если у нетренированного человека при повреждении скелетной мускулатуры уровни КК и ЛДГ растут на порядок, то у спортсменов они зачастую остаются неизменными [9]. И только увеличение в крови активности КК, превышающее норму более чем в 10 раз, указывает на деструкцию мышц. Активность КК-МВ достоверно увеличилась только при ОФН на 40,26 % относительно контроля. Сила влияния ОФН на активность КК – МВ составила 44,5 % (р = 0,009, однофакторный дисперсионный анализ). ХФН субмаксимальной и умеренной мощности не привели к повышению активности фермента относительно контроля. Сердечная изоформа КК-МВ сопряжена с Са2+-АТФазой. Изофермент КК-МВ специфичен для миокарда, так как в кардиомиоцитах его активность составляет 15–42 % от общей активности КК, в то время как в ткани скелетных мышц его содержание не превышает 4 %, но только в красных, медленно сокращающихся мышечных волокнах. Сохранение или снижение активности фермента в крови при ХФН нагрузках умеренной и субмаксимальной мощности позволяет утверждать о функциональной сохранности кардиомиоцитов и скелетных мышц.
Следствием ОФН является согласованное повышение кардиального тропонина на фоне активации креатинкиназной системы, в том числе и в кардиомиоцитах, что можно расценить как наличие повреждения миокардиальных клеток, повышение их проницаемости и выход цитоплазматического тропонина и КК-МВ в кровь. При физических нагрузках умеренной и субмаксимальной мощности в крови имеется диссонанс между тропонином I (повышение) при сохраненных количественных значениях КК-МВ. Более того, в пределах ХФН уровень тропонина I не определяется интенсивностью нагрузки и практически нет достоверных различий между ОФН и ХФН любой интенсивности, за исключением 9 суток ХФН умеренной мощности. Это может быть обусловлено функциональной принадлежностью тропонина I. Особенности строения белков, входящих в состав тропонинового комплекса, позволяют осуществлять тонкую регуляцию сократительных процессов, что дает возможность сердечной мышце приспосабливаться к разнообразным физиологическим и патологическим состояниям. Изменения конформации компонентов тропонинового комплекса обеспечивают развитие сокращения при повышении внутриклеточной концентрации Ca2+ и расслабление сердечной мускулатуры при ее снижении [4]. Адаптация к физическим нагрузкам обеспечивается среди многих механизмов и законом Франка – Старлинга. Согласно закону Франка – Старлинга, сила мышечного сокращения увеличивается пропорционально растяжению мышцы. Данные многих исследований указывают на то, что тропониновый комплекс может принимать участие в регуляции зависимой от растяжения силы сокращения сердечной мышцы [4]. В экспериментах с трансгенными мышами было показано, что замена сердечной изоформы тропонина I на медленную скелетную изоформу этого белка приводила к снижению данной зависимости [4]. Следовательно, повышение тропонина I в крови и соответственно в кардиомиоцитах можно рассматривать в качестве молекулярного механизма адаптации к возросшей физической активности.
Для обеспечения мышечной деятельности необходима энергия. Глюконеогенез основан на интенсивном использовании глюкогенных аминокислот и требует активации трансаминазных (АСТ и АЛТ) путей белкового обмена. Усиление протеолиза с последующим обезвреживанием потенциально токсичных аминокислот также происходит при участии трансаминаз. АЛТ-фермент, отражающий интенсивность глюкозоаланинового шунта, обеспечивающего интеграцию углеводного и белкового обмена, регулирует начальные метаболические пути через пировиноградную кислоту и аланин. Активность АЛТ в крови достоверно выше при физических нагрузках, имеющих анаэробно-аэробный характер (ОФН и ХФН субмаксимальной мощности). При ОФН активность АЛТ увеличилась на 63 % по сравнению с контролем. Однофакторный дисперсионный анализ показал достоверное влияние ОФН (р = 0,0005) на активность АЛТ, сила влияния составила 65,1 ± 2,7 %. Активность АЛТ при ХФН умеренной мощности постепенно нарастала, хоть и не так значительно (на 20 – 37 %) и только на 21 сутки стала достоверно выше контрольных значений (р = 0,015). ХФН субмаксимальной мощности привела к постепенному повышению активности АЛТ во все сроки эксперимента (на 36–63 %), что подтверждается трендом и высоким коэффициентом аппроксимации R2 = 0,827. Двухфакторный дисперсионный анализ показал, что активность АЛТ определяется интенсивностью воздействия физической нагрузки (сила влияния – 26,5 %), сроком физической нагрузки (сила влияния – 26,04 %) и в большей мере их совместным действием – сила влияния 54,14 %. АСТ – ключевой фермент в интеграции цикла трикарбоновых кислот, углеводного, липидного и белкового обмена, маркер транспорта протонов в митохондрии и их функционального состояния – показатель «горения» митохондрии. Активность АСТ достоверно выше контроля при физических нагрузках различной интенсивности. Рост активности АСТ указывает на интенсификацию работы цикла трикарбоновых кислот. При ОФН активность АСТ увеличилась на 48 % по сравнению с контролем. Однофакторный дисперсионный анализ показал достоверное влияние ОФН (р = 0,00003) на активность АСТ, сила влияния составила 78,1 ± 1,7 %. ХФН различной интенсивности привела к постепенному повышению активности АСТ во все сроки эксперимента (на 50–61 % – умеренной мощности; на 55–66 % – субмаксимальной мощности), что подтверждается трендом и высоким коэффициентом аппроксимации R2 = 0,99, но степень повышения активности АСТ не зависит от интенсивности и срока нагрузки. Двухфакторный дисперсионный анализ не выявил влияния физической нагрузки (интенсивности и срока) на активность АСТ.
Физическая нагрузка различной интенсивности сопровождается повышением активности цитолитических ферментов – АСТ и АЛТ. Факт повышения активности АЛТ в крови можно расценивать двойственно: во-первых, это формальный признак поражения печени; во-вторых, с метаболической точки зрения это признак активации глюкозоаланинового шунта. Его активация служит для компенсации возможной гипогликемии [9]. В целом повышение активности АЛТ (в 2–5 раз) и АСТ (4–5 раз) в крови расценивается как проявление патологии, но в наших исследованиях максимальное повышение активности ферментов составило 63–65 %. Таким образом, повышение активности АЛТ и АСТ в крови может быть отражением повышения функции печени и сердца при физической активности.
Для дифференциальной диагностики повреждений печени или сердца используют коэффициент де Ритиса. Коэффициент де Ритиса – это соотношение активности АСТ/АЛТ. Увеличение коэффициента де Ритиса характерно для инфаркта миокарда, а снижение – выявляется при заболеваниях печени. Высокий уровень активности АСТ у крыс, который в 20 раз превышает таковой у человека и определяет более высокий коэффициент де Ритиса (4 ± 1,5) при больших значениях АЛТ, может объясняться более значительной интенсивностью и взаимосвязью белкового и других обменов. При одинаковом уровне глюкозы у человека и крыс поступление субстратов для энергетического обмена более мощно обеспечивается за счет глюкогенных аминокислот. Система трансаминирования у крыс обеспечивает более высокие показатели дыхательной и сердечно-сосудистой систем. В наших исследованиях все виды физических нагрузок не приводили к повышению коэффициента де Ритиса, более того, тренд изменений указывал на его снижение при ХФН умеренной и максимальной мощности, что может быть отражением изменений углеводного и энергетического обменов. В условиях интенсивной физической нагрузки печеночный коэффициент де Ритиса является индикатором активации глюконеогенеза через глюкозоаланиновый шунт с использованием АЛТ, который необходим для поддержания адекватного уровня глюкозы в крови и развитие гипогликемии приводит к росту активности трансаминаз [10]. Об интенсификации глюконеогенеза свидетельствует не только низкий коэффициент де Ритиса, но и высокая активность АЛТ.
Индекс повреждения мышечной ткани – отношение показателей активности КК/АСТ имеет высокую диагностическую значимость при дифференциальной диагностике инфаркта миокарда и поражения скелетных мышц. Индекс повреждения мышечной ткани практически не изменился по сравнению с контролем при ОФН и ХФН умеренной мощности. При ХФН субмаксимальной мощности индекс повреждения мышечной ткани постепенно увеличивался на 21–25 % и стал достоверно выше контрольных значений на 21 сутки эксперимента. В целом же, несмотря на отсутствие различий при ХФН умеренной мощности и минимальные различия при ХФН субмаксимальной мощности, тренд изменений доказывает постепенное нарастание повреждений мышечной ткани, до определенного времени не принимающих патологического значения.
Выводы
1. Для острой физической нагрузки характерно возрастание активности ферментов: КК, КК-МВ, ЛДГ, АСТ, АЛТ, содержания молочной кислоты и тропонина I. Согласованное повышение КК, КК-МВ, тропонина I может свидетельствовать о повреждении кардиомиоцитов.
2. При хронической физической нагрузке умеренной и субмаксимальной мощности наблюдается постепенное увеличение активности в крови ферментов: КК, ЛДГ, АСТ, АЛТ, содержания молочной кислоты. Достоверные различия между ХФН умеренной и субмаксимальной мощности зарегистрированы по молочной кислоте (9,15 и 21 сутки – во все сроки наблюдения), активности ЛДГ (на 15 и 21 сутки), активности АЛТ (на 9 и 21 сутки). Диссонанс между тропонином I (повышение) и КК-МВ (нет изменений) позволяет говорить о сохранности миокардиоцитов. Таким образом, гиперферментемию можно рассматривать в качестве «функционально оптимальной» (адаптивной) реакции в ответ на изменение условий жизнедеятельности организма.
Рецензенты:Цейликман В.Э., д.м.н., профессор, зав. кафедрой биохимии, ГБОУ ВПО ЮУГМУ, г. Челябинск;
Колесников О.Л., д.м.н., профессор, зав. кафедрой биологии, ГБОУ ВПО ЮУГМУ, г. Челябинск.
Библиографическая ссылка
Ермолаева Е.Н., Кривохижина Л.В. ИНДИКАТОРЫ ПОВРЕЖДЕНИЯ ПРИ ФИЗИЧЕСКИХ НАГРУЗКАХ РАЗЛИЧНОЙ ИНТЕНСИВНОСТИ // Фундаментальные исследования. 2015. № 1-9. С. 1815-1821;URL: https://fundamental-research.ru/ru/article/view?id=38432 (дата обращения: 14.12.2025).



