Актуальность проблемы, связанной с профилактикой гнойно-септических инфекций (ГСИ), таких как гнойные осложнения травмы челюстно-лицевой области, объясняется увеличением количества больных с переломами костей лицевого скелета, в последние годы, особенно у лиц молодого и зрелого возраста [1, 2]. Основными причинами челюстно-лицевого травматизма являются дорожно-транспортные происшествия, бытовая и спортивная травмы, в меньшей степени – производственные травмы. Многие авторы отмечают, что в возникновении ГСИ челюстно-лицевой области главную роль играет резидентная микрофлора полости рта, то есть имеет место эндогенное инфицирование [3, 4, 5]. Однако не исключается возможность перекрестного инфицирования микроорганизмами от других пациентов и персонала, а также формирования и участия в эпидемическом процессе госпитальных штаммов микроорганизмов [6, 7, 8]. В связи с этим большое значение приобретает выяснение этиологии ГСИ челюстно-лицевой области. В настоящее время все больший удельный вес в этиологии гнойной инфекции челюстно-лицевой области приобретает условно-патогенная микрофлора полости рта, носа и глотки. Эта группа возбудителей стала высокопатогенной в условиях применения антибиотиков, к которым она проявляет выраженную природную и приобретенную устойчивость. Целью микробиологического мониторинга является своевременная микробиологическая диагностика инфекционных осложнений в интересах постановки этиологического диагноза, выдачи лечебных рекомендаций, а также определения антибиотикорезистентности микроорганизмов. Борьба с инфекционными осложнениями невозможна без введения системы мониторинга, своевременного выявления, назначения адекватного лечения.
Целью исследования являлось изучение этиологической структуры гнойно- септических инфекционных осложнений в стоматологии.
Материалы и методы исследования
В соответствии с задачами исследования было выделено 542 культуры микроорганизмов, из них 498 – от больных с гнойными осложнениями челюстно-лицевой области, 32 – от персонала соответствующих учреждений, где лечились данные больные, 12 – с объектов внешней среды соответствующих учреждений. Доставка материала в лабораторию осуществлялась не позднее 2 часов после забора. Видовую идентификацию микроорганизмов проводили по общепринятым методам.
Выделенные культуры на скошенном мясо-пептонном агаре (стрептококки на сахарном агаре) доставлялись в лабораторию кафедры эпидемиологии Азербайджанского медицинского университета. Полученные культуры расчищали путем 2-кратного пассирования на искусственных питательных средах с использованием жидкой и плотной среды, после чего определяли спектр чувствительности к антибиотикам методом дисков.
Для определения чувствительности микроорганизмов к антибиотикам применяли диско-диффузионный метод, используя Методические рекомендации (2004) и рекомендации Национального комитета по клиническим лабораторным стандартам (NCCLS, США, 2000) и диски с антибиотиками производства компании Becton Dickinson (США) и среду Мюллера-Хинтона того же производства. Статистический анализ данных осуществлялся с помощью программы электронных таблиц Microsoft Excel, которые были сформированы в соответствии с запросами проводимого исследования.
Результаты исследования и их обсуждение
За период исследования было выделено 542 культуры микроорганизмов, из них 498 (91,8 ± 1,2 %) – от пациентов, 32 (5,9 ± 1,6 %) – от персонала, 12 (2,3 %) – с объектов внешней среды (рис. 1).
Одинаковые культуры группировали в штаммы. Культуру считали принадлежащей к одному штамму на основании следующих критериев:
– идентичность по видовой принадлежности;
– совпадение биохимических, морфологических и культуральных свойств;
– совпадение антибиотикограммы;
– выделение от одного больного или от разных больных в пределах одного эпидемического очага, установленного на основании эпидемиологического расследования.
На основании данной методики из 542 культур было идентифицировано 318 культур, из которых 257 составили культуры, выделенные только от одного пациента в процессе динамического наблюдения, 37 – культуры, выделенные от разных пациентов, но связанные эпидемиологически (в очагах), 24 – культуры, формировавшие вспышки и повторно выделявшиеся от одних и тех же пациентов. Среди культур, выделенных повторно от одного пациента, средняя кратность выделения составила 2,5, среди культур, выделенных повторно только в очагах, – 4,9, среди культур, формировавших вспышки и повторно выделявшихся от пациентов, – 12,2. При этом 1 культура метициллин-резистентного Staphylococcus aureus, склонная к формированию как резидентного носительства, так и вспышечной заболеваемости, была выявлена у 3 пациентов и 1 медицинского работника, причем от одного из пациентов на протяжении периода наблюдения в 12 недель (3 месяца) было получено 4 культуры (изолята).
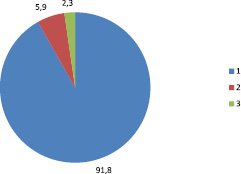
Рис. 1. Источники выделения культур микроорганизмов: 1 – больные; 2 – персонал; 3 – внешняя среда
После исключения повторов было идентифицировано 542 штамма, из которых 12 были выделены из внешней среды, 32 – от персонала, 498 – от пациентов (таблица).
Источники выделения культур микроорганизмов
|
Источники выделения культур |
Число выделенных культур |
Число выделенных штаммов |
Из них при клинических состояниях (заболеваниях) |
Из них при бессимптомных состояниях (от носителей) |
|
От пациентов |
498 |
293 |
277 |
16 |
|
От персонала |
32 |
21 |
16 |
5 |
|
Из окружающей среды |
12 |
4 |
– |
– |
|
Итого |
542 |
318 |
293 |
21 |
Относительно небольшое число культур, полученных от носителей, объясняется ориентацией микробиологических обследований в стационаре на клиническую, а не эпидемиологическую диагностику, первоочередным вниманием и приоритетным обслуживанием больных. В то же время существование бессимптомных бактериовыделителей среди больных и персонала свидетельствует о наличии внутрибольничного эпидемического процесса. Среди персонала бессимптомное бактериовыделение представляло в абсолютном большинстве случаев носительство золотистого стафилококка. Для последующего анализа было отобрано 277 штаммов, выделенных от пациентов с клиническими формами инфекционных осложнений.
Частота этиологической расшифровки инфекционных осложнений составила 94,5 % (277 штаммов возбудителей, 293 случаев инфекционных осложнений). В части случаев инфекционное осложнение вызывалось ассоциацией микроорганизмов. Наиболее часто определялись ассоциации грамотрицательных бактерий, стафилококков, Bacteroides, Fusobacterium, Peptostreptococcus (такие инфекции протекали наиболее тяжело). Этиологическая структура ГСИ челюстно-лицевой области представлена широким спектром бактерий и грибов. Выявляется все большее число возбудителей ГСИ, представленных микроорганизмами-оппортунистами: условно-патогенными бактериями и грибами, вызывающими инфекционный процесс на фоне иммунодефицитного состояния макроорганизма. Этиологическая структура выделенных микроорганизмов представлена на рис. 2.

Рис. 2. Этиологическая структура инфекционных осложнений в стоматологии: 1 – Peptostreptococcus spp.; 2 – Fuzobacterium nucleatum; 3 – Bacteroides melaninogenicus; 4 – Bacteroides gingivalis; 5 – Staphylococcus aureus; 6 – Bacteroides oralis; 7 – Streptococcus oralis; 8 – Borrelia vinsenti; 9 – Aerobacter aerogenes; 10 – Candida albicans штамма; 11 – прочие возбудители других родов
В структуре выделенных возбудителей преобладал Peptostreptococcus spp. – 78 штаммов (28,2 %), Fuzobacterium nucleatum 37 штаммов (13,4 %), Bacteroides melaninogenicus 31 штамм (11,2 %), Bacteroides gingivalis 23 штамма (8,3 %), Staphylococcus aureus 21 штамм (7,6 %), Bacteroides oralis – 18 штаммов (6,5 %), Streptococcus oralis – 16 штаммов (6,0 %), Borrelia vinsenti – 15 штаммов (5,8 %), Aerobacter aerogenes 14 штаммов (4,6 %), Candida albicans 12 штаммов (4,0 %), на прочие возбудители других родов (13 штаммов) приходится в общей сложности 4,2 %. Всего было выделено 277 штаммов.
Заключение
ГСИ до сих пор является основной причиной неблагополучного состояния стоматологического здоровья населения. Широкая распространенность ГСИ обусловлена как низкой приверженностью, так и из года в год снижающейся эффективностью их лечения, что вызвано развитием резистентности возбудителей к широкому кругу антибактериальных средств. Ко всему и этиологическая структура возбудителей ГСИ претерпевает перестройку, что осложняет дифференциальную их диагностику и выбор оптимальной тактики лечения. Анализ этиологической структуры различных клинических форм гнойных инфекционных осложнений челюстно-лицевой области в целом подтверждает данные, приводимые в изучаемых литературных источниках [5, 6, 7, 8]. Полученные результаты наряду с ускоренными методами микробиологических исследований использовались в ранней терапии инфекционных осложнений. Микробный пейзаж с объектов окружающей среды и бессимптомных носителей в целом повторяет структуру микроорганизмов, выделенных от больных с гнойными осложнениями челюстно-лицевой области.
Резидентную микрофлору инфекционных гнойных осложнений челюстно-лицевой области представляют различные микроорганизмы, доминирующими среди которых можно назвать Peptostreptococcus spp. При ГСИ челюстно-лицевой области также часто высевались в большом количестве Fusobacterium, Bacteroides. Среди аэробных представителей можно перечислить Streptococcus, Staphylococcus, грибы рода Candida.
Рецензенты:
Сафаров А.М., д.м.н., профессор кафедры ортопедической стоматологии Азербайджанского медицинского университета, г. Баку;
Пашаев А.Ч., д.м.н., заведующий кафедрой терапевтической стоматологии Азербайджанского медицинского университета, г. Баку.
Библиографическая ссылка
Мамедова Н.М. ОЦЕНКА ЭТИОЛОГИЧЕСКОЙ СТРУКТУРЫ ГНОЙНО-СЕПТИЧЕСКИХ ИНФЕКЦИОННЫХ ОСЛОЖНЕНИЙ В СТОМАТОЛОГИИ // Фундаментальные исследования. 2015. № 1-8. С. 1621-1624;URL: https://fundamental-research.ru/ru/article/view?id=38260 (дата обращения: 04.02.2026).



