Каротиноиды являются природными пигментами и синтезируются бактериями, водорослями, лишайниками [31, 36, 38], практически всеми высшими растениями [10] и грибами [8, 14]. Биосинтезом данных соединений обусловлена окраска гидробионтов [35], членистоногих, рыб и оперения птиц [2]. Факты синтеза каротиноидов млекопитающими не известны. Восполнение потребностей организма человека в этих соединениях возможно только путем поступления с пищей, биологически активными добавками к пище или лекарственными средствами.
Каротиноиды – биологически активные вещества (БАВ), представляющие собой производные изопрена, которые традиционно классифицируют на две подгруппы: каротины – углеводородные производные изопрена (ζ-каротин, нейроспорин, ликопин, β-каротин, γ-каротин, δ-каротин, α-каротин и др.) и ксантофиллы – кислородсодержащие производные каротинов (лютеин, зеаксантин, астаксантин и др.).
Каротиноиды обладают широким спектром фармакологических свойств, среди которых общепризнанными являются провитаминная, антиоксидантная, радиопротекторная и антиканцерогенная активности, которые в совокупности оказывают положительное влияние на иммунитет [2, 14, 24].
Эффективное изолирование каротиноидов из природных объектов, их анализ и стандартизация, разработка лекарственных и профилактических средств на их основе, проведение биотехнологических, фармакологических исследований возможны лишь при проведении оптимального качественного и количественного контроля этих БАВ.
В настоящее время в арсенале исследователей, изучающих природные соединения, имеется достаточно современных аналитических методов, позволяющих устанавливать структуру, проводить идентификацию, определять количественное содержание любых БАВ [26, 30].
Изолирование индивидуальных каротиноидов из природных объектов непосредственно связано с проблемой установления или подтверждения их структуры. Определение структуры выделенных впервые, а также уже известных каротиноидов проводится, как правило, методом спектроскопии ядерного магнитного резонанса (ЯМР) [29, 37]. Несомненно, данный метод является наиболее информативным для установления структуры любого вещества, в том числе и каротиноидов, особенно в связи с тем, что за последние годы аппаратурный прогресс позволяет использовать магнитные источники высокой мощности, что обеспечивает регистрацию спектров высокого качества. В работе Г. Бриттона с соавторами [24] представлена наиболее полная информация о ЯМР-спектрах более 500 каротиноидов.
Достаточно часто для установления подлинности известных каротиноидов или идентификации вновь полученных индивидуальных представителей этого класса используют метод спектрометрии в инфракрасной области (ИК-спектрометрия), позволяющий подтверждать структурные фрагменты и функциональные группы [7, 20] исследуемых веществ.
Все чаще для анализа каротиноидов исследователи применяют методы ближней ИК-спектрометрии (БИК) и спектроскопии комбинационного рассеяния (Raman-спектроскопия) [23, 34]. В работах, опубликованных за последние годы, достаточно часто анализ каротиноидов исследователи проводят методом масс-спектроскопии, используя его как самостоятельный метод и в сочетании с высокоэффективной жидкостной хроматографией ВЭЖХ [16, 25, 33].
В настоящее время не потерял своей актуальности используемый долгие годы для идентификации [4, 5, 25], исследования чистоты [21] и количественного содержания каротиноидов [3, 9, 18] метод спектрофотометрии в ультрафиолетовой (УФ) и видимой областях [22, 28].
Как правило, каротиноиды идентифицируют по положениям максимумов светопоглощения, которые варьируют в зависимости от длины полиенового фрагмента, наличия в структуре циклических концевых групп, стерических эффектов, природы используемого растворителя и др. [2, 22, 24]. Полиеновая структура каротиноидов обусловливает интенсивное поглощение электромагнитного излучения в интервале от 400 до 500 нм, что соответствует окраске, присущей этим соединениям, – желтой, оранжевой, красной или их сочетанию [2].
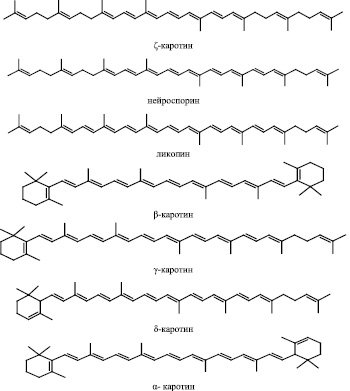
Структура некоторых каротинов
Максимумы светопоглощения некоторых каротинов в различных растворителях [22, 24, 28]
|
Каротин |
Растворитель |
Максимумы поглощения, нм |
Каротин |
Растворитель |
Максимумы поглощения, нм |
|
Нейроспорин |
хлороформ |
424, 451, 480 |
z-каротин |
этанол |
377, 399, 425 |
|
этанол, гексан |
416, 440, 407 |
петролейный эфир (гексан) |
378, 400, 425 |
||
|
петролейный эфир |
414, 439, 467 |
||||
|
Ликопин |
ацетон |
448, 474, 505 |
b-каротин |
ацетон |
429, 452, 478 |
|
хлороформ |
458, 484, 518 |
хлороформ |
435, 461, 485 |
||
|
этанол |
446, 472, 503 |
этанол |
425, 450, 478 |
||
|
петролейный эфир |
444, 470, 502 |
петролейный эфир (гексан) |
425, 450, 477 |
||
|
γ-каротин |
ацетон |
439, 461, 491 |
a-каротин |
ацетон |
424, 448, 476 |
|
хлороформ |
446, 475, 509 |
хлороформ |
433, 457, 484 |
||
|
этанол |
440, 460, 489 |
этанол |
423, 444, 473 |
||
|
петролейный эфир (гексан) |
437, 462, 494 |
петролейный эфир (гексан) |
422, 445, 473 |
||
|
δ-каротин |
хлороформ |
440, 470, 503 |
|||
|
петролейный эфир (гексан) |
431, 456, 489 |
Спектры поглощения каротиноидов в большинстве случаев характеризуются наличием трех максимумов поглощения или двух максимумов поглощения и плеча. В то же время известно, что электронные спектры некоторых каротиноидов, например астаксантина и гантаксантина, имеют по одному максимуму оптической плотности.
Для выраженного избирательного поглощения в видимой области необходимо, чтобы молекула каротиноида содержала полиеновую цепь не менее чем из семи двойных связей.
Если провести сравнительный анализ строения некоторых каротинов, изображенных на рисунке, и их максимумов поглощения, представленных в таблице, то эта взаимосвязь структуры и положения максимумов оптической плотности становится более наглядной, например для растворов в петролейном эфире.
Так, фитоен и фитофлуен, которые являются предшественниками z-каротина в ходе биосинтеза каротиноидов, имеют в структуре лишь по 3 и 5 сопряженных двойных связей соответственно. Эти соединения не окрашены, имеют максимумы поглощения в УФ-области, а именно при 276, 286 и 297 нм (фитоен) и 331, 348 и 367 нм (фитофлуен).
Молекула z-каротина включает систему уже из семи сопряженных двойных связей. Спектр поглощения этого соединения характеризуется тремя максимумами поглощения в видимой области: 378, 400 и 425 нм.
Нейроспорин с 9 сопряженными связями в молекуле, окрашенный в слабо-желтый цвет, является промежуточным соединением между z-каротином и ликопином с максимумами поглощения при 414, 439 и 467 нм. Наиболее ненасыщенный из алициклических каротиноидов (11 двойных связей) – это ликопин. В его молекуле нет циклических концевых фрагментов, он окрашен в красно-оранжевый цвет. Максимумы поглощения раствора ликопина расположены при 444, 470 и 502 нм.
Сравнение электронных спектров анализируемых соединений позволяет прийти к заключению о том, что чем длиннее система сопряженных связей, тем сильнее батохромное смещение максимумов поглощения. Так, например, первый максимум поглощения анализируемых каротинов расположен при 378, 414 и 444 нм, второй – 400, 439 и 470, третий – 425, 467 и 502 нм для x-каротина, нейроспорина и ликопина соответственно [24, 22, 28].
Кроме длины полиенового фрагмента, на характер спектра поглощения влияет число концевых циклов. Например, как и ликопин, b-каротин, окрашенный в желтый цвет, имеет 11 сопряженных двойных связей. Однако его молекула содержит два концевых цикла, что приводит к пространственному взаимодействию метильной группы при С5 в цикле с водородом при С8 в полиеновой цепи, а это обусловливает гипсохромный сдвиг положения максимумов поглощения 425, 450, 477 нм. В структуре g-каротина также 11 сопряженных связей, но один концевой цикл, вследствие чего максимумы поглощения смещены в длинноволновую область – 437, 462, 494 нм.
При анализе взаимного влияния длины полиенового фрагмента и числа концевых циклов в структуре каротинов на положение максимумов поглощения прослеживается следующая зависимость: увеличение количества сопряженных связей и уменьшение числа концевых циклов обусловливает батохромный сдвиг всех максимумов поглощения. В то же время увеличение числа циклических фрагментов при равном количестве сопряженных связей, как правило, приводит к смещению максимумов оптической плотности в сторону коротковолновой области (гипсохромный сдвиг максимумов поглощения). Например, для d-каротина, содержащего в структуре 10 сопряженных связей и один концевой цикл, максимумы поглощения наблюдаются при 431, 456, 489 нм, для a-каротина, также содержащего в своей структуре 10 сопряженных связей, но уже два концевых цикла, максимумы электронной плотности смещены в коротковолновую область и фиксируются при 422, 445, 473 нм.
Анализ взаимосвязи структуры и характера электронного спектра на примере некоторых каротинов показывает, что положения максимумов поглощения могут служить базовой информацией при изучении структуры этих БАВ. Кроме того, столь индивидуальный характер спектра поглощения каротиноидов является приемлемым параметром для их идентификации. Однако получение «идеального» спектра поглощения каротиноидов достаточно проблематично, что обусловлено необходимостью выделения образцов высокой степени чистоты.
Г. Бриттон предложил решение данной проблемы путем определения соотношения максимумов оптической плотности [2] исследуемого вещества. Как правило, с этой целью рассчитывают соотношение высот третьего максимума поглощения (III) ко второму (II). Полученное значение выражают в процентах, считая базовой линией прямую, проведенную через минимум между изучаемыми максимумами оптической плотности. Значение данной характеристики электронного спектра индивидуального каротиноида зависит от используемого растворителя. Так, например, соотношение III/II для b-каротина в петролейном эфире составляет 25 %, а в ацетоне – 15 %. Эта характеристика электронного спектра позволяет не только идентифицировать практически все индивидуальные каротиноиды, но и судить об их чистоте [22, 24, 28, 33].
Отечественная научная фармацевтическая школа достаточно широко использует метод спектрофотометрии как для качественного, так и для количественного анализа каротиноидов.
Так, при проведении исследований по стандартизации плодов шиповника (Rosa Sp.) авторы идентифицировали b-каротин путем сравнения положений максимумов поглощения гексанового экстракта из сырья и раствора стандартного образца (СО) b-каротина в том же растворителе [17].
В процессе мониторинга биотехнологического получения каротиноидов из биомассы бактерий Halobacterium halobium установление подлинности этих БАВ проводили при 470 нм, что соответствует максимуму поглощения суммы каротиноидов. Разделение полученной смеси каротиноидов методом колоночной хроматографии показало наличие в ней нескольких фракций. Одна из них имела максимум оптической плотности при 470 нм и была идентифицирована авторами как ксантофилл. В 3, 4 и 5-й фракциях установлено присутствие b-каротина с максимумом поглощения при 490 нм. В качестве элюента авторы использовали ацетон [9].
Данные литературы свидетельствуют о возможности применения калия дихромата для построения градуировочного графика с целью расчета количественного содержания суммы каротиноидов в надземной части серпухи венценосной (Serratula coronate L.) [1]. Этот прием позволяет избежать необходимости использования дорогостоящих СО каротиноидов.
Суммарное содержание каротиноидов в биомассе водоросли спирулины (Spirulina platensis (Nords.) Geilt.) в гексане [13], хлороформной фракции из шрота зелени пихты сибирской (Abies sibirica Lb.) [20], ацетоновом экстракте из моркови (Daucus carota subsp. sativus L.) [18] и извлечении из плодов Hippophae Rhamnoides L. [19] авторы рассчитывали по удельному показателю поглощения β-каротина, а идентификацию индивидуальных каротиноидов проводили по положению максимумов поглощения.
При разработке технологии получения сухого экстракта какалии копьевидной (Cacalia hastate L.) Д.Н. Оленников с соавторами [12] осуществляли контроль за процессом экстракции каротиноидов, определяя их суммарное содержание в гексановом извлечении из полученного экстракта при 450 нм. Расчет суммы каротиноидов проводили также по величине удельного показателя поглощения b-каротина для раствора в гексане.
Следует отметить множественность значений удельного показателя поглощения для β-каротина в гексане. Так, например, С.В. Первушкин с соавторами [13] для расчета суммы каротиноидов в биомассе водоросли спирулины (Spirulina platensis (Nords.) Geilt.) использовали значение удельного показателя поглощения β-каротина в гексане равное 2773. Ф.М. Юнусова с соавторами [19] в извлечении из плодов облепихи (Hippophae Rhamnoides L.) с применением в качестве экстрагента того же растворителя, для расчета исследуемых веществ применяли показатель поглощения со значением – 2592. Определение суммарного содержания каротиноидов в сухом экстракте какалии копьевидной (Cacalia hastate L.) проводили по удельному показателю, поглощения составляющему 2770 [12]. В то же время известен удельный показатель поглощения β-каротина в ацетоне – 2600, который был применен для расчета суммарного содержания каротиноидов в Daucus carota subsp. sativus L. [18].
Результаты, полученные многими исследователями, позволяют предположить, что за максимумы поглощения каротиноидных извлечений из природных объектов [3, 9, 18, 21], возможно, ответственно не индивидуальное соединение, а сумма каротиноидов. Этот вывод подтверждается экспериментальными данными. Так, отмечено, что интенсивность окраски плодов и цветков в чистом виде или с различными оттенками определяется не только общей суммой каротиноидов, но и их соотношением [4, 6]. Например, в работе Д.И. Писарева с соавторами [16] методом масс-спектроскопии было подтверждено, что гексановое извлечение из плодов шиповника колючейшего (Rosa spinosissima L.) содержит a-, b-, γ-каротин, лютеин, зеаксантин и примеси токоферолов. При изучении листьев алое древовидного (Aloe Arborescens L.) методом высокоэффективной хроматографии в тонком слое сорбента было установлено, что ацетоновое извлечение из них содержит сумму каротиноидов: виолаксантин, криптоксантин, лютеин, β-зеакаротин, β-каротин [11]. Результаты исследований В.И. Дейнека с соавторами [6] методом ВЭЖХ показали, что ацетоновое извлечение из плодов сладкого перца различных сортов представлено β-каротином, криптоксантином, зеаксантином.
Анализ зарубежных публикаций за последние годы показал, что метод спектроскопии в УФ и видимой областях используется зарубежными исследователями для предварительной оценки качественного состава каротиноидов и степени их чистоты [27, 31, 34, 36].
В частности, описан способ идентификации этих соединений в сравнении со стандартными образцами каротиноидов, в частности со СО β-каротина [31]. В случае отсутствия СО индивидуальных каротиноидов или анализа суммы каротиноидов исследователи в большинстве случаев прибегают к установлению подлинности по положению всех трех максимумов оптической плотности [25, 33]. Г. Бриттон с соавторами [2, 22, 24] рекомендует проводить подтверждение подлинности каротиноидов по трем максимумам поглощения и желательно, сравнивая спектры поглощения одного и того же каротиноида в нескольких растворителях, что значительно увеличивает достоверность результатов.
За рубежом чаще всего в ходе предварительного исследования содержание суммы каротиноидов пересчитывают на β-каротин, используя значение удельного показателя поглощения, который для раствора в гексан составляет 2592 [22, 28, 31]. В случае, когда известна величина удельного показателя поглощения для основного индивидуального каротиноида в объекте исследования [25], тогда расчет содержания суммы каротиноидов проводится в пересчете на него, например на нейроспорин [26]. Таким образом, зарубежными исследователями как метод количественного определения спектроскопия используется только для предварительной оценки содержания каротиноидов в изучаемом объекте.
Анализ публикаций, посвященных спектрофотометрическому анализу каротиноидов, позволяет прийти к следующим выводам:
- метод спектрофотометрического анализа каротиноидов в УФ и видимой областях остается незаменимым на стадии предварительных исследований этих соединений и позволяет разработать дальнейшую стратегию их анализа;
- идентификация каротиноидов по положению одного максимума поглощения и с использованием только одного растворителя не является достаточной;
- идентификация индивидуальных каротиноидов по положению всех трех максимумов электронной плотности в не менее чем двух растворителях и установление расчетно-экспериментального значения соотношения третьего и второго максимумов оптической плотности позволят повысить достоверность результатов при определении подлинности и чистоты каротиноидов.
Рецензенты:
Степанова Э.Ф., д.фарм.н., профессор кафедры технологии лекарств, Пятигорский медико-фармацевтический институт, филиал, ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Кайшева Н.Ш. д.фарм.н., профессор кафедры фармацевтической и токсикологической химии, Пятигорский медико-фармацевтический институт, филиал, ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.
Библиографическая ссылка
Курегян А.Г. СПЕКТРОФОТОМЕТРИЯ В АНАЛИЗЕ КАРОТИНОИДОВ // Фундаментальные исследования. 2015. № 2-23. С. 5166-5172;URL: https://fundamental-research.ru/ru/article/view?id=38175 (дата обращения: 23.01.2026).



