Современные методы микроскопических исследований являются важной методологической базой для получения фундаментальных знаний о функционировании биологических систем на клеточном, субклеточном и молекулярном уровнях. Сканирующая электронная микроскопия получила широкое применение благодаря целому ряду преимуществ – трёхмерности получаемых изображений, широкому диапазону увеличений (от макро-до наноуровня), большой разрешающей способности и глубине резкости, а также возможности подключения дополнительных приборов для микроанализа [9].
Современные тенденции рационального подхода к использованию ресурсов и импортозамещения делают актуальным поиск новых доступных методик подготовки биологических тканей к электронно-микроскопическому исследованию. Несмотря на существующее мнение о низких требованиях к пробоподготовке образцов биологических тканей для сканирующей электронной микроскопии [5], имеется ряд ограничений, связанных с необходимостью предотвращения деформации структур биологических объектов при их высушивании для исследования в условиях высокого вакуума. Недостатком методов замораживания-травления, лиофильного высушивания образцов тканей является повреждение нативных структур микроскопическими кристаллами воды. Кроме того, для их осуществления необходимо специальное оборудование, что значительно увеличивает себестоимость выполнения исследований. Метод перехода критической точки, позволяющий избежать кристаллообразования путем замещения водной фазы двуокисью углерода, также требует применения специального оборудования для контролируемого изменения температуры и давления при высушивании образца [4, 6]. При замещении водной фазы образцов костной ткани эпоксидной смолой для электронной микроскопии, их полимеризации и последующем травлении поверхности образца этиолятом калия [3] выявляются детали архитектоники минерализованных костных структур, но деформируются и удаляются неминерализованные компоненты, что значительно снижает информативность электронно-микроскопического исследования. Кроме того, отдельные компоненты эпоксидных смол являются высокотоксичными веществами II класса опасности (СанПиН 2.1.4.1074-01).
В археологии для сохранения и транспортировки хрупких объектов используется способ пропитывания легкоплавким углеводородным веществом – камфеном (3,3-диметил-2-метиленбицикло-[1,2,2]-гептан) [10]. Данное соединение характеризуется низкой температурой плавления (48–52 °С), растворимостью в ряде органических растворителей, способностью к возгонке при комнатной температуре, нетоксично (IV класс опасности). В процессе сублимации камфена (перехода из твердого состояния непосредственно в газообразное) сохранность структур объекта обеспечивается отсутствием деформации на границе раздела твердой и газообразной фаз вещества. Особое внимание следует обратить на необходимость использования химически чистого камфена, поскольку технический камфен содержит не сублимирующиеся органические примеси, загрязняющие колонну микроскопа.
Целью исследования являлась апробация способа подготовки образцов биологических тканей для исследования в сканирующем электронном микроскопе с использованием камфена.
Материалы и методы исследования
Исследование выполнено на образцах собственно соединительных и скелетных соединительных тканей костных регенератов, полученных в эксперименте на собаках при моделировании и лечении внутрисуставного перелома тазовой кости [7] через 14 суток после операции (n = 3) и при удлинении голени в аппарате Илизарова после флексионной остеоклазии берцовых костей [1, 2] на 28 сутки дистракции (n = 6). Животные содержались в стандартных условиях вивария. Оперативные вмешательства и эвтаназия осуществлялись в соответствии с требованиями Минздрава России к работе экспериментально-биологических клиник, а также «Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей» и были одобрены этическим комитетом ФГБУ «РНЦ «ВТО» им. академика Г.А. Илизарова».
Образцы биологических тканей размером до 1 см3, выделенные из костных регенератов, фиксировали 1–3 суток в смеси 2 % растворов формальдегида и глутарового альдегида (рН 7,4) с добавлением 0,1 % пикриновой кислоты. После фиксации их последовательно отмывали в фосфатном буфере, проточной и дистиллированной воде (в течение 2 часов на каждом из этапов). Затем образцы оставляли на ночь в 70 % этиловом спирте и далее дегидратировали по 2 часа в 80, 90, 96 и 100 % этиловом спирте. Далее этиловый спирт замещали этоксиэтаном, поместив образцы в смесь равных объемов растворителей (на ночь) и в этоксиэтан (на 2 часа). После этого образцы последовательно пропитывали в трех сменах смеси камфен/этоксиэтан, взятых в соотношении: 1/1, 2/1, 3/1 (по 2 часа в каждой) и далее помещали на 12 часов в две смены химически чистого камфена при t = 51 °C. По окончании пропитывания образцы оставляли при комнатной температуре в беспыльных условиях до полной сублимации камфена. После создания токопроводящего покрытия в ионном напылителе IB-6 («JEOL», Япония) препараты исследовали в режиме вторичных электронов при ускоряющем напряжении 20 кВ в сканирующем электронном микроскопе JSM-840 («JEOL», Япония). Приблизительное значение диаметра волокнистых ультраструктур определяли, соотнося с длиной автоматически генерируемого масштабного отрезка на каждом изображении.
Результаты исследований и их обсуждение
Исследование архитектоники тканей в зоне повреждения тазовой кости позволило выявить волоконно-фибриллярную организацию коллагенового остова соединительных тканей в составе костных регенератов. Полученные результаты хорошо воспроизводились во всех экспериментальных случаях.
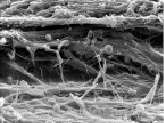
В периостальной части области повреждения тазовой кости волокнистая соединительная ткань надкостницы включала параллельные цилиндрические волокна диаметром до 5 мкм, группирующиеся в уплощенные пучки. Пучки соединялись посредством связующих фибрилл и косопоперечных волокон более мелкого калибра (рис. 1, а).
Межотломковое пространство высотой 1–2 мм заполняла рыхлая волокнистая соединительная ткань с высокой плотностью фибробластоподобных клеток и сосудов капиллярного типа. Коллагеновые фибриллы диаметром до 60 нм группировались в анастомозирующие уплощенные пучки, сгруппированные в слои. Соседние слои объединялись сетью поперечных и косопоперечных связующих волокон (рис. 1, б). На раневых поверхностях отломков располагались новообразованные грубоволокнистые костные трабекулы, связанные с окружающей тканью пучками коллагеновых волокон (рис. 1, в).
На раневой поверхности трабекул отломков определялись остеобласты – многорядно расположенные отросчатые клетки эллипсоидной формы с асимметрично локализованным ядром (рис. 2, а). Вблизи раневых поверхностей отломков встречались двучленные или многочленные изогенные группы хондроцитов – округлых, немного уплощенных клеток с многочисленными цитоплазматическими выростами, контактирующими со стенками лакун. Волокнистую основу территориального матрикса формировала нежная сеть спиралевидных фибрилл диаметром 20–30 нм (рис. 2, б). Фибробласты были представлены веретеновидными клетками с небольшим количеством отростков, покрытыми слоями коллагеновых фибрилл. В центральной части зоны повреждения локализовались остатки организующейся гематомы, включающие нити фибрина и дегенеративно измененные форменные элементы излившейся крови (рис. 2, в).
 а
а  б
б  в
в
Рис. 1. Фиброархитектоника зоны сращения перелома тазовой кости на 14-е сутки эксперимента: а – цилиндрические коллагеновые волокна в периостальной части зоны сращения, ув. 1000; б – уплощенные пучки коллагеновых волокон в интермедиарной части зоны сращения, ув. 3300; в – грубоволокнистые костные трабекулы на раневой поверхности отломков, ув. 650. Электронные сканограммы
 а
а 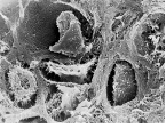 б
б  г
г
 а
а 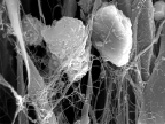 б
б  в
в
Рис. 3. Особенности фибро- и цитоархитектоники дистракционного регенерата большеберцовой кости собак через 28 суток удлинения конечности: а – пучки коллагеновых волокон соединительнотканной прослойки, ув.1700; б –остеогенные клетки, прикрепленные к волокнистому остову микрофибриллами, ув.4000; в – костные трабекулы игольчатой формы, ув. 3000. Электронные сканограммы
В образцах дистракционных регенератов большеберцовой кости центральная (срединная) часть регенерата была сформирована волокнистой соединительной тканью, в матриксе которой обнаруживались ориентированные в продольном направлении пучки коллагеновых волокон (диаметром от 2 до 7 мкм). Отдельные волокна объединялись фибриллярными структурами, образующими поперечные и косопоперечные межволоконные сшивки (мостики), диметром 250–300 нм. Толщина коллагеновых волокон в зоне соединительнотканной прослойки соответствовала 700 нм – 1,5 мкм (рис. 3, а).
Остеогенные клетки, преобладающие в межотломковой области, прикреплялись к матриксу посредством микрофибриллярных структур (диаметром 5–10 нм), формирующих трехмерную сеть и вплетающихся в более крупные продольно ориентированные пучки волокон (рис. 3, б).
Оссифицированный коллагеновый матрикс новообразованной костной ткани приобретал форму конусообразных костных тяжей, формирующих ретикулофиброзную костную ткань. Аморфный компонент костного матрикса имел глобулярное строение. Размер каждой глобулы не превышал 5–7 мкм. Первичная остеонная организация формирующихся трабекул свидетельствовала об интрамембранозном типе костеобразования. Их толщина составляла 25–30 мкм (рис. 3, в).
Заключение
Разработанный способ подготовки образцов биологических тканей для исследования в сканирующем электронном микроскопе включающий гистологическую фиксацию, дегидратацию, пропитывание камфеном и сублимацию при комнатной температуре без применения специального оборудования [8], обеспечивает сохранность объекта исследования, вплоть до ультраструктурных элементов цитоархитектоники. К преимуществам метода относятся простота выполнения, низкая себестоимость, малая токсичность реагентов, хорошая воспроизводимость результатов исследования. Хрупкие биологические объекты могут подвергаться транспортировке и хранению в камфене в течение длительного времени. Апробация данной методики на экспериментальном материале костных регенератов собак, сформированных на отдельных этапах нейтрального и дистракционного чрескостного остеосинтеза, позволили выявить особенности фибро- и цитоархитектоники соединительных тканей в их составе.
Рецензенты:
Краснов В.В., д.б.н., ведущий научный сотрудник лаборатории осевого скелета и нейрохирургии, ФГБУ «РНЦ ВТО им. акад. Г.А. Илизарова» Минздрава России, г. Курган;
Стогов М.В., д.б.н., ведущий научный сотрудник лаборатории биохимии, ФГБУ «РНЦ ВТО им. акад. Г.А. Илизарова» Минздрава России, г. Курган.
Библиографическая ссылка
Силантьева Т.А., Горбач Е.Н. ПОДГОТОВКА ОБРАЗЦОВ БИОЛОГИЧЕСКИХ ТКАНЕЙ ДЛЯ ИССЛЕДОВАНИЯ В СКАНИРУЮЩЕМ ЭЛЕКТРОННОМ МИКРОСКОПЕ С ИСПОЛЬЗОВАНИЕМ КАМФЕНА // Фундаментальные исследования. 2015. № 2-22. С. 4919-4923;URL: https://fundamental-research.ru/ru/article/view?id=38132 (дата обращения: 28.02.2026).



