На сегодняшний день аллергические заболевания стали серьезной проблемой человечества. Основными препаратами в лечении данной патологии являются антигистаминные средства – антагонисты Н1-гистаминовых рецепторов.
Антигистаминные препараты I и II поколения обладают рядом существенных недостатков. Препараты I поколения проникают через гематоэнцефалический барьер, вызывают седативный эффект, головокружение, нарушение координации, снижают способность к концентрации внимания, нарушают познавательную активность. Побочными действиями проявления антихолинэргического действия являются выраженная сухость слизистых оболочек полости рта, носоглотки, бронхов. Иногда при их приёме могут развиваться расстройства мочеиспускания и ухудшение зрения. К недостаткам также можно отнести феномен тахифилаксии (привыкания), требующий смены препарата каждые 7–10 дней [2, 5]. Существенным недостатком антигистаминных препаратов II поколения является их способность блокировать кальциевые каналы, что вызывает удлинение интервала QT и нарушение ритма сердца и повышает риск развития осложнений со стороны сердечно-сосудистой системы, особенно при их сочетанном приеме с антидепрессантами, противогрибковыми и антибактериальными препаратами, при употреблении грейпфрутового сока, а также у больных с патологией печени. Отсутствие парентеральных лекарственных форм ограничивает возможность применения антигистаминных препаратов II поколения при неотложных состояниях [3, 5].
С целью расширения российского рынка противоаллергических препаратов необходимо разрабатывать и внедрять в производство наиболее эффективные и зарекомендовавшие себя антигистаминные препараты III поколения, в частности дезлоратадин. Дезлоратадин при отсутствии седативного, кардиотоксического и других эффектов имеет лучший профиль безопасности по сравнению с препаратами других поколений этой группы. Кроме того, дезлоратадин улучшает качество жизни пациентов благодаря нормализации сна и дневной активности, уменьшению депрессии и отсутствию седативного эффекта [1].
Целью нашего исследования является разработка состава и технологии таблеток дезлоратадина.
В качестве объектов исследования использовали активные субстанции дезлоратадина двух производителей: Amsal Chem Private Limited, Индия и Абик Лтд., Израиль. При разработке состава таблеток применяли такие вспомогательные вещества, как лактоза, маннитол марки Pearlitol 100SD-Mannitol (Roqette, Франция), Prosolv EasyTab SP (JRS Pharma, Германия), микрокристаллическая целлюлоза марок 101 и 102, кальция гидрофосфата дигидрат, крахмал кукурузный прежелатинизированный (Roqette, Франция), поливинилпироллидон, карбоксиметилгликолят натрия, кислота лимонная, тальк, аэросил, магния стеарат, стеарил фумарат натрия. Определение фракционного состава, сыпучести, насыпной плотности порошков и гранул, распадаемости, прочности на сжатие и истирание таблеток-ядер проводили по общепринятым методикам на базе Центральной научно-исследовательской лаборатории Казанского ГМУ: насыпную плотность определяли на приборе ERWEKA тип SVM 121, ситовый анализ выполняли на вибросите BA200N, диаметр, толщину, прочность таблеток-ядер на раздавливание изучали на приборе ERWEKA серии ТВН 125 TD, исследование прочности на истираемость и ломкость проводили на тестере ERWEKA серии TAR 220. Таблетирование проводили на ротационной таблеточной машине РТМ-12, покрытие таблеток-ядер оболочкой – на установке Unilab-0,5-ТУ фирмы BWJ Huttlin на базе химико-фармацевтического предприятия ОАО «Татхимфармпрепараты» с использованием смеси для покрытия Vivacoat (JRS Pharma, Германия). Сравнительную кинетику растворения согласно процедуре «Биовейвер» проводили на приборе ERWEKA DT 800 (Германия). Количественное определение дезлоратадина, перешедшего в среду растворения, проводили на спектрофотометре UV-1800 (Shimadzu, Япония).
Сложность разработки состава и технологии таблетированной формы дезлоратадина была обусловлена свойствами лекарственного вещества. Дезлоратадин в присутствии многих наполнителей, в том числе лактозы, образует продукт разложения дезлоратадина 1-формил. Дезлоратадин является светочувствительным препаратом, в связи с чем возникла необходимость нанесения пленочного покрытия, при этом таблетки дезлоратадина должны иметь двояковыпуклую форму, что в свою очередь усложняет процесс получения таблеток с оптимальной прочностью на сжатие, ломкость и истирание.
Из-за чувствительности препарата к влаге в качестве способа таблетирования было решено использовать прямое прессование. При разработке рационального состава использовали вспомогательные вещества, придающие таблетируемым смесям и готовым таблеткам оптимальные технологические свойства. Разработанные составы таблеток с дезлоратадином представлены в табл. 1. Технологические свойства таблетируемых смесей и таблеток-ядер дезлоратадина представлены в табл. 2 и 3 соответственно.
Как видно из табл. 2, данные составы обладали оптимальными технологическими свойствами, необходимыми для прямого прессования: сыпучесть «отличная» для состава № 1 и «хорошая» для состава № 2, угол естественного откоса не превышал значения 50, насыпная плотность превышала 0,45 г/мл, количество мелкой фракции (до 100 мкм) не превышало 40 %. В процессе нанесения пленочного покрытия таблетки-ядра не истирались и не ломались, так как обладали необходимой прочностью (табл. 3).
Для оптимизации подбора состава и технологии таблеток дезлоратадина был применен метод полного факторного эксперимента. В качестве входных факторов использовали: остаточную влажность таблетируемой смеси (фактор x1); содержание крахмала кукурузного прежелатинизированного (фактор x2); содержание маннитола (фактор x3); в качестве факторов оптимизации (функций отклика) – распадаемость и прочность таблеток-ядер. Метод, реализованный в среде математического моделирования в программе Mathcad 15.0, позволяет минимизировать время на расчеты и использовать методику при решении других задач производства лекарственных препаратов. Некоторые выдержки (скриншоты) из программы представлены на рис. 1 и 2.
Таблица 1
Составы таблеток с дезлоратадином
|
Наименование вспомогательных и активных веществ |
Содержание веществ в таблетке, г |
|
|
Номер состава |
||
|
1 |
2 |
|
|
Дезлоратадин |
0,0050 |
0,0050 |
|
Маннитол |
0,0400 |
0,0680 |
|
Микрокристаллическая целлюлоза – 102 |
0,0380 |
0,0680 |
|
Кальция гидрофосфата дигидрат |
0,0100 |
– |
|
Крахмал кукурузный прежелатинизированный |
0,0040 |
– |
|
Карбоксиметилкрахмал натрия |
– |
0,0020 |
|
Тальк |
0,0020 |
0,0020 |
|
Стеарат магния |
0,0010 |
0,0010 |
|
Vivacoat |
0,0050 |
0,0050 |
Таблица 2
Технологические характеристики таблетируемых масс с дезлоратадином
|
Номер состава |
Остаточная влажность, % |
Фракционный состав, % |
Угол естественного откоса |
Сыпучесть, г/c |
Насыпная плотность, г/cм3 |
Насыпная плотность после усадки, г/см3 |
|
|
До 100 мкм |
100–250 мкм |
||||||
|
1 |
1,57 ± 1,27 |
14,44 ± 0,42 |
85,56 ± 1,71 |
42,5 ± 1,23 |
9,34 ± 1,00 |
0,485 ± 0,028 |
0,631 ± 0,101 |
|
2 |
2,47 ± 0,38 |
28,41 ± 0,55 |
71,59 ± 1,64 |
44,4 ± 1,59 |
6,97 ± 0,62 |
0,403 ± 0,048 |
0,562 ± 0,112 |
Таблица 3
Технологические характеристики таблеток-ядер дезлоратадина
|
Номер состава |
Высота таблеток – ядер |
Распадаемость |
Механическая прочность на истирание, % |
Механическая прочность на сжатие, кгс/см2 |
|
1 |
3,13 ± 0,2 |
4,66 ± 1,43 мин |
99,97 ± 0,0052 |
13,66 ± 1,43 |
|
2 |
3,17 ± 0,3 |
9,40 ± 1,31 мин |
99,98 ± 0,0038 |
>15 |
Рис. 1
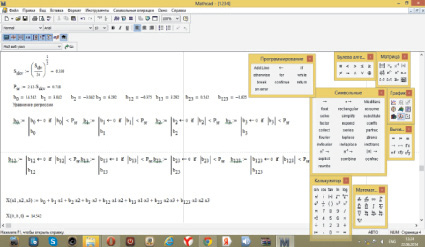
Рис. 2
В результате выполнения расчетов были получены уравнения регрессии для двух функций отклика: распадаемости и прочности.
Для распадаемости уравнение имеет вид
Y = 14,54 + 3,04x1 – 3,04x2 + 6,29x3 + 3,29x1x3 – 1,62x1x2x3.
Из уравнения видно, что наиболее сильное влияние оказывает фактор x3 (содержание маннитола), он имеет наибольший по абсолютной величине коэффициент. После него по силе влияния на отклик идут: двойное взаимодействие факторов x1 и x3 (остаточная влажность гранул и содержание маннитола); влияние фактора x1 (остаточная влажность гранул) и x2 (содержание крахмала прежелатинизированного), затем тройное взаимодействие всех факторов x1x2x3. Так как коэффициенты при x1, x3 и x1x3 положительны, то с увеличением количественного выражения этих факторов увеличивается отклик, что свидетельствует об обратной зависимости. Коэффициенты при x2, x1x2x3 отрицательны – с уменьшением фактора x2 и перечисленных взаимодействий значение отклика возрастает, а с увеличением – убывает. Так как Fрасч = 1,89 < Fтабл = 3,63, то уравнение регрессии по распадаемости адекватно.
Для прочности таблеток уравнение имеет вид
Y = 14,54 + 6,23x1 – 0,23x2 + 7,56x3 + 3,29x1x3 – 1,62x1x2x3.
Из уравнения видно, что наиболее сильное влияние на прочность таблеток оказывает фактор x3 (содержание маннитола), он имеет наибольший по абсолютной величине коэффициент. После него по силе влияния на отклик идут: влияние фактора x1 и x3 (остаточная влажность гранул и содержание маннитола); затем тройное взаимодействие всех факторов x1x2x3; затем фактора x2 (содержание крахмала прежелатинизированного). Так как коэффициенты при x1, x3 и x1x3 положительны, то с увеличением этих факторов увеличивается отклик, т.е. увеличивается прочность. Коэффициенты при x2, x1x2x3 отрицательны – с уменьшением фактора x2 и перечисленных взаимодействий значение отклика будет возрастать, а с увеличением – убывать. Так как Fрасч = 1,73 < Fтабл = 3,63, то уравнение регрессии по прочности адекватно.
Из полученных экспериментальных и теоретических данных были выявлены следующие оптимальные условия таблетирования: содержание маннитола – 40 %, остаточная влажность гранул – 1,75 %, содержание крахмала кукурузного прежелатинизированного – 4 %. Следовательно, для дальнейших исследований был выбран состав № 1, обладающий оптимальными технологическими свойствами. Следует отметить, что изготовленные таблетки полностью соответствовали статье «Таблетки» Государственной Фармакопеи ХI, том 2 и разработанному нами проекту фармакопейной статьи предприятия. Кроме того, разработанный состав обладал высокой стабильностью при хранении (о чем свидетельствовали сохранение концентрации действующего вещества и незначительный рост посторонних примесей в таблетках). На данные составы и технологию их производства получен патент РФ № 2537169 [4].
Для изучения биоэквивалентности было решено использовать процедуру «Биовейвер», позволяющую сделать вывод об эквивалентности оригинальному препарату «Эриус 5 мг», Бельгия in vitro. Проведение сравнительной кинетики растворения согласно процедуре «Биовейвер» является наименее трудоемким, не требующим вовлечения здоровых добровольцев [6].
Условия проведения сравнительной кинетики растворения следующие: используемыми средами являлись раствор, содержащий хлористоводородную кислоту с рН 1,2; ацетатный буферный раствор с рН 4,5; фосфатный буферный раствор с рН 6,8; прибор типа «Лопастная мешалка», скорость вращения мешалки 50 об/мин, температура – 37 °С, время растворения – 45 мин. Отбор проб проводили через 5, 15, 30, 45 минут после начала испытания. Исследования проводили на 12 таблетках воспроизведенного и оригинального препарата, данные обрабатывали статистически.
Количественное определение высвободившегося действующего вещества проводили методом УФ-спектрофотометрии. Измеряли оптическую плотность полученного раствора в максимуме поглощения при длине волны 282 нм (в среде растворения с рН 1,2), 275 нм (в среде растворения с рН 4,5) и 239 нм (в среде растворения с рН 6,8) в кювете с толщиной слоя 10 мм. Параллельно измеряли оптическую плотность стандартного раствора дезлоратадина. В качестве раствора сравнения использовали соответствующую среду растворения. Следует отметить, что разработанная методика количественного определения дезлоратадина, перешедшего в раствор, была провалидирована по показателям специфичность, точность (правильность), линейность, стабильность, сходимость и воспроизводимость [7].
При оценке подобия профилей высвобождения дезлоратадина из изучаемого и оригинального препарата руководствовались Методическими Указаниями МЗиСР РФ «Оценка биоэквивалентности лекарственных средств», прил. 4 (2008 г.). В соответствии с рассчитанным коэффициентом подобия f2 в среде ацетатного буферного раствора с рН 4,5 можно сделать вывод об эквивалентности профилей высвобождения дезлоратадина из препарата сравнения и оригинального препарата (f2 = 52,99). При высвобождении дезлоратадина из указанных выше препаратов в среде с рН 1,2 и рН 6,8 коэффициенты подобия не рассчитывали, так как в среду растворения через 15 мин перешло более 85 % действующего вещества (кинетика растворения считается эквивалентной без математической оценки).
Полученные результаты также свидетельствуют о подходящем способе и условиях таблетирования, а также правильности подбора вспомогательных веществ.
Таким образом, была разработана и запатентована таблетированная лекарственная форма дезлоратадина и доказана ее эквивалентность оригинальному препарату.
Рецензенты::
Абдуллина С.Г., д.фарм.н., профессор кафедры фармацевтической химии с курсом аналитической и токсикологической химии, ГБОУ ВПО «Казанский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Казань;
Шакирова Д.Х., д.фарм.н., профессор кафедры управления и экономики фармации, ГБОУ ВПО «Казанский государственный медицинский университет» Министерства здравоохранения Российской Федерации, г. Казань.
Работа поступила в редакцию 01.04.2015.
Библиографическая ссылка
Лефтерова М.И., Камаева С.С., Анисимов А.Н. РАЗРАБОТКА СОСТАВА И ТЕХНОЛОГИИ ТАБЛЕТОК ДЕЗЛОРАТАДИНА С ИСПОЛЬЗОВАНИЕМ ПОЛНОГО ФАКТОРНОГО ЭКСПЕРИМЕНТА // Фундаментальные исследования. 2015. № 2-12. С. 2631-2636;URL: https://fundamental-research.ru/ru/article/view?id=37536 (дата обращения: 26.02.2026).



