СП является одной из актуальных проблем, что определяется большим удельным весом данной патологии как среди всех легочных заболеваний (10–12 %), так и среди ургентных состояний в торакальной хирургии (до 12,5 %) [3]. По данным, полученным в ходе всеобщей диспансеризации населения СССР, СП был диагностирован у 0,3 % от числа всех обратившихся пульмонологических больных. Первичный спонтанный пневмоторакс (ПСП) вызывает особый научный интерес, т.к. встречается у лиц наиболее трудоспособного возраста (20–40 лет), признававшихся до этого здоровыми. Частота развития рецидива заболевания при разных способах лечения может превышать 30–35 %, причем нередко рецидивы развиваются в течение первых 6–12 месяцев. Заболеваемость идиопатическим СП в России на протяжении последних десятилетий не имеет тенденции к снижению, сохраняясь в соотношении 7,4:100 000 человек среди мужчин, а среди женщин – 1,2 на 100000 жителей [7]. По данных ассоциации торакальных хирургов Великобритании глобальная распространенность первичного СП достигает 18–28/100 000 в год для мужчин. Истинная распространенность первичного СП неизвестна, так как в ряде случаев болезнь может протекать бессимптомно.
В 71–95 % развитие СП ассоциируют с буллезной эмфиземой легких [1, 2]. Среди теорий, объясняющих патогенез развития эмфизематозных изменений в легочной ткани, можно выделить следующие: генетическая, ферментативная, обструктивная, механическая, инфекционная, сосудистая, аутоиммунная [1, 2, 4]. Наиболее распространенной является теория, согласно которой буллезная трансформация легких происходит вследствие дисбаланса в системе протеазы-антипротеазы, заключающейся в недостаточности α1-антитрипсина и повреждающего действия нейтрофильной эластазы на соединительнотканные элементы межальвеолярных перемычек. В исследованиях последних лет появились данные, не выявившие снижения концентрации α1-антитрипсина в сыворотке крови пациентов с СП [4]. Таким образом, ни одна из известных сегодня теорий не в состоянии полностью объяснить этиопатогенез развития спонтанного пневмоторакса.
В литературе в настоящее время имеются единичные высказывания о связи ПСП с дисплазией соединительной ткани (ДСТ) [6, 8]. В отечественной медицине под ДСТ понимают системный прогредиентный процесс, в основе которого лежат генетически детерминированные дефекты волокнистых структур и основного вещества межклеточного матрикса соединительной ткани, приводящие к нарушению формообразования органов и систем и определяющие особенности ассоциированной патологии [5, 6, 8]. Ведущим в постановке ДСТ является определение ряда фенотипических критериев и висцеральных маркеров.
Цель исследования: изучить взаимосвязь ДСТ и СП путем определения фенотипических и висцеральных маркеров недифференцированной дисплазии соединительной ткани у пациентов с первичным спонтанным пневмотораксом.
Критерии включения в исследование: мужской пол, возраст не старше 40 лет, первый эпизод или рецидив СП, отсутствие хронической либо острой патологии, требующей коррекции.
Нами был обследован 21 пациент, находившийся на лечении в клинике факультетской хирургии ГБОУ ВПО РязГМУ Минздрава России на базе отделения торакальной хирургии ГБУ РО «ОКБ». Контрольную группу составили 20 здоровых добровольцев. У всех пациентов имел место ПСП. До развития ПСП пациенты считались здоровыми. Все больные были мужского пола; женщины в исследование не включались. В 16 случаях (76 %) имел место правосторонний пневмоторакс, у 5 (14 %) – левосторонний. Двухсторонних пневмотораксов не отмечалось. У 14 эпизод пневмоторакса был первым, у 7 пациентов имел место рецидив. Средний возраст составил 26 ± 1,2 лет.
При выборе метода лечения и способа коррекции пневмоторакса придерживались «Проекта Национальных клинических рекомендаций по диагностике и лечению спонтанного пневмоторакса» от 2013 г. При поступлении в стационар первично всем пациентам выполнено дренирование пневмоторакса с постановкой в плевральную полость одного либо двух (при тотальном СП) трубчатых силиконовых дренажей достаточного диаметра (не менее 16-18F). После достижения полного расправления легкого пациенты обследованы с использованием мультиспиральной компьютерной томографии (РКТ). По результатам РКТ у 15 (88,2 %) пациентов выявлено наличие булл разного размера, локализованных в S1,3. Необходимо отметить, что у 12 (70,6 %) пациентов имелись симметричные двухсторонние поражения легких, у 3 (29,4 %) – буллы располагались лишь на стороне пневмоторакса. Изолированным дренированием плевральной полости ограничивались у пациентов с первым эпизодом пневмоторакса, у которых по данным РКТ не было выявлено буллезных изменений легких, либо больные отказались от проведения противорецидивного оперативного вмешательства по каким-либо причинам. Показаниями к торакотомии считали продолжающиеся сброс воздуха по дренажной системе более 72 часов и нерасправление легкого. У этих пациентов РКТ грудной клетки не проводилось ввиду малой информативности на фоне коллабированного легкого.
По виду проведенных хирургических вмешательств пациенты распределились следующим образом: дренирование плевральной полости без индукции плевродеза проведено у 10; ВТС, атипичная резекция легкого – 5, VATS-2, торакотомия – у 4 больных. Во всех случаях оперативные вмешательства дополнялись частичной париетальной плеврэктомией (табл. 1).
У всех пациентов проводились антропометрические исследования. Измерялись следующие показатели:
– длина верхней конечности – расстояние между выступающей точкой на крае акромиального отростка лопатки и дистальной точкой ногтевой фаланги 3-го пальца;
– длина плеча – расстояние от выступающей точки на крае акромиального отростка лопатки до верхней точки головки лучевой кости;
– длина предплечья – расстояние от нижней точки шиловидного отростка лучевой кости до верхней точки головки лучевой кости;
– длина кисти – расстояние между проекцией шиловидной кости на продолжение линии третьей пястной кости до самой дистальной точки ногтевой фаланги 3-го пальца;
– длина нижней конечности – расстояние от большого вертела до пола;
– длина бедра – расстояние между верхним краем лонного сочленения и серединой медиального мыщелка большеберцовой кости;
– длина голени – расстояние между серединой медиального мыщелка большеберцовой кости и нижней точкой на внутренней лодыжке;
– длина стопы – расстояние от пяточного бугра до конца ногтевой фаланги 2-го пальца.
Полученные результаты представлены в табл. 2.
Определяли признаки долихостеномелии (марфаноидность) – удлинение размеров конечностей по отношению к туловищу. Критериями диагностики долихостеномелии с помощью антропометрических данных являются:
– отношение «кисть/рост» > 11 %;
– отношение «стопа/рост» > 15 %;
– разность «размах рук – рост» > 7,6 см;
– отношение «верхний сегмент/нижний < 0,85, где нижний сегмент измерялся от лонного сочленения до пола, верхний сегмент определяли как разность «рост – нижний сегмент».
При оценке критериев долихостеномелии с помощью антропометрических данных средние показатели составили:
– отношение «кисть/рост» – 11,2 %;
– отношение «стопа/рост» – 14,9 %;
– разность «размах рук – рост» 4,1 ± 0,76 см;
– отношение «верхний сегмент/нижний» – 1,06 ± 0,02.
При этом у 11 пациентов (52,4 %) соотношение «стопа/рост» превышало 15 %, у 6 больных (28,6 %) разность «размах рук – рост» составила более 7,6 см.
Для определения дефицита массы тела рассчитывали индекс Варги (ИВ) по формуле
ИВ = (масса тела, г /рост2, см) – – (возраст, годы/100).
Величина ИВ 1,7–1,5 отражает умеренное снижение массы тела. Величина ИВ менее 1,5 – выраженный дефицит массы тела.
По данным антропометрических исследований рост пациентов составили 179 ± 1,4 см, вес – 64 ± 1,3 кг, добровольцы контрольной группы имели меньший рост 176,3 ± 0,9, при большем весе 72,5 ± 1,1. Индекс Варги равен 1,7 ± 0,04. В 76 % случаев выявлен дефицит веса, у 4 пациентов выраженный недостаток массы тела.
Таблица 1
Распределение пациентов по виду хирургического вмешательства
|
№ п/п |
Вид операции |
Количество пациентов (n = 21) |
|
Торакоцентез, дренирование плевральной полости (1 или 2 дренажа) |
10 |
|
|
Дренирование плевральной полости + ВТС + атипичная резекция S1,3 + субтотальная париетальная плеврэктомия |
5 |
|
|
Дренирование плевральной полости + VATS резекция S1,3 + субтотальная париетальная плеврэктомия |
2 |
|
|
Дренирование плевральной полости + торакотомия + атипичная резекция S1,3 + субтотальная париетальная плеврэктомия |
4 |
Таблица 2
Результаты антропометрических исследований в группах
|
№ п/п |
Антропометрические показатели |
Результат (см) опыт |
Результат (см) контроль |
|
1 |
Длина верхней конечности |
81,4 ± 0,9 |
79,2 ± 1,2 |
|
2 |
Длина плеча |
33,1 ± 0,4 |
32,4 ± 0,7 |
|
3 |
Длина предплечья |
28,95 ± 0,6 |
28,95 ± 0,6 |
|
4 |
Длина кисти |
20,1 ± 0,3 |
20,1 ± 0,3 |
|
5 |
Длина нижней конечности |
95,95 ± 1,5 |
94,8 ± 1,2 |
|
6 |
Длина бедра |
44,7 ± 1,09 |
44,7 ± 1,09 |
|
7 |
Длина голени |
44,8 ± 0,8 |
43,6 ± 1,0 |
|
8 |
Длина стопы |
26,8 ± 0,4 |
25,8 ± 0,9 |
|
9 |
Верхний сегмент тела |
92,1 ± 1,3 |
92,1 ± 1,3 |
|
10 |
Нижний сегмент тела |
87,2 ± 1,2 |
86,1 ± 1,5 |
|
11 |
Размах рук |
86,1 ± 1,5 |
86,1 ± 1,5 |
Таблица 3
Шкала P. Beighton для оценки выраженности гипермобильности суставов
|
№ п/п |
Тест |
Суставы |
|
|
Способность |
правый |
левый |
|
|
1 |
пассивно отогнуть назад V палец в пястно-фаланговом суставе более чем на 90 |
1 |
1 |
|
2 |
пассивно привести I палец к ладонной поверхности руки |
1 |
1 |
|
3 |
пассивно разогнуть локтевой сустав > 10° |
1 |
1 |
|
4 |
пассивно разогнуть коленный сустав > 10° |
1 |
1 |
|
5 |
интенсивно прижать ладони к полу, не сгибая коленей |
1 |
1 |
|
Итого: |
9 |
||
Примечание. Один балл может быть получен для каждой стороны при манипуляциях 1–4, поэтому показатель гипермобильности составляет максимально 9 баллов.
Одним из наиболее часто встречающихся в клинической практике проявлений ННСТ является синдром гипермобильности суставов (ГМС). Выраженность ГМС оценивали по девятибалльной шкале P. Beighton (табл. 3).
Максимальная величина по этим тестам равняется 9 баллам, причем 1 балл обозначает патологическое переразгибание одного сустава на одной стороне, а 2 балла – на двух. Показатель от 0 до 2 расценивался как физиологический вариант нормы, от 3 до 5 – как умеренная гипермобильность, от 6 до 9 баллов – выраженная гипермобильность суставов.
Признаки ГМС выявлены у 11 (52,4 %) пациентов из общего числа, причем у 9 определялась умеренная, а у 2 выраженная гипермобильность суставов.
Одним из наиболее частых висцеральных проявлений ДСТ являются синдром дисплазии соединительной ткани сердца, к которому относятся нозологически самостоятельные формы (синдром Марфана, Элерса – Данло) и так называемые малые аномалии сердца (МАС) – пролабирование митрального клапана (ПМК), аномальные расположенные хорды (АРХ) и т.д. Проблема МАС является актуальной из-за частоты распространения: ПМК встречается у 4–15 % населения, АРХ – у 4,1–17,1 %. По современным данным МАС могут приводить к различным осложнениям и служить одной из причин внезапной смерти больных.
При проведении ЭХО-графии сердца у всех пациентов выявлены признаки МАС. У 10 больных визуализировалась дополнительная трабекула левого желудочка. Аномально расположенная хорда левого желудочка (АРХ) выявлена у 5 пациентов. Пролапс митрального клапана (ПМК) 1 степени обнаружен у 2 больных, ПМК 1–2 степени – у одного, незначительная регургитация митрального и трихуспидиального клапана у 17, умеренная регургитация митрального клапана у 1 пациента. Важно отметить, что у части пациентов имело место сочетание дополнительных трабекул левого желудочка с АРХ в нем.
При ультразвуковом исследовании органов брюшной полости у 4 пациентов выявлена деформация и S-образное искривление желчного пузыря, у 1 – нефроптоз 2 ст.
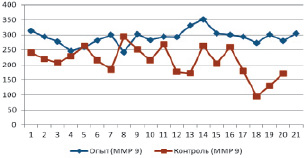
Показатели матриксной металлопротеиназы 9 в сыворотке крови обследуемых
По мнению ряда авторов, одним из ведущих механизмов формирования ДСТ на молекулярно-генетическом уровне является активность металлопротеиназ, которые участвуют в процессах морфогенеза, резорбции и ремоделирования тканей. Известно, что ММР 9 влияет на деградацию внеклеточного матрикса соединительной ткани, расщепляя коллаген IV и V, формирующих базальную пластинку и интерстициальную ткань. С целью изучения роли ММР 9 в генезе ПСП , определяли методом ИФА содержание желатиназы В (ММР 9) в сыворотке крови больных и добровольцев контрольной группы. Уровень ММР 9 был повышен у всех пациентов основной группы в сравнении с контрольной. Средние значения составили 287,4 ± 3,7 и 202,1 ± 10,8 в основной и контрольной группах соответственно. Различия в группах были статистически достоверны (рисунок).
Таким образом, у пациентов с первичным спонтанным пневмотораксом выявлены как фенотипические, так и висцеральные маркеры дисплазии соединительной ткани. При ИФА выявлена высокая активность матриксных металлопротеиназ сыворотки крови в сравнении с контрольной группой. Полученные данные указывают на необходимость дальнейшего углубленного изучения взаимосвязи недифференцированной дисплазии соединительной ткани и первичного спонтанного пневмоторакса с целью улучшения результатов лечения этой категории больных
Рецензенты:
Хубезов Д.А., д.м.н., профессор, заведующий кафедрой хирургии и общеврачебной подготовки с курсом эндохирургии ФДПО, ГБОУ ВПО РязГМУ Минздрава России, г. Рязань;
Юдин В.А., д.м.н., профессор кафедры хирургии и общеврачебной подготовки с курсом эндохирургии ФДПО, ГБОУ ВПО РязГМУ Минздрава России, главный хирург Министерства здравоохранения Рязанской области, г. Рязань.
Библиографическая ссылка
Михеев А.В. НЕДИФФЕРЕНЦИРОВАННАЯ ДИСПЛАЗИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ: ЕЕ РОЛЬ В ГЕНЕЗЕ ПЕРВИЧНОГО СПОНТАННОГО ПНЕВМОТОРАКСА // Фундаментальные исследования. 2015. № 1-4. С. 793-797;URL: https://fundamental-research.ru/ru/article/view?id=37423 (дата обращения: 28.02.2026).



