Разработка эффективных композитов на цементных связующих, обеспечивающих улучшение их эксплуатационных показателей и снижение материалоемкости, является важной задачей в области строительного материаловедения.
В настоящее время существует широкий спектр технологических приемов, позволяющих целенаправленно регулировать структуру и свойства цементных композитов. Одним из таких технологических приемов является активация воды затворения, которая инициирует химические процессы, протекающие в цементно-водных системах.
Поэтому необходимо уделять значительное внимание в технологии изготовления материалов на основе цементных вяжущих исходному состоянию воды затворения, которая во многом определяет технологические и эксплуатационные свойства полученного материала [3, 5, 4]. При направленном действии внешних физических полей (электрических, магнитных, тепловых, звуковых и других) вода меняет свои свойства. Такая вода затворения во многом определяет характер процессов гидратации и структурообразования цементных систем [6, 1, 12].
Одним из технологических приемов обработки воды является использование электрического тока для проведения химических процессов на границе металл – электропроводящий раствор – вода (электролит).
Образование цементного камня состоит из ряда протекающих во времени физико-химических процессов, в которых важнейшую роль играет вода [10]. Исследования влияния магнитного поля на процесс схватывания и кристаллизации цементного камня касались вопросов влияния напряженности магнитного поля на его прочностные характеристики. Изменения свойств получаемого камня связываются с влиянием магнитного поля на структурные характеристики воды. Однако известно, что сохранение возмущающего магнитного действия в воде имеет очень короткий временной промежуток [9]. Это относится к «абсолютной химически чистой воде». Для затворения строительного цементного раствора, как правило, используется природная вода, имеющая различный ионный состав, различную величину жесткости. Поэтому природа ионного состава воды определяет «отклик» на воздействие магнитного поля и структуру водного раствора. Особое значение имеет наличие в растворе многовалентных ионов металлов, в частности железа, алюминия, кальция, магния.
Управляя ионным составом используемой для затворения воды, можно управлять физико-механическими свойствами получаемого цементного камня. Задавать ионный состав можно различными способами, в частности электрохимическим растворением металлов. Рассмотрим общие закономерности электрохимического окисления металлов и частный случай генерации ионных структур на основе железа и алюминия.
При анодном растворении металлов с повышением плотности тока в прианодном слое повышается концентрация ионов растворяемого металла. Эта концентрация может расти до предела растворимости по данному иону в данном растворе электролита. При этом анодный потенциал и напряжение на электролизере начинают возрастать. При полном, плотном покрытии анода слоем соединений данного иона (окисный слой) может привести к прекращению процесса растворения. Это явление называется механической (или солевой) пассивностью анода.
Металлы, образующие ионы различных степеней окисления, имеют и различные потенциалы, отвечающие соответствующим реакциям:
Me – пе → Меп+ ; 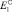 ;
;
Me – me → Mem+ ; 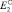 ;
;
Men+ – (m – n)e → Mem+ ; 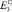 , (1)
, (1)
где n – низшая степень окисления; m – высшая степень окисления.
Согласно первому закону термодинамики сумма максимальных работ первого и третьего процессов должна быть равна максимальной работе второго процесса, т.е.
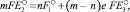 (2)
(2)
откуда
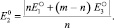 (3)
(3)
Из этого следует, что потенциал растворения металла в форме высшей валентности лежит между потенциалами двух процессов, причем если m = 2, а n = 1, то 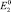 лежит точно посредине двух других потенциалов, При этом могут иметь место два случая:
лежит точно посредине двух других потенциалов, При этом могут иметь место два случая:
a) 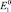 положительнее
положительнее 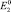 (случай растворения меди);
(случай растворения меди);
б) 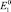 отрицательнее
отрицательнее 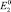 (случай растворения железа).
(случай растворения железа).
Следует учитывать, что в присутствии металла в растворе будет тот катион, потенциал которого в условиях электролиза более электроотрицателен.
При растворении железа это будет двухвалентный ион, т.к.
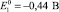 ,
, 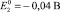 .
.
Во всех случаях образования металлом ионов разных валентностей при анодном растворении он будет переходить в форме обоих ионов. Концентрации их в растворе должны определяться равновесием
Me + Ме2+ = 2 Ме+, если m = 2, а n = 1;
2Ме + Ме3+ = 3 Ме+, если m = 3, а n = 1. (4)
Эти равновесные концентрации между ионами высшей и низшей валентности определяются соотношением потенциалов 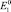 и
и 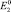 .
.
При анодном растворении железа (сталей), в случае применения стального анода, соотношение равновесных концентраций в электролите между Fe2+ и Fe3+ можно вычислить по уравнению
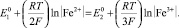 (5)
(5)
Принимая концентрацию (активность) двухвалентного железа равной 1 г-иону/л, получаем
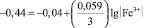
и
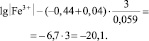 (6)
(6)
Следовательно, процесс перехода в раствор железа в форме трехвалентного иона столь незначителен, что им можно пренебречь и при анодном растворении железного электрода преимущественно образуются ионы двухвалентного железа.
Согласно диаграмме Пурбе (диаграмме электрохимического равновесия воды в системе железо ‒ вода) (рис. 1), при величине рН = 7 и потенциале анода более положительном, чем 0,4 В, возможно устойчивое состояние двухвалентных ионов железа [11].
Электрохимический потенциал железного электрода по реакции: Fe – 2е → Fe2+ в соответствии с уравнением Нернста описывается уравнением
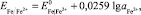 (7)
(7)
где 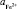 – активность ионов железа, г-экв./л;
– активность ионов железа, г-экв./л; 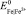 – стандартный электрохимический потенциал электрода, равный – 0,44 В.
– стандартный электрохимический потенциал электрода, равный – 0,44 В.
Образование труднорастворимого гидрооксида железа вблизи анода описывается уравнением
Fe2+ + 2 ОН– = Fe(OH)2. (8)
Гидроксид железа является труднорастворимым соединением. Активность ионов железа в растворе с рН = 7 ничтожна и может быть выражена через величину произведения растворимости Fe(OH)2:
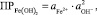
откуда
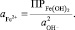 (9)
(9)
Электродные потенциалы и рН гидратообразования
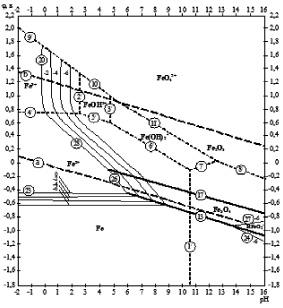
Диаграмма φ – рН для системы железо – вода при 25 °С (негидратированная форма окислов)
Значение ПР составляет 4,8∙1016 [10].
Подставив (6) в (7), получаем
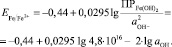 (10)
(10)
Отрицательный логарифм активности ионов ОН– является гидроксильным показателем рОН, подобно водородному показателю рН. При нейтральном значении рН = 7 гидроксильный показатель рОН также равен 7, поскольку всегда сумма рН + рОН = 14, тогда
 (11)
(11)
Приведенные выше расчетные значения равновесных потенциалов рассмотренных реакций характеризуют термодинамическую возможность протекания их в прямом или обратном направлениях.
Смещение потенциала электрода в область более положительных значений смещает равновесные процессы на электроде в анодную область – увеличится количество ионизирующихся атомов железа и, с возрастанием тока, протекающего через электрод, возрастает концентрация ионов железа, выходящих в прианодное пространство и последующих химических реакций данных ионов с противоионами, находящимися в растворе электролита.
При больших плотностях тока на аноде потенциал электрода достигает величин, при которых происходит окисление воды и прианодное пространство подкисляется – рН смещается в область меньшую 7, достигая величин 3–5. При этом согласно [14] процесс идет через
Fe + Н2О → Fe(OH)–ads + Н+;
Fe(OH)–ads → (FeOH)ads + e;
Fe(OH)ads + ОН– → Fe(OH)2 – e. (12)
В результате высока вероятность образования кристаллов окисногидрокисных соединений железа, имеющих размеры от 1 до 100 нм. Эти частицы имеют избыточную поверхностную энергию, в силу чего крайне неустойчивы и через образование и коагуляцию образующихся мицеллярных структур переменного состава стабилизируются [8]. При взаимодействии с электрическим и магнитным полями данные дисперсные структуры могут являться активными центрами кристаллизации процессов затворения, влияя в дальнейшем на структуру и механические свойства цементного камня.
При использовании алюминиевого анода в камере электрохимической активации, исходя из термодинамических предпосылок, можно рассмотреть систему: алюминий – водные растворы. В этом случае можно записать реакции, которые могут происходить с участием алюминия и его солей в воде:
Al = Al3+ + 3е; (13)
Al + 3H2O = Al(OH)3 + 3 H+ + 3e; (14)
Al + 2H2O = AlO-2 = 4H+ + 3e; (15)
Al3+ + 3OH- = Al(OH)3; (16)
AlO2- + H2O + H+ = Al(OH)3. (17)
Для анализа воспользуемся стандартными величинами потенциалов Гиббса [7] для данных соединений с целью определения работы каждого из процессов.
В процессе растворения алюминия затрачивается энергия, зависящая от величины электродного потенциала.
Для реакции (13) величина работы составит
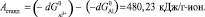
Величина стандартного потенциала алюминия Е0 = –1,66 В.
Если активность ионов Al3+ не равна нулю,
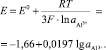 (18)
(18)
Величины стандартной работы образования
|
Вещество |
Стандартная работа образования, (-dG0, кДж/моль) |
|
H2O |
236,73 |
|
OH- (р-р) |
156,99 |
|
Al3+ (р-р) |
480,23 |
|
AlO-2 (р-р) |
818,14 |
|
Al(OH)3 (аморф.) |
1135,42 |
|
Al2O3.3H2O (гидроаргилит) |
2315,94 |
Для реакции (14): величина Aстанд = 447,78 кДж/моль, следовательно
Е0 = –1,55 В.
Считая, что 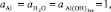 , получим
, получим
Е = – 1,55 – 0,059 рН.
Для реакции (15) величина Астанд = 360,503 кДж/моль или Е0 = –1,262 В.
Для иной концентрации:
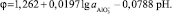
Для реакции (16) величина Астанд = 206,763 кДж/моль.
Известна связь работы с константой равновесия реакции Астанд = RT lg K.
Учитывая, что
2,3∙RT = 5695,674 Дж/моль∙град.,
получим
Астанд = 5695,674∙lg K.
В рассматриваемом равновесии
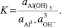
Переменив знаки и учтя, что для твердого осадка гидроаргиллита 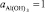 , получим
, получим
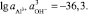
Произведение активностей данных ионов представляет собой произведение растворимости гидраргиллита при образовании в растворе ионов Al3+ и 3∙OH–.
В процессе восстановления водорода на катоде прикатодный раствор подщелачивается. В щелочной среде гидроокись алюминия в любой форме может растворяться с образованием алюмината 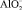 . Таким образом, для реакции (17) Астанд = 83100 Дж/моль.
. Таким образом, для реакции (17) Астанд = 83100 Дж/моль.
Отсюда
83100 = 5695,67 lg K
или
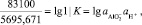
откуда 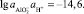
Выражение под логарифмом также представляет собой произведение растворимости для гидроксида алюминия (гидроаргиллита). Начало образования осадка при увеличении рН найдем, исходя из величины константы равновесия (17).
Если
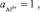
то 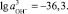
Но
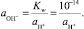
Тогда
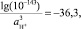
откуда
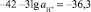
или рН = 42 – 36,3/3 = 1,9.
В более щелочных растворах должен появиться осадок гидраргилита. При дальнейшем увеличении щелочности раствора он стабилен в интервале рН от 1,9 до 14,6.
Зависимость потенциала алюминиевого электрода от кислотности раствора определяется диаграммой равновесия φ – рН для системы Al – H2O представлена в виде диаграмм Пурбе [11].
В нейтральных водных растворах алюминий корродирует с определенной скоростью, возрастающей при увеличении анодной поляризации. И только при достижении достаточно положительного потенциала наступает пассивность поверхности алюминиевого электрода.
Накопление дисперсных частиц гидраргиллита в момент окисления алюминия обеспечивает образование мицеллярных структур, стабилизирующих эти частицы, и тем самым возможно их участие в процессах, где используется вода с образованными частицами гидраргиллита, в частности в процессах образования строительных растворов – использование электрохимически активированной воды.
Протекание электрического тока через воду сопровождается процессами на катоде – электроде, потенциал которого при этом смещается в область более отрицательных потенциалов относительно равновесного. По мере смещения происходят процессы восстановления структур, имеющих положительный заряд. Очередность восстановления определяется величиной заряда и концентрацией частиц, несущих данный заряд (ион, мицеллярная структура и др.).
При прохождении тока через воду (водные растворы) вероятно восстановление ионов водорода из молекул воды, не останавливаясь на стадиях разряда (Фольмер, Гейровский, Тафель), по интегральной схеме:
2Н2О + 2е → 2ОН– + Н2. (19)
Поскольку ионы гидроксония обладают самой высокой подвижностью, то диффузионный ток по катионам водорода в чистой воде достигается при рН > 1 и значительных плотностях тока. При восстановлении водорода из воды, определяющей скорость процесса, является стадия Фольмера – разряд адсорбированных на катоде атомов водорода [13].
Выделение водорода на катоде происходит при потенциале более отрицательном, чем обратимый потенциал Е, отвечающий рН данного раствора:
Ен = RT/ln aн = –b0 pH. (20)
Величина водородного перенапряжения составляет значительную долю напряжения на ваннах при электролизе воды и хлоридных растворов. При увеличении плотности тока связь перенапряжения выделения водорода с плотностью тока выражается уравнением Тафеля:
df = а + b lg i. (21)
Константа а соответствует перенапряжению водорода при плотности тока 1 А/см2, константа b дает изменение перенапряжения при десятикратном изменении плотности тока. Величина а меняется в широких пределах при изменении природы катодного металла: от –0,1 В для платины до –1,5 В для свинца. Величина б меняется в более узких пределах от 0,03 до 0,12. Максимальное перенапряжение водорода наблюдается в нейтральных растворах и линейно уменьшается с отклонением рН в обе стороны от точки нейтральности.
Перенапряжение водорода уменьшается с ростом температуры и зависит от природы металла катода и плотности тока.
Таким образом, активно влияя на структуру водных систем и формы нахождения в них примесей, можно регулировать физико-химические свойства воды и тем самым изменять процессы структурообразования и свойства цементных композитов. Учитывая большое количество условий, оптимальные режимы обработки должны устанавливаться экспериментальным путем. При этом для определения пределов варьирования устанавливаются наиболее вероятные границы изменения отдельных параметров и их сочетаний.
Так, напряженность электрического поля при обработке воды может быть назначена исходя из того, что концентрация гидроксида металла при растворении материала электродов в результате электрохимических процессов увеличивается непропорционально напряженности электрического поля. Увеличение напряженности выше 50–60 В/см приводит к нелинейному увеличению концентрации гидроксида. Кроме того, условия безопасной работы установки по обработке воды с позиций охраны труда обязывают использовать напряжение 30–50 В/см.
При плотности тока от 1 до 5 мА/см2 наступает равновесие между процессами растворения металла и образования пассивирующих пленок, и электрод растворяется равномерно, без пассивации. Увеличение плотности тока смещает равновесие в сторону образования пассивирующих слоев и приводит к полной пассивации электродов. Следовательно, плотность тока при обработке воды затворения электрическим полем необходимо поддерживать до 5 мА/см2.
При увеличении продолжительности обработки воды происходит увеличение концентрации гидроксида металла. Время обработки может назначаться в пределах от долей секунд до нескольких десятков минут. В производственных условиях продолжительность обработки воды не должна задерживать основной процесс приготовления бетонной смеси, то есть время на обработку воды должно примерно равняться времени на дозирование компонентов, их загрузку и прочие операции.
Таким образом, при обработке воды затворения электрическим полем растворимых электродов наиболее вероятные границы изменения напряженности электрического поля должны находиться в пределах от 1 до 50 В/см, плотности тока – от 1 до 5 мА/см2, продолжительности обработки – не более 1–20 мин. Точные значения расчетных параметров устанавливаются экспериментальным путем.
Рецензенты:
Фокин Г.А., д.т.н., профессор кафедры «Физика и химия», Пензенский государственный университет архитектуры и строительства, г. Пенза;
Монастырев П.В., д.т.н., профессор, директор института архитектуры, строительства и транспорта, Тамбовский государственный технический университет, г. Тамбов.
Работа поступила в редакцию 16.02.2015.
Библиографическая ссылка
Фомичев В.Т., Ерофеев В.Т., Емельянов Д.В., Матвиевский А.А., Митина Е.А. ВЛИЯНИЕ ЭЛЕКТРОДНЫХ РЕАКЦИЙ В ПРОЦЕССАХ ЭЛЕКТРОМАГНИТНОЙ АКТИВАЦИИ ПРИРОДНОЙ ВОДЫ ЗАТВОРЕНИЯ НА СВОЙСТВА БЕТОНА // Фундаментальные исследования. 2015. № 4. С. 145-151;URL: https://fundamental-research.ru/ru/article/view?id=37138 (дата обращения: 12.12.2025).



