Эректильная дисфункция (ЭД) – наиболее точный из употребляемых терминов импотенции, определяющий последнюю как неспособность достижения и поддержания эрекции, необходимой для удовлетворения сексуальных партнеров [10, 8].
До 1970 г. ЭД считалась общим симптомом психогенных нарушений или изменения метаболизма тестостерона. Впоследствии было доказано, что психогенный фактор может обуславливать развитие ЭД, но ведущими в развитии нарушений эрекции являются органические изменения в механизме эрекции. Гипоксия, гипергликемия приводят к фенотипическим изменениям в кавернозных телах (КТ), а именно к усилению синтеза и накоплению коллагена с исходом в кавернозный фиброз, развитием кавернозной недостаточности [3]. Кавернозный фиброз является основным звеном в морфогенезе ЭД [4].
Цель исследования – функциональными и морфологическими методами изучить изменения КТ полового члена (ПЧ) у мужчин с органической ЭД.
Задачи:
1) проанализировать изменения пенильного кровотока и характер капиллярного кровообращения у мужчин с ЭД;
2) определить изменения мышечных, коллагеновых, эластических и аргирофильных волокон, а также изменения ядрышковых организаторов (ЯОР) гладкомышечных (ГМК), эндотелиальных клеток (ЭК) и фибробластов (ФБ) КТ.
3) определить взаимоотношения коллагенов III и IV типов в КТ ПЧ.
Материалы и методы исследования
Функциональное исследование было проведено 43 пациентам с ЭД с последующей биопсией КТ. Возраст пациентов с ЭД колебался в широком диапазоне от 34 до 74 лет (средний возраст составил 54 ± 11 лет). Продолжительность болезни от 2 до 25 лет (в среднем 6 лет).
В качестве контрольной группы для исследования пенильного кровотока и изучения характера капиллярного кровообращения были подвергнуты функциональному исследованию 27 добровольцев в возрасте от 21 до 35 лет (средний возраст 29 ± 4 лет).
В качестве условно контрольной группы для сравнения морфологической картины биопсийного материала исследовали аутопсийный материал от 20 мужчин в возрасте до 40 лет (средний возраст 29 ± 6 лет). Аутопсийный материал забирали не позднее 4 часов после смерти.
Основные методы функционального исследования: ультразвуковое исследование (УЗИ) сосудов и КТ ПЧ. При этом определяли диаметр кавернозных артерий, изменение эректильной площади кавернозных тел, градиент пиковой систолической скорости кровотока и индекс эффективности микроциркуляции. Для оценки микроциркуляции методом лазерной допплеровской флоуметрии нами использовался лазерный анализатор микроциркуляции крови ЛАКК-02 (НПП «ЛАЗМА», Россия), состоящий из двух излучателей для зондирования ткани в видимой красной области спектра излучения и в инфракрасной области, фотоприёмного устройства и световодных зондов-датчиков, включавших в себя 3 световода, заключённых в общий светонепроницаемый жгут.
Для морфологического исследования все образцы ткани ПЧ фиксировали в 10 % растворе нейтрального формалина, проводили стандартной проводкой и заключали в парафин. Приготовленные стеклопрепараты окрашивали гематоксилином и эозином, пикрофуксином по Ван Гизону, резорцин-фуксином по Вейгерту, импрегнация стромы по Гомори, определяли процентное содержание коллагеновых, эластических, аргирофильных и мышечных волокон в КТ.
Иммуногистохимическим методом определяли содержание коллагенов III и IV типов в КТ. Иммуногистохимическое исследование проводили с использованием мышиных первичных антител коллагенов III и IV типов фирмы DAKO – стрептавидин-биотиновым методом с применением системы визуализации BioGenex Super Sensitive Polymer-HRP Detection System с использованием хромогена DAB. Использовали мышиные антитела к коллагенам III (клон HWD 1.1) и IV типа (клон COL-94) в разведении 1:30. Предобработка проводилась пепсином 30 минут. Инкубация для коллагена III типа – 2 часа, для IV типа – 30 мин.
Ставили аргирофильную реакцию на кислые белки ядрышковых организаторов (ЯОР-белки) по Daskal Y. и соавт. [9] в модификации Боброва И.П. и соавт. [1]. Окрашенные материалы исследовали субъективным методом. Исследовали ядра клеток, с четкими очертаниями ядра, при увеличении микроскопа в 1000 раз (объектив х100, 1.25, oil, окуляр 10), с использованием иммерсионной системы. Протокол субъективного количественного подсчета ЯОР-белков в ядрах клеток проводили согласно рекомендациям Crocker J. с соавторами (1989). В каждом случае исследовали от 30 до 50 ядер ГМК, ФБ, ЭК. Суммарно подсчитывали внутриядрышковые гранулы серебра в пределах ядер клеток, при необходимости фокусируя изображение (с использованием микровинта микроскопа) по толщине среза. В случае краевого слияния близлежащих гранул (преимущественно внутриядрышковой локализации) количество вычисляли путем субъективного сравнения площадей прилежащих гранул. После субъективного подсчета ЯОР-белков в ядрах изображение с каждого поля зрения выводилось и сохранялось в цифровом варианте на жестком диске компьютера. Площадь области ядрышковых организаторов (ОЯОР) определяли морфометрическим методом.
Морфометрическое исследование проводили с использованием системы компьютерного анализа изображений, состоящей из микроскопа Lieca DNM проходящего света с подсоединенной цифровой камерой Lieca ЕС3, персонального компьютера на базе процессора Pentium 4 с тактовой частотой 3,2 Ггц и оперативной памятью 1 ГБ и программы UTHSCSA Image Tool 3.0 (разработанной в University of the Texas Health Science Center of San Antonio, Tеxas, USA, 2007, и свободно доступной в Интернете). С каждого случая делали по 10 снимков. Определяли процентное содержание коллагеновых, эластических, аргирофильных волокон, ГМК, выраженное в процентах.
Статистические расчеты проводили в статистическом пакете прикладных программ Stat Soft Statistica 6.0. Предварительно определяли характер распределения данных: соответствие или несоответствие полученных данных нормальному распределению. Для проверки на нормальность распределения применяли следующий статистический критерий: W-тест Шапиро – Уилкса для малых выборок (p < 0,05, то гипотеза о нормальности распределения отклоняется) и тест Колмогорова – Смирнова для больших выборок. Вычисляли значение средних величин (М) и стандартное отклонение (σ). Если данные соответствовали нормальному распределению данных, применяли параметрический критерий для сравнения двух выборок – t-критерий Стьюдента для независимых выборок. При отсутствии нормального распределения данных применяли непараметрические критерии для сравнения двух независимых выборок – U-критерий Манна – Уитни и критерий Вальда – Вольфовица. Значимость между средними величинами и независимыми переменными считали статистически достоверной, если значение «р» было менее или равно 0,05–95 % (уровень безошибочного суждения). Степень корреляции оценивали с использованием непараметрического метода – рангового коэффициента корреляции Спирмена (r), а для часто повторяющихся данных (например, числовые значения гранул серебра в ядрышках) использовали корреляцию гамма.
Результаты исследования и их обсуждение
По нашим данным диаметр кавернозных артерий в состоянии покоя составил 0,08 ± 0,04 см, в состоянии тумесценции достигал 0,15 ± 0,04 см (группа здоровых лиц), в то время как в группе мужчин с ЭД данный показатель составил – 0,06 ± 0,01 см в покое и 0,09 ± 0,10 см в фазу тумесценции соответственно (параметр увеличения диаметра артерии был необходим как показатель эластичности стенки). Диаметр кавернозных тел в фазу эрекции в группе контроля составил 3,3 ± 0,1 см, в группе мужчин с ЭД – 2,3 ± 0,2 см. У всех пациентов эхоструктура КТ была представлена мелкими гиперэхогенными включениями от 1 до 3 мм в диаметре в различной степени выраженности: от единичных, расположенных ближе к головке полового члена до диффузных, занимающих всю кавернозную ткань. Такая неоднородность ткани может соответствовать фиброзу КТ [2].
Пиковая систолическая скорость кровотока ПЧ в фазу полной эрекции составила 34,3 ± 2,5 см/с в контрольной группе, а в группе мужчин с ЭД 23,40 ± 1,20 см/с. Индекс резистентности в кавернозных артериях ПЧ во время фазы полной эрекции составил 0,6 ± 0,2 у.е. в группе контроля и 0,81 ± 0,20 у.е. у мужчин с ЭД. Индекс эффективности микроциркуляции составил 1,20 ± 0,11 у.е. в контрольной группе и 0,62 ± 0,08 у.е. у пациентов с ЭД.
В КТ ПЧ при ЭД происходило увеличение содержания коллагеновых волокон и снижение ГМК, на что ранее указывали и другие авторы [6]. В КТ нам удалось выявить достоверное увеличение содержания коллагеновых волокон в отличие от группы сравнения (ЭД – 25,86 ± 1,82 %, группа сравнения – 20,21 ± 1,44 %, p = 0,03). Причем у 81 % пациентов с ЭД морфологическими методами удалось зафиксировать очаговые фиброзные изменения в кавернозных телах (рисунок).
При этом количество ГМК в КТ достоверно снижалось у пациентов с ЭД и составило 38,90 ± 2,94 %, в то время как в группе сравнения – 44,61 ± 1,37 %. Нами также отмечены их дистрофические изменения в виде вакуолизации цитоплазмы и сморщивания ядра. Эластические волокна в КТ значительно снижались по сравнению с контролем до 3,12 ± 0,31 % (контрольная группа 11,03 ± 1,27 %), волокна при этом были фрагментированы, раздвоены, «крючковидной формы», имели не только количественные изменения, но и качественные. Объем волокон в трабекулах КТ при ЭД – 18,78 ± 3,29 % (контрольная группа 16,29 ± 1,74 %, различия достоверны при p < 0,001).
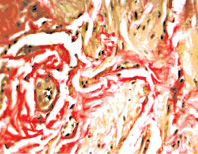
Световая микроскопия. Микрофотография кавернозного тела ПЧ при ЭД. Окраска пикрофуксином по Ван Гизону. Замещение гладкомышечных клеток волокнистой соединительной тканью, очаговый фиброз
При проведении морфометрических измерений процентного содержания коллагена III типа в КТ ПЧ у пациентов с ЭД отмечено увеличение его процентного содержания – 20,09 ± 4,25 % (контроль 17,20 ± 4,94 %), коллаген IV типа определяли в базальных мембранах каверн, в экстрацеллюлярном матриксе мышечных трабекул, базальных мембранах ГМК, где отмечали его умеренную или выраженную экспрессию, а также в медии артерий ПЧ и в экстрацеллюлярном матриксе эндотенония. Процентное содержание коллагена IV типа в КТ при ЭД составило 17,87 ± 5,52 % (контрольная группа 14,01 ± 5,52).
В КТ ПЧ пациентов с ЭД в ГМК мы обнаруживали от 1 до 3 кольцевидных ядрышек на одно ядро. В процентном соотношении содержание ГМК с 1–3 ядрышками показало, что при ЭД появляется большое количество клеток, содержащих 2 и 3 ядрышка. При этом в группе пациентов с ЭД также отмечалось увеличение количества гранул на одно ядро ГМК. При измерении площади ОЯОР выявили увеличение их суммарной площади в ГМК у пациентов с ЭД (p < 0,05). Среди ФБ отмечена аналогичная тенденция. В группе пациентов с ЭД происходит увеличение в процентном содержании клеток с двумя ядрышками на 1 ядро и увеличение количества гранул на 1 ядро. Количество ядрышек на 1 ядро ЭК составило от 1 до 3 в контрольной группе, а у пациентов с ЭД количество гранул серебра на 1 ядро колебалось в широком диапазоне от 1 до 6 гранул (морфометрические данные приведены в таблице).
Морфометрические изменения ОЯОР ГМК, ФБ и ЭК
|
Показатели |
Контрольная группа |
ЭД |
|||||||||||
|
ГМК |
ФБ |
ЭК |
ГМК |
ФБ |
ЭК |
||||||||
|
n |
% |
n |
% |
n |
% |
n |
% |
n |
% |
n |
% |
||
|
Количество ядрышек на 1 ядро |
1 |
286 |
89,9 |
278 |
92,7 |
322 |
88,7 |
812 |
78,5 |
868 |
96 |
905 |
91,1 |
|
2 |
32 |
10,1 |
22 |
7,3 |
37 |
10,2 |
197 |
19 |
36 |
4 |
86 |
8,7 |
|
|
3 |
– |
4 |
1,1 |
2,5 |
– |
– |
2 |
0,2 |
|||||
|
Количество гранул на 1 ядро |
1 |
193 |
60,7 |
234 |
78 |
110 |
30,3 |
368 |
64,7 |
585 |
64,7 |
593 |
59,7 |
|
2 |
107 |
33,7 |
66 |
22 |
162 |
44,6 |
167 |
29,3 |
270 |
29,9 |
278 |
28 |
|
|
3 |
16 |
5 |
48 |
13,2 |
30 |
5,3 |
47 |
5,2 |
64 |
6,4 |
|||
|
4 |
2 |
0,6 |
37 |
10,2 |
4 |
0,7 |
2 |
0,2 |
54 |
5,4 |
|||
|
5 |
– |
5 |
1,4 |
– |
– |
– |
3 |
0,3 |
|||||
|
6 |
– |
1 |
0,3 |
– |
– |
– |
2 |
0,2 |
|||||
|
Среднее количество гранул на 1 ядро |
1,46 ± 0,62* n = 318 |
1,22 ± 0,41* n = 300 |
2,09 ± 1,00* n = 363 |
1,61 ± 0,92* n = 1035 p = 0,004 |
1,41 ± 0,61* n = 904 p = 0,007 |
1,59 ± 0,88* n = 993 p = 0,005 |
|||||||
|
Средняя площадь ОЯОР, мкм2 |
1,47 ± 0,58* n = 318 |
1,22 ± 0,33* n = 300 |
2,16 ± 0,96* n = 363 |
1,65 ± 0,79* n = 1035 p = 0,0000001 |
1,49 ± 0,54* n = 904 p = 0,0000001 |
1,66 ± 0,76* n = 993 p = 0,02 |
|||||||
Примечания:
▪ – значения показателей представлены в виде M ± s, где M – среднее значение величин; s – стандартное отклонение;
n – количество измерений.
Мы решили условно разделить ФБ и ЭК на высоко и слабо активные по количеству гранул серебра на 1 ядро. Таким образом, получилось, что фибробласты с количеством гранул серебра более 2 на 1 ядро у пациентов с ЭД 5 %. Количество ФБ с количеством гранул серебра от 1 до 2 в группе 100 %, у пациентов с ЭД 94 %. ЭК с количеством до 3 гранул серебра на 1 ядро мы условно отнесли к слабоактивным, а клетки с количеством гранул серебра на 1 ядро больше трех – высокоактивные. Таким образом, в группе контроля ЭК слабоактивных – 88 %, а высокоактивных – 12 %. У пациентов с ЭД слабоактивных клеток – 94 %, высокоактивных – 6 %.
Между количеством высокоактивных ЭК КТ у пациентов с ЭД и высокоактивными ФБ была обнаружена взаимосвязь. Коэффициент корреляции Гамма составил – r = –1,0, Z = –2,038, p = 0,04. Коэффициент корреляции Гамма между высокоактивными ФБ и ГМК составил у пациентов с ЭД – r = –1,0, Z = –2,153, p = 0,03.
Между количеством гранул серебра на одно ядро ФБ, ГМК, ЭК и процентной долей коллагена IV типа были обнаружены следующие коррелятивные связи: количество гранул серебра в ядре ГМК и процентная доля коллагена IV типа – r = 0,52, p = 0,00001; между количеством гранул серебра на одно ядро в ФБ КТ ПЧ – r = –0,32, p = 0,0025; между количеством гранул серебра на одно ядро ФБ и коллагеном III типа КТ ПЧ при ЭД – r = 0,35, p = 0,0049.
Проведя анализ УЗИ ПЧ, мы выявили основные нарушения, приводящие к развитию васкулогенной ЭД. Это структурные изменения сосудистой стенки и КТ, которые сопровождаются гемодинамически значимыми изменениями пенильной гемодинамики: недостаточный артериальный приток в КТ в фазу максимальной эрекции, избыточный венозный дренаж в вены субтуникального подоболочечного сплетения и в систему глубокой дорсальной вены, снижение периферического сопротивления в синусах КТ, а также микроциркуляторные нарушения: снижение интенсивности перфузии кровью КТ, уменьшение объема кровотока в артериолах, явления застоя крови в венулах. В литературе данные по эффективности указанных параметров разнятся и не все исследователи считают их применение эффективным в диагностике васкулогенной ЭД [11], однако функциональные изменения, происходящие в КТ ПЧ, нашли свое подтверждение и при морфологическом исследовании. Морфометрические измерения ОЯОР клеток КТ ПЧ в группах пациентов с ЭД снижается морфофункциональная активность ЭК, повышается активность ФБ. При этом чем ниже активность ЭК, тем выше активность ФБ КТ. Снижение белково-синтетической функции ЭК может являться морфологическим эквивалентом эндотелиальной дисфункции, лежащей в морфогенезе нарушения эрекции. Обнаруженное повышение морфофункциональной активности ГМК у пациентов с ЭД относительно контроля можно интерпретировать как приспособительный механизм ГМК, направленный на компенсацию эректильной функции. Причем чем большее количество более активных субклонов ФБ появляется в КТ, тем меньше становится активных ГМК.
Это представляет ценность еще и потому, что не всегда удается зафиксировать изменения в КТ ПЧ стандартными морфологическими методами при, казалось бы, ясной и довольно четкой картине изменений, зафиксированных функциональными методами диагностики [12]. Это позволяет предположить, что основным звеном в развитии ЭД являются изменения сосудов КТ [7, 5] с последующими изменениями в них: нарастание дистрофических изменений ГМК и снижение их количества, замещение утраченных ГМК волокнистой соединительной тканью и развитием кавернофиброза.
Заключение
При васкулогенной эректильной дисфункции происходит снижение сократительной функции артерий КТ ПЧ за счет их фиброзных изменений. Нарушения микроциркуляции в тканях ПЧ приводят к необратимым и прогрессирующим изменениям в виде кавернофиброза, проявляющегося в виде очагового или диффузного увеличения коллагеновых волокон в трабекулах КТ ПЧ и нарастания дистрофических изменений ГМК с изменением их активности, а также активности ФБ и ЭК КТ.
Рецензенты:Высоцкий Ю.А., д.м.н., профессор, зав. кафедрой нормальной анатомии человека, Алтайский государственный медицинский университет, г. Барнаул;
Талалаев С.В., д.м.н., профессор, зав. кафедрой гистологии, Алтайский государственный медицинский университет, г. Барнаул.
Работа поступила в редакцию 06.03.2015.
Библиографическая ссылка
Гервальд В.Я., Климачев В.В., Неймарк А.И., Лепилов А.В., Музалевская Н.И., Пашков А.Ю., Насонов Т.Г., Гервальд И.В., Сивоконева Ю.М. ПАТОМОРФОЛОГИЯ ЭРЕКТИЛЬНОЙ ДИСФУНКЦИИ // Фундаментальные исследования. 2015. № 1-3. С. 483-487;URL: https://fundamental-research.ru/ru/article/view?id=37043 (дата обращения: 15.02.2026).



