Квантово-химические методы исследования являются надежным инструментарием для установления геометрии молекул реагентов, изучения особенностей межмолекулярных взаимодействий, анализа структуры соединений различного происхождения [1–6]. Учитывая значительную роль стерического и энергетического факторов при взаимодействии металла и органического реагента, методами квантово-химического моделирования возможно проведение оптимизации геометрии молекул с выявлением наиболее конформационно устойчивых и термодинамически выгодных структур.
Цель исследования – оценка стабильности металлорганических комплексов и выявление их конформационно устойчивых структур квантово-химическим методом.
Материал и методы исследования
В исследовании рассмотрены комплексы 1,2-диацилгидразина с цинком. Квантово-химические расчеты проведены методом параметризации РМ 3 в приближении ограниченного и неограниченного метода Хартри ‒ Фока (RHF/6-311 G(d)) в полноэлектронном валентно-расщепленном базисном наборе 6-31l G(d) с использованием программных пакетов HyperChem 7.5 Pro. Методика проведения квантово-химических расчётов рассмотрена в работах [2, 7–10].
Результаты исследования и их обсуждение
Результаты квантово-химических расчётов ПРС молекулы 1,2-диацилгидразина, важнейшими из которых являются энергии верхней занятой (ЕHOMO) и нижней свободной (ELUMO) молекулярных орбиталей, значения абсолютной жёсткости η и мягкости S, химического потенциала χ, глобальной нуклеофильности IN, представлены в таблице.
Рассчитанные ПРС молекулы 1,2-диацилгидразина
|
ЕНОМО |
ELUМО |
η, эВ |
χ, эВ |
Ѕ, эВ– |
IN, эВ– |
|
–9,864 |
0,457 |
10,321 |
4,704 |
0,097 |
0,933 |
Реагент характеризуется высокими значениями химического потенциала χ и глобальной нуклеофильности IN, что свидетельствует о его способности к образованию металлорганических комплексов. Структура наиболее устойчивого конформера молекулы 1,2-диацилгидразина показана на рис. 1. В молекуле 1,2-диацилгидразина находится четыре донорных центра: два жестких – на атомах кислорода карбонильных групп с эффективным зарядом qе(О) = –0,359 и два менее жестких – на атомах азота. Кроме того, наличие трёх ротамерных (вращательных) изомеров молекулы 1,2-диацилгидразина предполагает существование нескольких комплексов «цинк-диацилгидразин»: [Zn(H2O)5(DAH)]n+, [Zn(H2O)5(DAH)]+, [Zn(H2O)4(DAH)]+, [Zn(H2O)4(DAH)], [Zn(H2O)3(DAH)2], [Zn(H2O)2(DAH)2], где DAH – комплексообразующий фрагмент 1,2-диацилгидразина.
Для оценки прочности металлорганических комплексов с диацилгидразином были рассчитаны следующие ПРС: степень переноса заряда ΔN, энергия комплексообразования ∆Екомп и количество водородных связей, которые вносят значительный вклад в общую энергетику комплексобразования.
Квантово-химический расчет возможных структур комплекса [Zn(H2O)5(DAH)]n+ показал, что для такого состава существуют две координационно насыщенные структуры, в которых ион цинка проявляет координационное число 6. Первый комплекс [Zn(H2O)5(DAH)]2+, в котором лиганд присоединяется через одну карбонильную группу, образуется по схеме [Zn(H2O)6]2+ + DA H → [Zn(H2O)5(DAH)]2+ + H2O. Рассчитанное значение ∆Екомп составляет –70,67 кДж/моль. Комплекс характеризуется низким значением ∆N = 0,385. Пространственная структура комплекса с указанием длины связей (Å) представлена на рис. 2.
Второй комплекс [Zn(H2O)5(DAH)]+, в котором лиганд присоединяется через один из атомов азота гидразидной группы, характеризуется значением ∆N = 0,503. Образование комплекса происходит по схеме
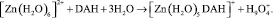
а
б
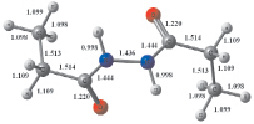
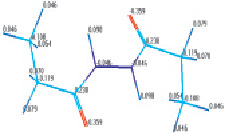
Рис. 1. Структура наиболее устойчивого конформера молекулы 1,2-диацилгидразина с указанием: а – длины связей (Å); б – зарядов на атомах
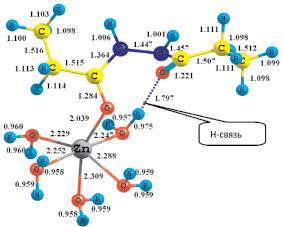
Рис. 2. Пространственная структура комплекса [Zn(H2O)5(DAH)]2+
Значение энергии комплексообразования ∆Eкомп составляет ‒ 362,70 кДж/моль. Структура второго комплекса характеризуется большей конформационной и термодинамической стабильностью благодаря высоким значениям ∆N и наличию трех водородных связей.
Расчет возможных структур комплекса [Zn(H2O)4(DAH)]n+ показал, что для такого состава существуют две координационно насыщенные структуры, в которых ион цинка проявляет координационное число 6. Пространственная структура первого комплекса [Zn(H2O)4(DAH)]+, в котором лиганд присоединяется через одну карбонильную группу и один из атомов азота гидразидной группы, характеризующегося значением ∆N = 0,403, представлена на рис. 3.
В структуре наблюдается наличие одной внутримолекулярной водородной связи. Значение ∆Eкомп составляет –170,19 кДж/моль. Образование комплекса происходит по схеме
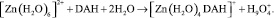
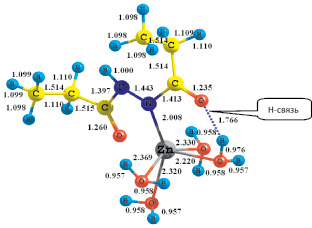
Рис. 3. Пространственная структура комплекса [Zn(H2O)4(DAH)]+
Пространственная структура второго комплекса [Zn(H2O)4(DAH)], в котором лиганд присоединяется через оба атома азота гидразидной группы, характеризуется значением ∆N = 0,425. Комплекс [Zn(H2O)4(DAH)] устойчив (ΔG < 0). Рассчитанное значение ∆Eкомп составляет –212,44 кДж/моль. Образование комплекса происходит по схеме
Расчет параметров комплекса [Zn(H2O)n(DAH)2] показал возможность существования двух координационно насыщенных структур. Пространственная структура [Zn(H2O)3(DAH)2], характеризующаяся значением ∆N = 0,545, в которой один лиганд присоединяется через одну карбонильную группу и один из атомов азота гидразидной группы, а второй – только через один из атомов азота гидразидной группы, представлена на рис. 4.


Рис. 4. Пространственная структура комплекса [Zn(H2O)3(DAH)2]


Рис. 5. Пространственная структура комплекса [Zn(H2O)2(DAH)2]
Комплексы [Zn(H2O)3(DAH)2] можно охарактеризовать как наиболее прочные и склонные к самосборке в супрамолекулярные полиассоциаты, благодаря возможности электростатического взаимодействия между образованными структурами. Образование комплекса [Zn(H2O)3(DAH)2] конформационно и термодинамически обосновано (ΔG << 0). Значение ∆Eкомп составляет –415,79 кДж/моль. Образование комплекса происходит по схеме
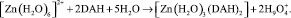
Пространственная структура комплекса [Zn(H2O)2(DAH)2], в котором оба лиганда присоединяются через одну карбонильную группу и один из атомов азота гидразидной группы, представлена на рис. 5. Комплекс [Zn(H2O)2(DAH)2] характеризуется наличием трёх водородных связей. Однако более низкое значение ∆N комплекса [Zn(H2O)2(DAH)2], равное 0,460, в сравнении со значением ∆N комплекса [Zn(H2O)3(DAH)2], равным 0,545, не позволяют отнести данную структуру к наиболее стабильной.
Значение ∆Eкомп составляет – 290,27 ккал/моль. Образование комплекса происходит по схеме
Расчет структур комплекса [Zn(H2O)n(DAH)3] показал невозможность их самопроизвольного образования и отсутствие у них конформационной устойчивости.
Заключение
Анализ представленных результатов квантово-химических исследований позволяет сделать заключение, что с наибольшей вероятностью в водных растворах образуются стабильные и способные к самосборке металлорганические комплексы следующего состава:
– комплекс [Zn(H2O)3(DAH)2], в котором один лиганд присоединяется через одну карбонильную группу и один из атомов азота гидразидной группы, а второй – только через один из атомов азота гидразидной группы, характеризующийся ∆Eкомп = –415,79 кДж/моль, ΔN = 0,545 и наличием пяти водородных связей;
– комплекс [Zn(H2O)5(DAH)]+, в котором лиганд присоединяется через один из атомов азота гидразидной группы, ∆Eкомп = –362,70 кДж/моль, ΔN = 0,503 и три водородные связи.
Следовательно, квантово-химические расчёты параметров реакционной способности (ПРС) реагентов, значений степени переноса заряда ΔN, энергии комплексообразования ∆Екомп, числа водородных связей позволяют выявлять наиболее энергетически выгодные и конформационно устойчивые структуры металлорганических комплексов с учётом возможности их самосборки в супрамолекулярные полиассоциаты, что необходимо для прогнозирования свойств реагентов.
Рецензенты:Черчинцев В.Д., д.т.н., профессор, зав. кафедрой промышленной экологии и безопасности жизнедеятельности, ФГБОУ ВПО «Магнитогорский государственный технический университет им. Г.И. Носова», г. Магнитогорск;
Калмыков В.Н., д.т.н., профессор, зав. кафедрой подземной разработки месторождений полезных ископаемых института горного дела и транспорта, ФГБОУ ВПО «Магнитогорский государственный технический университет им. Г.И. Носова», г. Магнитогорск.
Работа поступила в редакцию 06.03.2015.
Библиографическая ссылка
Медяник Н.Л., Шадрунова И.В., Варламова И.А., Калугина Н.Л., Гиревая Х.Я. ОЦЕНКА СТАБИЛЬНОСТИ МЕТАЛЛОРГАНИЧЕСКИХ КОМПЛЕКСОВ КВАНТОВО-ХИМИЧЕСКИМ МЕТОДОМ // Фундаментальные исследования. 2015. № 2-6. С. 1198-1203;URL: https://fundamental-research.ru/ru/article/view?id=37004 (дата обращения: 31.12.2025).



