Настоящая работа продолжает серию наших экспериментов [6, 7], посвященных тестированию ингибиторов окисления различного химического строения кинетическими методами. На сегодняшний день известно большое количество природных (убихиноны, токоферолы, каротиноиды, флавоноиды) и синтетических антиоксидантов (АО), имеющих несколько активных функциональных групп и обладающих комбинированным действием. Многие из них применяются для стабилизации пищевых продуктов, фармацевтических и косметических препаратов, полимеров, топлива, смазочных масел. В медицине уделяется большое внимание антиоксидантотерапии как способу неспецифической коррекции широкого спектра заболеваний, сопровождающихся усилением свободнорадикального окисления липидов биомембран. Ведется целенаправленный поиск перспективных антиоксидантов из числа традиционных лекарственных препаратов с целью расширения спектра их фармакологического действия.
Цель исследования – тестирование антиоксидантной активности ряда лекарственных препаратов при различных способах инициирования в гомогенных и гетерогенных системах, в сравнении со стандартными антиоксидантами: дибунолом и a-токоферолом.
Материалы и методы исследования
Антиоксидантную активность (АОА) изучали волюмометрическим методом поглощения кислорода в модифицированной установке типа Варбурга при окислении этилолеата (ЭО) в присутствии 1∙10−3 М цетилтриметиламмоний бромида (ЦТМАБ) в качестве поверхностно-активного вещества (ПАВ), с добавками 2∙10−3 М хлорида меди (II) в пробе при t = (60 ± 0,2) °С, Wi = 6,7∙10-5 М∙с–1. Соотношение липидов и воды составляло 1:3, а общий объем пробы 4 мл. Разработанная нами кинетическая модель тестирования антиоксидантов, подбор концентраций катализатора и ПАВ описываются в работе [8]. Процесс окисления метилолеата (МО) в среде инертного растворителя хлорбензола инициировали за счет термического разложения 3∙10–3 М 2,2¢-азобисизобутиронитрила (АИБН) в пробе при t = (60 ± 0,2) °С, Wi = 4,2∙10-8 М∙с–1. В качестве критериев оценки антиоксидантных свойств соединений использовали – периоды индукции (t), начальные и максимальные скорости окисления (Wнач, Wmax). Антиоксидантную активность, количественно определяемую по формуле АОА = τi – τS/τS, где τS и τi – периоды индукции окисления субстрата в отсутствие и в присутствии исследуемого АО соответственно. Антирадикальную активность (АРА) соединений тестировали в системе инициированного окисления этилбензола хемилюминесцентным методом (ХЛ) по известной методике [10]. Окисление инициировалось АИБН при t = (60 ± 0,2) °С, Wi = 2,3∙10-8 М∙с–1 [8]. Кинетику накопления гидропероксидов изучали при аутоокислении линолевой кислоты (ЛК) методом обратного йодометрического титрования в среде хлорбензола, t = (60 ± 0,2) °С.
Результаты исследования и их обсуждение
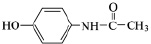
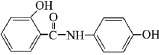
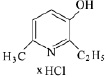
В медицине парацетамол используется как противовоспалительное, жаропонижающее и обезболивающее средство, соединение ингибирует фермент циклооксигеназу, тормозит образование простагландинов, участвующих в механизме возникновения гиперальгезии и повышенной температуры [5]. Осалмид применяется как желчегонное средство [9]. Эмоксипин используется в офтальмологии как ретинопротектор, в последнее время применяется при лечении гипертонии и ишемической болезни сердца [2, 3, 4]. Формулы изучаемых соединений представлены в табл. 1.
Таблица 1
Химические формулы изучаемых антиоксидантов
|
Название АО |
Формула |
|
Парацетамол (N-(4-гидроксифенил)ацетамид) |
|
|
Осалмид (N-(4¢-гидроксифенил)-2-гидроксибензамид) |
|
|
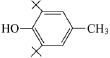
Эмоксипин (2-этил-6-метил-3-гидроксипиридина гидрохлорид) |
|
|
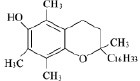
a-Токоферол (6-гидрокси-2,5,7,8-тетраметил-2-фитилхроман) |
|
|
Дибунол (2,6-ди-трет-бутил-4-метилфенол) |
|
Методом хемилюминесценции в группе исследуемых соединений была оценена величина константы скорости реакции k7 фенолов с пероксильными радикалами [10]:
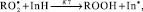
где InH – ингибитор окисления; In● – радикал ингибитора; 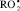 – пероксильный радикал. Стехиометрический фактор ингибирования f, показывающий количество свободных радикалов, реагирующих с молекулой ингибитора, для большинства изучаемых соединений был близок 2 (табл. 2).
– пероксильный радикал. Стехиометрический фактор ингибирования f, показывающий количество свободных радикалов, реагирующих с молекулой ингибитора, для большинства изучаемых соединений был близок 2 (табл. 2).
Таблица 2
Значения константы скорости реакции антиоксидантов с пероксильными радикалами 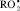 , Wi = 2,3∙10-8 М∙с–1; САО = 1∙10–3 М; t = 60 °С
, Wi = 2,3∙10-8 М∙с–1; САО = 1∙10–3 М; t = 60 °С
|
№ п/п |
Название АО |
K7∙104, М–1∙с–1 |
f |
|
1 |
Парацетамол |
4,00 |
2,4 |
|
2 |
Осалмид |
6,86 |
2,4 |
|
3 |
Эмоксипин |
0,61 |
2,0 |
|
4 |
a-Токоферол |
360 |
2,0 |
|
5 |
Дибунол |
1,40 |
2,0 |
При исследовании кинетики изменения интенсивности ХЛ в присутствии исследуемых соединений было установлено, что все АО оказывают ингибирующее действие на процесс окисления модельного субстрата. Показано, что наибольшую активность в реакции с пероксильными радикалами проявлял осалмид, константа скорости реакции k7 которого обусловлена акцепторным характером заместителя в пара-положении, наличием p-р-сопряжения между амидной группой и фенолом. АРА осалмида складывается из активности двух гидроксильных групп, в парацетамоле донорный заместитель содержится в пара-положении. В эмоксипине в положениях 2 и 4 по отношению к гидроксилу расположены донорные алкильные заместители. Сравнение констант скорости реакции k7 исследуемых соединений и a-токоферола показывает, что основной природный АО более активен в реакции с пероксильными радикалами ~ в 360 раз.
Для доказательства механизма действия антиоксидантов изучали кинетику окисления липидного субстрата при различных условиях инициирования процесса. Кинетику окисления соединений в условиях каталитического окисления этилолеата изучали в широком диапазоне концентраций (1∙10–6–1∙10–1 М). Осалмид проявлял высокую антиоксидантную активность по сравнению с парацетамолом и эмоксипином в соизмеримых концентрациях. На рис. 1 показаны типичные кинетические кривые (КК) окисления этилолеата в водно-липидной среде в присутствии осалмида. Установлено, что все исследуемые концентрации осалмида уменьшали начальную и максимальную скорости окисления в 2–5 раз по сравнению с контролем (табл. 3). Кинетические кривые окисления этилолеата с добавками парацетамола представлены на рис. 2. В изученном диапазоне концентраций парацетамола наблюдалось отсутствие периода полного торможения, но отмечалось снижение начальной и максимальной скоростей окисления по сравнению с контролем в 3–5 раз (табл. 3). Такой характер КК для парацетамола предполагает подавление антиоксидантных свойств фенольного гидроксила за счет образования хелатных комплексов с катионами меди (II) и проявление ингибирующего эффекта только за счет амидной группы.
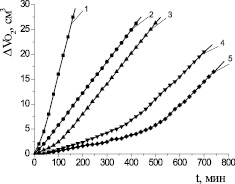
Рис. 1. Кинетика окисления этилолеата в водно-липидной среде в присутствии добавок осалмида, М: 1 – контроль; 2 – 1∙10–4; 3 – 5∙10–4; 4 – 1∙10–3; 5 – 1∙10–2; 2∙10−3 М CuCl2; 1∙10−3 М ЦТМАБ; t = 60 °С
Таблица 3
Кинетические параметры окисления этилолеата в водно-липидной среде в присутствии 2∙10−3 М CuCl2 в зависимости от концентрации АО, Wi = 6,7∙10-5 М∙с–1, t = 60 °С
|
С(АО), М |
τi, мин |
Wнач∙10–5, М∙с–1 |
Wmax∙10–5, М∙с–1 |
Wmax ЭO/Wmax AO |
|
Контроль ЭО |
15 |
7,5 |
14,0 |
– |
|
Парацетамол |
||||
|
5∙10–5 |
15 |
7,3 |
13,7 |
1,0 |
|
1∙10-4 |
20 |
6,2 |
10,0 |
1,4 |
|
5∙10–4 |
30 |
4,7 |
4,0 |
3,5 |
|
1∙10−3 |
40 |
2,5 |
3,1 |
4,5 |
|
5∙10−3 |
40 |
2,2 |
2,6 |
5,4 |
|
1∙10−2 |
45 |
2,0 |
2,4 |
5,8 |
|
Осалмид |
||||
|
5∙10–5 |
25 |
5,1 |
10,0 |
1,4 |
|
1∙10-4 |
45 |
2,9 |
4,4 |
3,2 |
|
5∙10–4 |
215 |
1,4 |
4,2 |
3,3 |
|
1∙10−3 |
350 |
0,6 |
2,7 |
5,2 |
|
5∙10−3 |
425 |
0,5 |
2,5 |
5,6 |
|
1∙10−2 |
500 |
0,4 |
2,5 |
5,6 |
|
Эмоксипин |
||||
|
5∙10–5 |
30 |
3,4 |
5,1 |
2,7 |
|
1∙10-4 |
40 |
2,1 |
4,3 |
3,3 |
|
5∙10-4 |
45 |
1,5 |
3,7 |
3,8 |
|
1∙10−3 |
55 |
1,0 |
3,5 |
4,0 |
|
5∙10−3 |
70 |
0,8 |
3,2 |
4,4 |
|
1∙10−2 |
90 |
0,7 |
2,6 |
5,4 |
|
a-Токоферол |
||||
|
1∙10–5 |
30 |
4,3 |
8,8 |
1,6 |
|
5∙10–5 |
35 |
4,1 |
8,2 |
1,7 |
|
1∙10–4 |
40 |
3,8 |
7,4 |
1,9 |
|
5∙10-4 |
70 |
3,0 |
7,9 |
1,8 |
|
1∙10−3 |
45 |
4,3 |
16,8 |
0,8 |
|
Дибунол |
||||
|
1∙10–5 |
65 |
7,0 |
12,3 |
1,1 |
|
5∙10–5 |
110 |
2,6 |
9,3 |
1,5 |
|
1∙10–4 |
140 |
2,1 |
8,7 |
1,6 |
|
5∙10–4 |
360 |
1,3 |
8,4 |
1,7 |
|
1∙10−3 |
600 |
1,0 |
8,0 |
1,8 |
На рис. 3 показано, что при всех концентрациях эмоксипин тормозит начальные и максимальные скорости окисления. В присутствии эмоксипина наблюдаются периоды индукции и периоды аутоускорения. Вероятно, в этих условиях лимитирующей является реакция разрушения эмоксипином гидропероксидов по молекулярному механизму. Зависимости периодов индукции от концентрации эмоксипина приведены в табл. 3.
Показано, что в водно-липидной среде дибунол проявлял себя как сильный ингибитор: наблюдался период полного торможения, период аутоускорения и достижение максимальной скорости окисления. Периоды индукции увеличивались пропорционально увеличению концентрации дибунола (табл. 3). По наклону прямой в координатах t,[InH] была рассчитана скорость инициирования в обеих системах, получены значения 4,2∙10–8 и 6,7∙10–5 М∙с–1 в безводной и водно-липидной среде соответственно. Максимальные скорости окисления липидов в гомогенной и гетерогенной системах были равны 8,0∙10–7 и 1,4∙10–4 М∙с–1 соответственно.
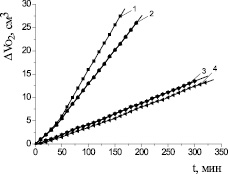
Рис. 2. Кинетика окисления этилолеата в водно-липидной среде в присутствии добавок парацетамола, М: 1 – контроль; 2 – 1∙10–4; 3 – 1∙10–3; 4 – 1∙10–2; 2∙10−3 М CuCl2; 1∙10−3 М ЦТМАБ, t = 60 °С
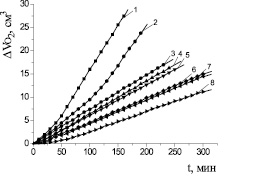
Рис. 3. Кинетика окисления этилолеата в водно-липидной среде в присутствии добавок эмоксипина, М: 1 – контроль; 2 – 1∙10–6; 3 – 5∙10–5; 4 – 1∙10–4; 5 – 5∙10–4; 6 – 1∙10–3; 7– 5∙10–3; 8 – 1∙10–2; 2∙10−3 М CuCl2, 1∙10−3 М ЦТМАБ, t = 60 °С
Анализ кинетических кривых окисления этилолеата с добавками АО показал существенные отличия механизма действия a-токоферола от дибунола в зависимости от концентраций. С увеличением концентрации a-токоферола наблюдалась инверсия антиоксидантного действия (табл. 3), при этом увеличивалась максимальная скорость окисления. Причиной ускорения процесса могло быть комплексообразование OH-группы a-токоферола с катионами меди (II). В процессе окисления a-токоферол образует достаточно активные токофероксильные радикалы (In·) [1], способные участвовать в побочных реакциях продолжения цепей с молекулами субстрата.
Установлено, что a-токоферол имеет экстремальную зависимость периодов индукции от концентрации с максимумом в 5∙10–4 М. Для осалмида и эмоксипина периоды индукции возрастали с увеличением концентрации соединения, периоды индукции парацетамола возрастали до 1∙10–3 М и в дальнейшем практически не изменялись (табл. 3).
Ингибирующее действие указанных соединений тестировали в широком диапазоне концентраций (1∙10–5–1,5∙10–3 М) в условиях инициированного окисления метилолеата в среде хлорбензола. Исследуемые АО увеличивали периоды индукции в процессе окисления модельного субстрата. Для осалмида, парацетамола, эмоксипина и дибунола наблюдалась линейная зависимость между периодом индукции и концентрацией. Действие a-токоферола в изучаемом диапазоне концентраций описывалось также линейной зависимостью (рис. 4).
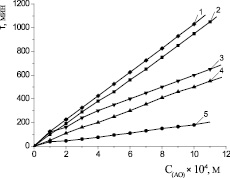
Рис. 4. Зависимость периодов индукции от концентрации АО: 1 – парацетамол; 2 – дибунол; 3 – a-токоферол; 4 – осалмид; 5 – эмоксипин; субстрат окисления МО, Wi = 4,2∙10–8 М∙c–1, t = 60 °С
Таблица 4
Кинетические параметры окисления МО в присутствии различных концентраций исследуемых АО, Wi = 4,2∙10–8 М∙c–1, t = 60 °С
|
С(АО)∙10–4, М |
tинд, мин |
Wнач∙10–7, M∙c–1 |
Wmax∙10–7, M∙c–1 |
Wмак. MO/Wмак. AO |
АОА = τi –τS/τS |
|
Метилолеат (контроль) |
|||||
|
0 |
26 |
1,90 |
8,00 |
– |
– |
|
Парацетамол |
|||||
|
2 |
220 |
0,57 |
1,30 |
6,2 |
8,5 |
|
4 |
425 |
0,50 |
1,16 |
6,9 |
16,3 |
|
6 |
625 |
0,31 |
0,66 |
12,1 |
24,0 |
|
8 |
820 |
0,21 |
0,30 |
26,7 |
31,5 |
|
10 |
1030 |
0,20 |
0,28 |
28,6 |
39,6 |
|
Осалмид |
|||||
|
2 |
110 |
1,06 |
2,19 |
3,7 |
4,2 |
|
4 |
200 |
0,76 |
1,98 |
4,0 |
7,7 |
|
6 |
300 |
0,62 |
1,30 |
6,2 |
11,5 |
|
8 |
410 |
0,46 |
1,18 |
6,8 |
15,8 |
|
10 |
500 |
0,37 |
1,12 |
7,1 |
19,2 |
|
Эмоксипин |
|||||
|
2 |
45 |
1,81 |
7,12 |
1,1 |
1,7 |
|
4 |
65 |
1,74 |
5,81 |
1,4 |
2,5 |
|
6 |
110 |
1,62 |
4,30 |
1,9 |
4,2 |
|
8 |
160 |
1,53 |
4,03 |
2,0 |
6,2 |
|
10 |
180 |
1,51 |
3,91 |
2,1 |
6,9 |
|
a-Токоферол |
|||||
|
2 |
160 |
0,78 |
6,51 |
1,2 |
6,2 |
|
4 |
280 |
0,76 |
6,42 |
1,2 |
10,8 |
|
6 |
400 |
0,77 |
6,50 |
1,2 |
15,4 |
|
8 |
500 |
0,76 |
6,34 |
1,2 |
19,2 |
|
10 |
600 |
0,76 |
6,42 |
1,2 |
23,1 |
|
Дибунол |
|||||
|
2 |
190 |
0,68 |
6,32 |
1,3 |
7,3 |
|
4 |
380 |
0,69 |
6,21 |
1,3 |
14,6 |
|
6 |
570 |
0,67 |
6,40 |
1,3 |
21,9 |
|
8 |
750 |
0,68 |
6,12 |
1,3 |
28,9 |
|
10 |
950 |
0,69 |
6,30 |
1,3 |
36,5 |
В работе была проанализирована закономерность изменения начальной (Wo2нач) и максимальной (Wo2max) скорости окисления в присутствии различных концентраций изучаемых АО. Установлено, что указанные кинетические параметры практически не изменялись с ростом концентрации дибунола и α-токоферола, но существенно уменьшались при введении других АО (табл. 3, 4). По всей вероятности, выявленная закономерность связана с участием АО в реакциях нерадикального разрушения гидропероксидов.

Рис. 5. Кинетика накопления гидропероксидов при аутоокислении линолевой кислоты в присутствии равных концентраций АО: 1 – контроль; 2 – эмоксипин; 3 – осалмид; 4 – парацетамол. Стрелкой показан ввод АО. С(АО) = 2∙10–4 M, t = 60 °C
Были проведены эксперименты по прямому тестированию кинетики накопления гидропероксидов после введения в частично окисленный липидный субстрат каждого из исследуемых АО. Из рис. 5 видно, что после ввода АО в течение первого часа наблюдалось снижение концентрации гидропероксидов практически до исходного уровня. Установлено, что АО способствовали разрушению гидропероксидов на 20–75 %.
Выводы
1. Получен ряд уменьшения константы скорости реакции k7 соединений с пероксильными радикалами: 3,60∙106 М–1∙с–1 (a-токоферол) > 6,86∙104 М–1∙с–1 (осалмид) > 4,00∙104 М–1∙с–1 (парацетамол) > 1,40∙104 М–1∙с–1 (дибунол) > 0,61∙104 М–1∙с–1 (эмоксипин).
2. Установлено, что осалмид и парацетамол в процессе окисления способны как эффективно уничтожать пероксильные радикалы, так и разрушать гидропероксиды молекулярным путем. Вероятно, что антирадикальная активность ингибиторов обусловлена присутствием в их химической структуре фенольного гидроксила, а способность разрушения гидропероксидов связана с наличием амидной группы.
3. Показан идентичный механизм действия стационарного антиоксиданта дибунола при инициированном окислении безводных и катализируемых водно-липидных субстратов.
4. Установлена слабая антиоксидантная активность a-токоферола при каталитическом окислении водно-липидных субстратов.
5. Установлена высокая антиоксидантная активность парацетамола в безводной инициируемой среде и низкая в водно-липидной катализируемой среде.
6. С целью расширения спектра фармакологического действия изучаемых соединений были получены патенты на изобретение (осалмид, парацетамол).
Рецензенты:Ерёмин Д.И., д.б.н., профессор кафедры почвоведения и агрохимии, ФГБОУ ВПО «Государственный аграрный университет Северного Зауралья», г. Тюмень;
Грехова И.В., д.б.н., профессор кафедры общей химии, ФГБОУ ВПО «Государственный аграрный университет Северного Зауралья», г. Тюмень.
Работа поступила в редакцию 06.02.2015.
Библиографическая ссылка
Перевозкина М.Г. КИНЕТИЧЕСКИЕ МОДЕЛИ ДЛЯ ТЕСТИРОВАНИЯ АНТИОКСИДАНТНЫХ СВОЙСТВ ЭМОКСИПИНА, ОСАЛМИДА И ПАРАЦЕТАМОЛА // Фундаментальные исследования. 2015. № 2-5. С. 940-947;URL: https://fundamental-research.ru/ru/article/view?id=36961 (дата обращения: 08.01.2026).