Согласно данным ВОЗ установлена тесная связь между курением табака и преждевременной смертью более чем 6 миллионов человек в год. Прогнозные исследования свидетельствуют об увеличении до 10 % к 2030 году вклада никотин-ассоциированных заболеваний в общую смертность населения стран с различным уровнем экономики. В составе табачного дыма присутствуют около 4000 химических веществ, 250 из которых имеют токсические эффекты, а 50 признаны канцерогенами. Тем не менее наиболее изученным и активно обсуждаемым компонентом табачного дыма является никотин. Реализация эффектов никотина происходит через никотиновые ацетилхолиновые рецепторы (нАХР), многочисленные подтипы которых представлены в различных отделах нервной системы. α4β2-подтип нАХР рецепторов преимущественно определяется в центральной нервной системе и имеет связь с развитием никотиновой зависимости [12]. α7-подтип нАХР рецепторов участвует в обеспечении скорости синаптической передачи, реализации когнитивных функций [7] и наряду с α4β2-подтипом обеспечивает процессы вазорегуляции и контрактильной активности миокарда. Помимо присутствия в различных отделах нервной системы экспрессия нАХР установлена в эндотелиоцитах сосудов и направлена на синтез, транспортировку и метаболизм ацетилхолина. Предполагается, что эндотелиальный пул нАХР обеспечивает участие никотина в ангиогенезе, эффекты которого зависят от продолжительности воздействия стимула и могут иметь разнонаправленный характер. Так, при краткосрочных эффектах никотина наблюдается усиление процессов неоангиогенеза посредством стимуляции эндотелиальных нАХР. В то же время при длительной стимуляции никотиновых рецепторов в серии экспериментальных исследований у крыс установлено подавление активности α7-нАХР, сопровождающееся замедлением процессов неоангиогенеза [8].
Очевидно, что курение является значимым фактором развития эндотелиальной дисфункции и одним из триггеров возникновения патологического каскада, запускающего необратимые процессы морфофункциональных изменений сосудистого русла. В литературе достаточно данных о роли патофизиологических эффектов табачного дыма на организм человека, особенно при развитии онкологических, сердечно-сосудистых и легочных заболеваний. В то же время мало освещен вопрос об изменениях цереброваскулярной системы при табакокурении.
Нам представилось интересным изучение влияния табачного дыма на структурную реорганизацию сосудистого русла головного мозга.
Материалы и методы исследования
Материалом исследования послужили 10 крыс-самцов линии Вистар 8-недельного возраста массой 230–250 г, разделенные произвольно на 2 группы, одна из которых дышала атмосферным воздухом (контрольная группа; 4 крысы), а другую (экспериментальная группа; 6 крыс) – обкуривали табачным дымом. Эксперименты проводились в соответствии с Хельсинкской декларацией 1975 года и ее пересмотренным вариантом от 2008 года. Экспериментальная модель табакокурения выполнена в соответствии с протоколом H. Zheng и колл. (2009) [9]. Группу крыс-курильщиков помещали в специальную камеру для ингаляции, где они подвергались воздействию табачного дыма в течение 1 часа утром и 1 часа днем, 7 дней в неделю в течение 6 месяцев. Через 6 месяцев животных обеих групп фиксировали и анестезировали путем внутрибрюшинного введения рометара (Xylazinum, «Spora», Praha) в концентрации 5,5 мг/кг. Затем производилась декапитация животных и изготавливались гистологические препараты головного мозга. Для общеморфологического анализа парафиновые срезы головного мозга толщиной 10 мкм депарафинировали и окрашивали гематоксилином и эозином по стандартной методике, затем оценивали плотность распределения капилляров на 1 мм2 (мкм/мм2), удельную плотность распределения клеток глии на 1 мкм2 и индекс Керногана (соотношение толщины стенки артерии к диаметру просвета). Гистологические препараты просматривали в световом микроскопе AxioScope A1 (Carl Zeiss, Германия) и фотографировали при помощи цифрового фотоаппарата AxioCam ICc3 (Carl Zeiss, Германия). Обработку результатов осуществляли с помощью программ Adobe Photoshop 7.0 и Image J. Достоверность различий между группами (при p < 0,05) оценивали с помощью коэффициента Манна – Уитни.
Результаты исследования и их обсуждение
Нами обнаружено, что при длительном табакокурении морфометрические параметры микроциркуляторного русла головного мозга имеют выраженное отличие от группы контроля (рис. 1).
Удельная плотность распределения капилляров на площади в 1 мм2 при воздействии табачного дыма составила 115,8 ± 9,7 мкм, что было достоверно меньше, чем в контрольной группе, – 455,4 ± 18,9 мкм (р < 0,001). Уменьшение количества капилляров может свидетельствовать о нарушении процессов ангиогенеза, который регулируется балансом ангиогенных и ангиостатических факторов. При этом компоненты табачного дыма (никотин, нитрозамины, фенолы, формальдегид и т.д.) могут влиять на ангиогенез посредством стимуляции как ангиогенных, так и ангиостатических факторов.
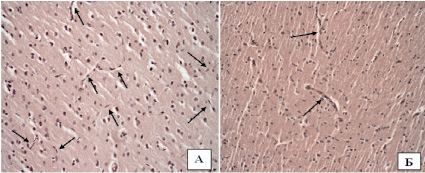
Рис. 1. Распределение капилляров в головном мозге крыс контрольной группы (А) и у животных с моделью хронического табакокурения (Б). Окраска гематоксилином и эозином, ув. х20; стрелками указаны капилляры
Большинство публикаций в этой области посвящены влиянию никотина на ангиогенез. Данные литературы говорят о том, что изменения в сосудистом русле зависят от продолжительности курения. Ангиогенный эффект никотина опосредуется эндотелиальными нАХР, наиболее распространенными из которых являются α7-нАХР. Указанные рецепторы играют важную роль в ангиогенезе и активируются в эндотелии в условиях гипоксии и ишемии. Известно, что в клинически значимых дозах острое воздействие никотина увеличивает пролиферацию эндотелиоцитов, их миграцию и образование новых капилляров в условиях in vitro. Краткосрочная экспозиция никотина у животных in vivo усиливает процессы васкуляризации опухолей, неоваскуляризации атеросклеротических бляшек и ангиогенеза сетчатки. По данным Li X.W. и др. активация нАХР может повысить образование капилляров в зоне экспериментального инфаркта миокарда [10]. Напротив, длительное воздействие табачного дыма подавляет капиллярный рост. В серии экспериментов, проведенных Hakuoh Konishi и др., показано, что у животных, подвергавшихся в течение 52 недель воздействию никотина, нарушен эндотелиальный рост сосудистых сегментов аорты. Данный факт авторы связали с угнетением синтеза белков-переносчиков α7-нАХР и соответственно подавлением активности рецепторов α7-нАХР. Таким образом, «острый ангиогенный эффект» никотина в виде увеличения плотности капилляров утрачивается при его хроническом воздействии [8].
Основной функцией капилляров является обеспечение обмена метаболитами между тканями и кровью. Проявление микрососудистого разрежения, или рарефикации, ухудшает перфузию головного мозга, особенно белого вещества, так как в нём, в отличие от большинства других тканей, отсутствует резерв капилляров, т.е. определенное количество капилляров, потеря которых не отражается на перфузии ткани. В белом веществе также слабо развита система анастомозов между капиллярами [3]. Мы обнаружили, что при длительном курении одновременно с обеднением микрососудистого русла отмечается и уменьшение количества клеточных элементов в веществе мозга, о чем говорит достоверное снижение удельной плотности распределения клеток нейроглии до 16,9 ± 1,2 клеток/мкм2 по сравнению с группой контроля (37,1 ± 3,4 клеток/мкм2; р < 0,01) (рис. 2).
Рарефикацию капилляров и уменьшение клеточных элементов нейроглии следует рассматривать в качестве взаимосвязанных процессов. Уменьшение плотности капиллярного русла значительно снижает доставку кислорода и питательных веществ к тканям с возникновением «энергетического» дефицита, в условиях которого гибнет часть клеток нейроглии. Можно провести параллель между полученными нами результатами в виде потери нейронов и установленным в клинических исследованиях ухудшением когнитивных функций у курильщиков. Например, у курящих подростков хуже показатели вербальной памяти, устного счета, словарного запаса [4], скорости обработки информации [14] и общий интеллект [15] по сравнению с некурящими сверстниками.
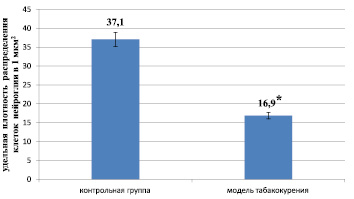
Рис. 2. Удельная плотность распределения клеток нейроглии при экспериментальном моделировании табакокурения (Примечание. ⃰ – различия между группами при р ˂ 0,01)
Уменьшение плотности капилляров и артериол обусловливает повышение сосудистого сопротивления в данном бассейне и обеднение микрососудистого русла [6]. Росту сосудистого сопротивления могут способствовать и структурные изменения в мелких артериях, которые выражаются в сужении просвета и увеличении соотношения между толщиной стенки и диаметром сосуда в результате гиперплазии и гипертрофии гладких миоцитов. Действительно, согласно полученным нами результатам индекс Керногана (соотношение толщины стенки артерии к диаметру просвета) достоверно выше у животных экспериментальной группы, чем в контроле (соответственно 1,59 ± 0,07 и 0,98 ± 0,06; р ˂ 0,001) (рис. 3).

Рис. 3. Артериолы головного мозга у крыс контрольной группы (А) и у животных с моделью хронического табакокурения (Б). Окраска гематоксилином и эозином, ув. х20; стрелками указаны артериолы головного мозга
Артериолы головного мозга, имеющие толстые гладкомышечные стенки, являются резистивными сосудами, способными при сокращении изменять величину просвета, что является основным компонентом регуляции кровоснабжения органов в ответ на гемодинамические стимулы. Главная функция гладкомышечных волокон состоит в создании активного напряжения сосудистой стенки (сосудистого тонуса) и в изменении величины просвета сосудов в соответствии с физиологическими потребностями кровоснабжаемой области. При курении в результате вазоспазма происходит сокращение гладких мышц артериол и их радиус уменьшается, за счет чего снижается напряжение в стенке. Сначала это служит адаптивным механизмом, однако в дальнейшем при длительном воздействии табачного дыма приводит к стойкому и прогрессирующему изменению архитектоники артерий и сосудистому ремоделированию концентрического типа, при котором происходит уменьшение просвета сосуда за счет утолщения его мышечного компонента. Данное ремоделирование сосудистой стенки может приводить к нарушению вазомоторных реакций в церебральных артериях [1].
Таким образом, в условиях хронического табакокурения регистрируется изменение градиента ангиогенеза в сторону уменьшения плотности капилляров в головном мозге. Одновременно с этим отмечается снижение количества клеток нейроглии. Обеднение микрососудистого русла может быть одной из причин структурного ремоделирования артерий вследствие повышения сопротивления в данном сосудистом басейне.
Рецензенты:Дубиков А.И., д.м.н., профессор, заведующий кафедрой факультетской терапии, ГБОУ ВПО «Тихоокеанский государственный медицинский университет» Минздрава России, г. Владивосток;
Котельников В.Н., д.м.н., доцент, руководитель учебного военного центра, ГБОУ ВПО «Тихоокеанский государственный медицинский университет» Минздрава России, г. Владивосток.
Работа поступила в редакцию 24.02.2015.
Библиографическая ссылка
Захарчук Н.В., Невзорова В.А., Гончар Е.Ю. РЕОРГАНИЗАЦИЯ СОСУДИСТОГО РУСЛА ГОЛОВНОГО МОЗГА У КРЫС ПРИ МОДЕЛИРОВАНИИ ХРОНИЧЕСКОГО ТАБАКОКУРЕНИЯ // Фундаментальные исследования. 2015. № 1-2. С. 270-274;URL: https://fundamental-research.ru/ru/article/view?id=36885 (дата обращения: 14.02.2026).



