Загрязнение окружающей среды носит сложный характер и вызывает в природных экосистемах глубокие изменения, снижающие их устойчивость. Трансформации подвергаются как наземные, так и водные экосистемы. Одним из таких изменений является увеличение токсичности компонентов природной среды вследствие накопления загрязняющих веществ [3, 5, 6, 13].
Для оценки токсичности природных вод, промышленных сбросов, почвы, кормов и прочих объектов окружающей среды используют тесты на различных живых организмах [1, 4, 7, 10, 11, 13, 14]. Чаще всего в качестве тест-объектов используются организмы, которые широко распространены в природе, участвуют в процессах самоочищения вод и обладают коротким жизненным циклом. Таким требованиям отвечают Protozoa. Методы биотестирования при помощи простейших обладают высокой чувствительностью, экспрессностью, надежностью, универсальностью и малой себестоимостью. Они просты в проведении, поддаются инструментализации и автоматизации, а их результаты легко интерпретируемы [4, 7, 8].
Цель исследования: изучение возможности использования микроорганизмов сенного настоя для эколого-токсикологической оценки состояния объектов окружающей среды (природных и сточных вод, снега, почвы, донных осадков и др.).
Задачи:
1. изучить таксономический состав микронаселения сенного настоя;
2. выявить индикаторные виды микроорганизмов, которые могут быть использованы в качестве тест-объектов (тест-систем);
3. провести работы по культивированию индикаторных тест-организмов.
В работе впервые представлена таксономическая характеристика микроорганизмов сенного настоя; выделены организмы, которые отвечают требованиям, предъявляемым к тест-объектам в биотестировании; проведены работы по культивированию генетически однородного штамма инфузорий Colpoda sp.
Материалы и методы исследования
Приготовление сенного настоя осуществлялось по общепринятой методике [2]. Сенной настой разделяли на три емкости: «чистый» сенной настой, настой с добавлением аквариумной воды и почвы. В качестве подкормки использовали сухие хлебопекарные дрожжи. Наблюдения за Protozoa проводили в течение нескольких месяцев при t = 20 ± 2 °С. Идентификацию простейших проводили под микроскопом при увеличении: об.40х, ок.10х. Для получения однородной культуры производили пересадку микроорганизмов в стерильные пробирки с питательной средой.
Для проведения биотестирования использовали сенной настой разной степени зрелости (от 5 суток до 2-х месяцев и более), содержащий свободноживущие инфузории родов Colpoda, Oxytricha, Stylonychia, Euplotes, Paramecium, а также червей сем. Stenostomidae, Philodinidae и Dicranophoridae.
Эксперименты по биотестированию проводили с дизельным топливом (ДТ), моторным маслом (ММ). Нефтепродукты разводились в дистиллированной воде в концентрациях 0,1 мг/л, 1,0 мг/л и 10,0 мг/л. В чашках Петри в равных пропорциях смешивали сенной настой с водными растворами (эмульсиями) нефтепродуктов. Биотестирование проводили в течение 6 суток. Просмотр проб проводили через 15 мин., 1 час, 24 часа, 2 сут., 4 сут., 6 сут. при увеличении: об.10х, ок.10х. Подсчет организмов производили в 10 полях зрения. Пробы фотографировали при увеличении 1х, 1,5х, 2х, 3х. Критерием острой и хронической токсичности являлось статистически достоверное различие с контролем или снижение численности инфузорий на 50 % и 25 % по сравнению с контролем в течение 24-х и 96-часовой и более экспозиции соответственно. Проба являлась токсичной также при стимуляции клеток простейших более чем на 30 % [8]. Результаты были подвергнуты статистической обработке при помощи Microsoft Office Excel.
Результаты исследования и их обсуждение
На начальных сроках опытов (1–5-е сутки) в пробах сенного настоя встречаются бесцветные жгутиконосцы, равноресничные инфузории родов Aspidisca и Holophrya (рис. 1).
Популяции этих микроорганизмов характеризуются взрывным ростом численности, который сменяется резким спадом. Такая нестабильность и маленький размер особей затрудняет их использование в качестве тест-организмов.
Инфузории рода Colpoda появляются в сенном настое на 5–10 сутки культивирования. Типичными представителями этого рода в лабораторном микрокосме являются C. steini, C. cucullus и C. aspera (рис. 2).
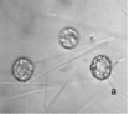
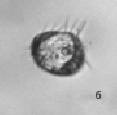
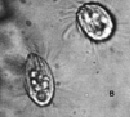
Рис. 1. Жгутиконосцы и ресничные инфузории: а – жгутиконосцы Mastigophora, б – инфузория Aspidisca sp., в – инфузория Holophrya sp. Ув. микроскопа: об.40х, ок.10х; ув. фотоаппарата: 1х

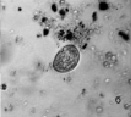
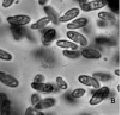
Рис. 2. Инфузории рода Colpoda: а – C. steini; б – C.cucullus; в – C.aspera. Ув. микроскопа: об.10х, ок.10х; ув. фотоаппарата: 2х, 3х
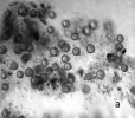
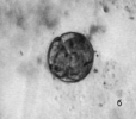
Рис. 3. Инфузория C. steini: а – цисты покоя; б – циста в состоянии деления. Ув. микроскопа: об.10х, ок.10х; об.40х, ок.10х; ув. фотоаппарата: 1х, 1,5х
Среди инфузорий рода Colpoda наиболее устойчивую популяцию образует Colpoda steini Enriquez, 1908. Это широко распространенный вид, обитающий в почвах и пресных водоемах. При неблагоприятных условиях C. steini способна образовывать цисту покоя (рис. 3, а). C. steini способна в течение 12 часов эксцистироваться. При этом в период эксцистирования происходит деление клетки. Количество будущих особей может колебаться от 4 до 128 [15]. В опыте мы наблюдали в цисте от 4 до 8 особей (рис. 3, б). Размножение длится 1–2 суток. При наступлении неблагоприятных условий кольподы снова цистируются. Добавление сухих дрожжей стимулирует новый цикл размножения.
На действие растворов ДТ C. steini реагируют как цистированием, так и резкой вспышкой численности. Эта характеристика может быть успешно использована как тест-функция в биотестировании. Быстрый переход от стадии покоя к активной жизнедеятельности позволяет получать на основе культуры C. steini удобный в использовании сухой препарат-диагностикум с длительным сроком годности. Для получения диагностического препарата нами был использован метод синхронизации [4]. В июне 2012 г. культуру C. steini, полученную в сенном настое, поместили в три чашки Петри, высушили и в состоянии цисты оставили на хранение. Через 4 месяца в чашки Петри добавили дистиллированную воду. А через 2 суток получена синхронизированная культура C. steini.
На 10–15 сутки опыта среди свободноживущих инфузорий можно выделить представителей родов Paramecium, Blepharisma, Oxytricha, Stylonychia и Euplotes. Из них наиболее устойчивую популяцию образуют Paramecium caudatum и Oxytricha sp.
Paramecium caudatum Ehrenberg, 1838 – это широко распространенная ресничная инфузория, предпочитающая альфа-мезосапробные условия. Температурный оптимум лежит в пределах 24–28 °C, предпочитает pH, близкую к нейтральной (6,5–7,5). Основной пищей парамеции являются бактерии, водоросли и мелкие простейшие. Питание инфузорий осуществляется через глотку – фагоцитоз, или через клеточную мембрану – пиноцитоз. Короткий жизненный цикл, высокий темп деления, возможность клонирования позволяют эффективно использовать ее в биотестировании и токсикологических исследованиях в течение всего года [8].
На начальных стадиях эксперимента при СДТ = 0,1, 1,0 и 10,0 мг/л парамеция активно фагоцитирует капли ДТ, ее клетка увеличивается в размерах в 2–3 раза (рис. 4, а). В эти сроки опыта отмечается резкий рост численности парамеции. Факт скачкообразного увеличения численности инфузорий объясняется тем, что в водных растворах ДТ при t = 20 °С активно развиваются нефтеокисляющие бактерии, которые являются источником пищи для инфузорий-бактериофагов. Потребление нефтесодержащей органики происходит по схеме: ДТ – нефтеокисляющие бактерии – инфузории [5]. Простейшие способны не только быть непосредственными потребителями органики, но и оказывать стимулирующее влияние на активность бактерий. В течение последующих суток происходит постепенная утилизация нефтеуглеводородов (рис. 4, б). В эти же сроки опыта численность парамеции резко снижается. В опытах с ММ показано, что при Cмм = 0,1 и 1,0 мг/л численность парамеции снижается уже в первые часы и сутки наблюдения. Остро токсична для инфузории СММ = 10,0 мг/л. Спустя 1 час было отмечено разрушение клеточной оболочки парамеции (рис. 4, в). Следует отметить, что фактор токсичности для парамеций в опыте с ММ преобладает над пищевым фактором.
Динамика численности P. сaudatum в опытах с растворами ДТ и ММ представлена на рис. 5.
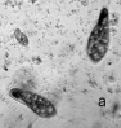
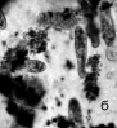
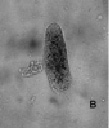
Рис. 4. Биотестирование нефтепродуктов с помощью P. caudatum: а – опыт с ДТ (через 24 часа); б – опыт с ДТ (на 2-4 сутки); в – опыт с ММ (спустя 1 час). Ув. микроскопа: об.10х, ок.10х; ув. фотоаппарата: 1,5х, 2х, 3х
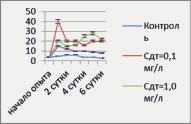
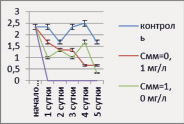
Рис. 5. Динамика численности P. caudatum в опыте с нефтепродуктами
Эксперименты показали, что чувствительность P. caudatum проявляется на стадии экспоненциального роста, поэтому поддержание в лабораторных условиях популяции в данной фазе развития является необходимым условием для использования ее в качестве тест-объекта.
Проведены опыты по биотестированию тяжелых нефтепродуктов с помощью Oxytricha sp. Эта инфузория широко распространена в пресных водоемах и почвах. Основной пищей окситрихи являются бактерии, дрожжи, детрит. Размножение происходит путем поперечного деления клетки. В зависимости от условий выращивания время генерации может составлять от нескольких часов до нескольких суток. Изменение внешних условий (температура, химический состав среды и другие факторы) воспринимаются клеткой, и первая ответная реакция – изменение характера движения: уменьшение или увеличение скорости, частоты остановок и разворотов, разнообразные таксисы.
Биотестирование тяжелых НП (мазута) дало следующую картину. Просмотр проб в рабочем (неразведенном) растворе показал, что в первые минуты опыта инфузория резко замедлила скорость движения вплоть до полной остановки. Затем в течение 5 минут инфузория совершала круговые вращательные движения. Через 10–15 минут мы наблюдали прекращение движения и разрушение структуры клетки. Реакция инфузорий на действие водных эмульсий НП в разведении 1:2 и 1:3 была идентичной. Размеры перистомального поля уменьшались. Просматривалось изменение внутренней структуры организмов: уплотнение макро- и микронуклеуса, нарушение функций сократительной вакуоли и др. Спустя 30 минут отмечалась 100 % гибель окситрихи во всех пробах.
Среди других представителей свободноживущих инфузорий сенного настоя можно отметить инфузорию рода Euplotes. Появляется на 5–10 сутки после закладки опыта. Численность инфузории колеблется в пределах 1–4 экз/п.зр. микроскопа. Euplotes sp. характеризуется высокой подвижностью, резкими колебаниями численности, что ограничивает ее использование в биотестировании. На 10–15 сутки в пробах сенного настоя эпизодически встречается инфузория рода Stylonychia. Стилонихию достаточно легко содержать в лабораторных условиях, она может быть использована в биотестировании.
Видовой состав многоклеточных организмов сенного настоя в разных вариантах его приготовления характеризуется некоторыми отличиями. Так, в сенном настое с добавлением почвы многоклеточные организмы были представлены немногочисленными, но стабильно присутствующими экземплярами круглых червей (тип Nemathelmintes): организмами, принадлежащими к классу брюхоресничные, или гастротрихи (Gastrotricha); представителями класса коловратки (Rotatoria). Коловратки родов Rotaria и Philodina появились в пробах через месяц наблюдения. В сенном настое с добавлением аквариумной воды через 2 месяца отмечено начало развития ресничных червей Turbellaria, принадлежащих к семейству Stenostomidae [9].
Опыты по биотестированию проводили с червями семейства Stenostomidae. При действии НП в концентрации СММ = 0,1 мг/л наблюдалось замедление движения червей, образование малоподвижных скоплений. В случае высоких концентраций НП (СММ = 1,0 мг/л и СММ = 10,0 мг/л) тело червя сжималось, в среднем и хвостовом отделе формировались капсулы. В целом наблюдалась дезинтеграция внутренних органов, приводящая к гибели организмов. Черви сем. Stenostomidae являются чувствительными тест-организмами. Однако популяция Stenostomidae появляется в сенном настое время от времени, что затрудняет ее использование для целей биотестирования.
Спустя 20–30 дней в пробах отмечено присутствие коловраток – представителей семейств Philodinidae и Dicranophoridae [10]. Под действием микроорганизмов в течение месяца в сенном настое произошла флокуляция коллоидных частиц и образование агрегатов ДТ. В области этих сгустков и сосредоточилась жизнедеятельность инфузорий и коловраток. Первоначально Philodina sp. были представлены единичными экземплярами. В ходе опыта экспоненциальное увеличение численности коловраток совпадало с уменьшением численности инфузорий. ДТ образовало на поверхности раствора пленку, которая и послужила субстратом для массового развития коловраток. По мере уменьшения площади пленки был отмечен переход коловраток в состояние анабиоза, или высыхания. Результаты опыта демонстрируют возможность применения культуры коловраток как для биологической очистки (доочистки) нефтяного загрязнения среды, так и для биотестирования, что согласуется с результатами других исследователей [1, 12].
Изучение видового спектра микроорганизмов в сенном настое выявило закономерность появления и смены инфузорий на ранних сроках наблюдения (5–15 суток): Colpoda sp. → Euplotes sp. → Oxytricha sp. (Stylonychia sp.) → Paramecium sp. На поздних сроках опыта последовательность смены состава гетеротрофного сообщества происходила по схеме: коловратки → нематоды → ресничные черви. Что касается других микроорганизмов сенного настоя, то их таксономический состав определяется свойствами добавляемых ингредиентов (почва, аквариумная вода).
На начальных сроках опыта (5–10 сутки) в сенном настое наиболее устойчивую популяцию образует инфузория Colpoda steini. Установлено, что чувствительность кольподы выше на постцистной стадии развития. Также выявлено, что наиболее чувствительными тест-объектами были Paramecium caudatum и Oxytricha sp. Поддержание популяции этих свободноживущих инфузорий в экспоненциальной фазе роста является необходимым условием успешного применения в биотестировании. Тщательное изучение культур инфузорий, выращенных в сенном настое, выявление закономерностей их ответных реакций, разработка единого метода подготовки проб и культуры инфузорий как тест-системы к проведению анализа позволят получить объективную картину эколого-токсикологического состояния среды.
Таким образом, проведение серий экспериментов по выращиванию гетеротрофных организмов в сенном настое, выделение индикаторных тест-систем, чувствительных к токсиканту, опыты по получению синхронизированной культуры инфузорий и выявление роли коловраток в утилизации нефтяного загрязнения является эффективным инструментом в биотестировании и биоиндикации состояния окружающей среды.
Рецензенты:
Макаревич П.Р., д.б.н., профессор, первый заместитель директора по науке Мурманского морского биологического института КНЦ РАН, г. Мурманск;
Зензеров В.С., д.б.н., ведущий научный сотрудник, Мурманский морской биологический институт КНЦ РАН, г. Мурманск.
Работа поступила в редакцию 31.12.2014.
Библиографическая ссылка
Минченок Е.Е., Пахомова Н.А. ВИДОВОЙ СОСТАВ МИКРООРГАНИЗМОВ СЕННОГО НАСТОЯ И ИХ ИСПОЛЬЗОВАНИЕ В БИОТЕСТИРОВАНИИ // Фундаментальные исследования. 2014. № 12-12. С. 2584-2589;URL: https://fundamental-research.ru/ru/article/view?id=36732 (дата обращения: 13.02.2026).



