Поиск средств, обладающих выраженными антиоксидантными свойствами, позволяющими оказывать влияние на течение обменных процессов в организме человека, по-прежнему остается актуальной задачей настоящего времени. И перспективным в этом плане могут быть гидробионты, из которых выделены вещества, нашедшие применение в современной фармакологической и косметической практике [3]. Одним из таких соединений является созданный на базе Института биомедицинских исследований и ОАО «Росбиофарм», очищенный стабилизированный водный экстракт печени черноморской колючей акулы (Squalus acanthias) с товарным знаком «Скваакан», на который в 2003 году был зарегистрирован патент «Способ получения лекарственного препарата «Скваакан» [6].
Целью настоящей работы является изучение антиоксидантных свойств водного экстракта печени черноморской колючей акулы в норме и при экспериментальном оксидативном стрессе, созданном введением циклофосфамида.
Материалы и методы исследований
Исследования проведены на 40 белых крысах-самцах линии Wistar, разделенных на четыре равные группы по десять особей в каждой. Животные отбирались в возрасте 90 ± 5 дней и содержались в условиях естественного освещения на стандартной диете вивария, состоящей из злаковых и овощей. Доступ к воде был свободный и постоянный.
Животным первой группы внутрибрюшинно вводили физиологический раствор в объеме 1,0 мл; вторую группу составляли крысы, получавшие в/б «Скваакан» в дозе 0,02 мл/кг один раз в двое суток на протяжении 16 дней (8 инъекций, вводимый объем с учетом разведения физиологическим раствором составлял 1,0 мл); животные третьей группы получали в/б «Циклофосфан-ЛЭНС» в дозе 150,0 мг/кг один раз в двое суток на протяжении 16 дней (8 инъекций, вводимый объем 1,0 мл); животным четвертой группы в/б один день вводили «Скваакан», а другой – «Циклофосфан-ЛЭНС» в дозах, аналогичных второй и третьей группам. Все опыты проводили в соответствии с приказом Минздравсоцразвития России № 708н от 23 августа 2010 г. «Об утверждении Правил лабораторной практики».
Через 24 часа после последней инъекции крысам внутрибрюшинно вводилось 5,0 мг анестетика общего действия («Золетил», в объеме 0,1 мл готового раствора препарата) и при достижении состояния обезболивания и сна (через 6–8 минут) они подвергались декапитации, а в собранных образцах крови, стабилизированной гепарином, определялись содержание маркеров перекисного окисления липидов – гидроперекисей (ГП) в плазме крови и малонового диальдегида (МДА) в эритроцитах по реакции с тиобарбитуровой кислотой; осмотическая резистентность мембран эритроцитов к растворам с нарастающим гипертоническим эффектом, состоящим из смеси хлорида натрия и карбамида (с номерами от 1 до 7, где в последнем имеет место 100 % гемолиз) [1]; активность показателей цитолиза гепатоцитов – аланин- и аспартаттрансаминаз (АлТ и АсТ). О состоянии антиоксидантной защиты судили по активности в эритроцитах одного из основных ферментов системы – каталазы по методу T. Beutler [5].
Полученные результаты обрабатывались статистически в программе Excel по парному t-критерию Стьюдента.
Результаты исследования и их обсуждение
В работе в качестве индуктора свободнорадикального окисления использован широко применяемый в химиотерапии цитостатик циклофосфамид, метаболизирующийся в печени под действием микросомальной оксидазной системы с образованием метаболитов (активный – 4-гидроксициклофосфамид и неактивный – 4-кетоциклофосфамид), часть которых транспортируется в клетки, где под влиянием фосфатаз превращается в метаболиты, обладающие длительным стойким цитотоксическим действием с периодом полувыведения до 12 часов [2]. Образующийся активный метаболит вступает в реакции алкилирования, приводя к поперечным сшивкам в двойной цепи между нитями ДНК с ингибированием синтеза РНК и белка. В результате этого активизируются тригерные механизмы гибели клеток путем некроза и апоптоза, протекающие через активацию процессов свободнорадикального окисления, что приводит к окислительному стрессу [7].
Изолированное введение крысам «Скваакана» на исследуемые показатели оказывает неоднозначное действие, что проявлялось в статистически значимом снижении содержания малонового диальдегида в мембранах эритроцитов с 33,41 ± 2,85 мкмоль/л до 21,82 ± 1,88 мкмоль/л (р < 0,002 относительно контрольной группы), в то время как уровень гидроперекисей в плазме крови не менялся (рис. 1). Введение крысам циклофосфамида вызвало усиление пероксидации липидов на 66,98 % и 44,61 % по содержанию гидроперекисей и малонового диальдегида соответственно. С учетом того, что циклофосфамид как прооксидант вызывает активацию процессов свободно-радикального окисления, это вполне закономерно, а при его совместном введении со «Сквааканом» исследуемые показатели претерпели более резкое снижение, оказавшись ниже нормы (гидроперекиси на 25,5 % и малоновый диальдегид на 29,4 %). Это, очевидно связано не только с тем, что «Скваакан», блокирует образование активных форм кислорода и препятствует дальнейшему развитию оксидативного стресса, в том числе и опосредованного апоптозом и некрозом, что сопровождается нормализирующим морфологическую картину печени введением экстракта гидробионта при экспериментальном остром токсическом гепатите [4], но и тем, что он в условиях мембранной патологии, возможно, активизирует и другие защитные механизмы, а не только те, что связаны с действием ферментов антиоксидантной защиты, в частности каталазы (рис. 1), которая в условиях активации процессов липопероксидации, вызванных введением циклофосфамида, компенсаторно увеличивается. В то же время между группой, получавшей «Скваакан» и контрольными животными нет достоверных расхождений в активности фермента.
В качестве дополнительного подтверждения этой гипотезы можно привести полученные нами результаты изучения осмотической резистентности мембран эритроцитов в условиях in vitro к действию растворов с нарастающей концентрацией мочевины, обладающей гемолитическим действием (рис. 2).
Из рисунка видно, что кривая осмотической резистентности мембран эритроцитов крыс, получавших «Скваакан», сдвинута вправо относительно данных контрольных животных, получавших физиологический раствор. При этом результаты имеют статистически значимое отличие (р < 0,02) в образцах, внесенных в раствор № 3, хотя по кривой видно, что достоверное отличие начинается раньше (с середины раствора № 2) и длится дольше (до середины раствора № 4). В то же время кривая устойчивости мембран эритроцитов, получавших в ходе эксперимента циклофосфамид, оказывается сдвинутой влево, что обусловлено тем, что этот цитостатик обладает прооксидантным действием и способен вызвать нарушение целостности мембран эритроцитов, и такое расположение этих трех кривых на графике вполне закономерно и логически обоснованно. А то, что результаты, полученные у крыс, которым вводились циклофосфамид и «Скваакан», в графике также смещены вправо и находятся рядом с данными, когда крысы получали только «Скваакан» как раз и не противоречит тому, что они аналогичны изменением содержания гидроперекисей и малонового диальдегида, как показано в рис. 1. То есть «Скваакан» в условиях активации (индукции) процессов свободнорадикального окисления оказывает мембраностабилизирующее действие.
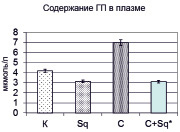
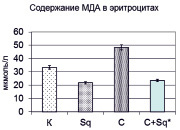
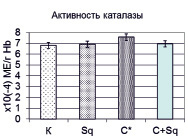
Рис. 1. Содержание гидроперекисей, малонового диальдегида и активность каталазы у крыс контрольных (К), получавших «Скваакан» (Sq), циклофосфамид (С) и их чередование (Sq + С)
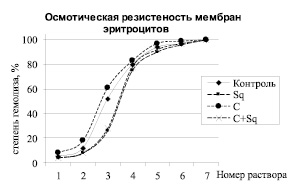
Рис. 2. Осмотическая резистентность мембран эритроцитов крыс контрольных (К), получавших «Скваакан» (Sq), циклофосфамид (С) и их чередование (Sq + С)
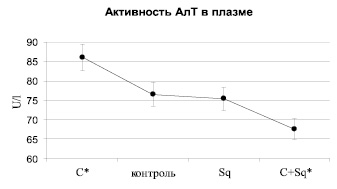
Рис. 3. Зависимость активности АлТ в плазме крыс контрольных (К), получавших «Скваакан» (Sq), циклофосфамид (С) и их чередование (Sq + С). * – статистически значимое отличие относительно контроля
Поскольку метаболическая активация циклофосфамид связана и с ферментными системами гепатоцитов, представилось интересным изучить содержание одних из маркеров их цитолиза, в частности аланин- и аспартаттрансаминазы. АлТ в отличие от АсТ является более органоспецифичным ферментом и динамика его изменений в большей степени отражает истинную картину состояния гепатоцитов, а АсТ – миокарда, особенно при их поражениях. На рис. 3 изображена графическая зависимость энзиматической активности АлТ, имеющая статистически значимые отличия (р < 0,05) по сравнению с контролем и данными крыс, получавших «Сквакан». При этом введение только циклофосфамида повышает, а совместно со «Сквааканом» – снижает активность фермента. То есть в этом варианте также, как в случае выше отмеченных изменений, мембранопротекторное действие «Скваакана» обусловливает меньший выход в кровяное русло АлТ.
В отношении АсТ динамика носит качественно схожий характер, но менее визуализируемый: для контрольной группы и получавших «Скваакан» активность составила 154,2 ± 11,2 и 152,7 ± 8,9 U/l соответственно, а при введении только циклофосфамида и совместно со «Сквааканом» изменения активности фермента были не столь выраженными – до 161,8 ± 6,4 и 139,1 ± 1,8 U/l соответственно, то есть все отличия имели только тенденциозное направление.
Таким образом, на основании результатов экспериментальных исследований можно заключить, что изучаемый стабилизированный водный экстракт из печени колючей акулы – «Скваакан» в условиях циклофосфан-ндуцированного окислительного стресса проявляет выраженные антиоксидантные свойства, приводя к снижению образования перекисного окисления липидов и активности ферментов цитолиза гепатоцитов. При этом отмеченные изменения приходятся в основном на активные компоненты препарата, поскольку существенных нарушений в ответных реакциях со стороны системы антиоксидантной защиты на примере каталазы не отмечено. «Скваакан» может быть рекомендован для дальнейшего изучения на различные виды биологической активности, корреляционно связанные с антиоксидантыми свойствами, в рамках доклинических испытаний.
Рецензенты:
Болиева Л.З., д.м.н., профессор, заведующая кафедрой фармакологии с клинической фармакологией, ГБОУ ВПО «Северо-Осетинская государственная медицинская академия», г. Владикавказ;
Брин В.Б., д.м.н., профессор, заведующий кафедрой нормальной физиологии ГБОУ ВПО «Северо-Осетинская государственная медицинская академия», г. Владикавказ.
Работа поступила в редакцию 30.12.2014.
Библиографическая ссылка
Батагова Ф.Э., Батагова Ф.Э., Албегова Ж.С., Скупневский С.В., Скупневский С.В., Джиоев И.Г. АНТИОКСИДАНТНЫЕ СВОЙСТВА СТАБИЛИЗИРОВАННОГО ВОДНОГО ЭКСТРАКТА ПЕЧЕНИ КОЛЮЧЕЙ АКУЛЫ (Squalus acanthias) В УСЛОВИЯХ ПРИМЕНЕНИЯ ЦИТОСТАТИКА // Фундаментальные исследования. 2014. № 10-10. С. 1897-1901;URL: https://fundamental-research.ru/ru/article/view?id=36667 (дата обращения: 01.02.2026).



