Хлорированные углеводороды, в частности дихлорэтан (ДХЭ), являются одними из наиболее токсичных веществ, широко используемых в быту и промышленности. Метаболизм ДХЭ протекает весьма интенсивно и происходит в печени, корковом и мозговом слое почек, легких, селезенке, желудочно-кишечном тракте, коже, при этом образуются более токсичные продукты [7, 10]. При сохраняющейся высокой летальности от острых интоксикаций ДХЭ, наиболее часто встречаются состояния, связанные с длительным поступлением токсиканта в организм, при этом способ введения ДХЭ, как показали многочисленные наблюдения, не оказывает существенного влияния на распределение его метаболитов [3, 8]. В ранее выполненных нами исследованиях было выявлено увеличение содержания веществ низкой и средней молекулярной массы (ВНиСММ) в эритроцитах и плазме крови крыс при субхронической интоксикации ДХЭ [4]. В то же время патофизиологические механизмы эндогенной интоксикации при длительном введении ДХЭ изучены далеко не полно.
Считается, что именно эндотоксин (ЭТ) грамотрицательных бактерий, представляющий из себя липополисахарид (ЛПС), играет одну из ведущих ролей в формировании синдрома эндогенной интоксикации. Он обладает исключительно высокой биологической активностью и относится к числу наиболее сильных экзогенных модуляторов иммунологической реактивности. Основное патофизиологическое действие ЭТ опосредуется индукцией выброса целого ряда эндогенных медиаторов воспаления, синтезируемых в основном клетками миеломоноцитарного ряда [15, 16]. Поступление эндотоксина в системный кровоток в значительной степени зависит от состояния цитоплазматических мембран органов и тканей, которые выполняют барьерные функции, где важная роль принадлежит кишечнику [13, 16]. Одним из основных патогенетических факторов, регулирующих проницаемость мембран, выступает активация процессов свободнорадикального окисления. Свободнорадикальное окисление (СРО), являясь одним из общих типовых механизмов дезорганизации плазматических мембран, играет роль триггерного механизма, обеспечивающего доступность липидно-белковых комплексов мембраны соответственно для фосфолипаз и протеаз [12]. Важным звеном в регуляции поступления кишечного липополисахарида в общий кровоток также является гипофизарно-надпочечниковая система, активность которой определяет величину сброса портальной крови по шунтам, минуя печень [1,16].
В связи с этим целью исследования явилось изучение перекисного окисления липидов, антиоксидантной защиты и метаболических процессов в слизистой тонкой кишки, а также оценка уровня липополисахарида и гормонов гипофизарно-надпочечниковой системы (кортизола и адренокортикотропного гормона) в крови крыс при хронической интоксикации ДХЭ.
Материалы и методы исследования
Эксперименты выполнены на 24 здоровых половозрелых неинбредных белых крысах-самцах массой 180–220 г, разделенных на 2 группы: 1-я – контрольная (n = 6), 2-я – животные с моделированной интоксикацией дихлорэтаном (n = 18). Эксперименты проводились в соответствии с требованиями приказов № 1179 МЗ СССР от 10.10.83 г., № 267 МЗ РФ от 19.06.03 г. «Правила проведения работ с использованием экспериментальных животных», «Правила по обращению, содержанию, обезболиванию и умерщвлению экспериментальных животных».
Хроническая интоксикация дихлорэтаном достигалась ежедневным энтеральным введением токсиканта в дозе 5 мг/кг (0,01 LD50) в течение 60 суток. За 12 часов до умерщвления животных лишали пищи. Объектом исследования служили слизистая тонкого кишечника и плазма крови. Для исследования кровь собирали из сердца методом кардиопункции под легким эфирным наркозом, после чего животных подвергали декапитации. Извлекали сегмент проксимального отдела тонкого кишечника. Последний выворачивали, промывали холодным 0,15М КСl и с помощью стеклянной пластинки соскабливали слизистую. Эксперименты выполнялись в зимний период времени. Забор биологического материала производился в утренние часы. Тестирование осуществляли на 15, 30 и 60 сутки.
Состояние перекисного окисления липидов (ПОЛ) оценивали по концентрации диеновых конъюгатов и малонового альдегида. Содержание диеновых конъюгатов (ДК) определяли методом прямой спектрофотометрии. Принцип метода заключается в выделении нативных жирных кислот путем экстракции смесью равных объемов гептана и изопропанола с последующим измерением оптической плотности проб гептановой фазы липидного экстракта. Поглощение при длине волны 232 нм отражает содержание диеновых конъюгатов [2]. Для определения малонового диальдегида (МДА) использовали метод M. Mihara (1980), заключающийся в образовании окрашенного комплекса при взаимодействии продуктов перекисного окисления липидов с тиобарбитуровой кислотой, с помощью стандартного набора фирмы Агат-Мед (Россия).
Одновременно с процессами ПОЛ регистрировали активность ферментов антиоксидантной защиты: каталазы [6], супероксиддисмутазы [9]. Активность глюкозо-6-фосфатдегидрогеназы оценивали спектрофотометрически по восстановлению НАДФ при 340 нм [17]. Определяли содержание восстановленного глутатиона, учитывая его способность реагировать с избытком аллоксана с образованием соединения, имеющего максимум поглощения при длине волны 305 нм [11]. Состояние энергетического обмена оценивали по содержанию молочной и пировиноградной кислот в 10 % гомогенате ткани тонкого кишечника, приготовленном на 6N хлорной кислоте, энзиматическим методом по E. Marbach и M. Weil в модификации И.В. Зарубиной [5,18].
Определение уровня гормонов проводили методом иммуноферментативного анализа (ИФА) с использованием EIA-3647 ACTH ELISA DRG, EIA-1887 Cortisol ELISA DRG. Материалом для определения концентрации кортизола служила сыворотка крови, а для определения адренокортикотропного гормона (АКТГ) – плазма крови. Определение уровня липополисахарида (ЛПС) проводили с помощью LAL-теста (хромогенный тест) набора реактивов ENDOSAFE® ENDOCHROME™ («HyСult biotechnology», Голландия).
Обработку полученных результатов проводили с применением методов вариационной статистики. После проверки нормальности распределения изучаемых параметров в сравниваемых группах определяли средние величины (М), ошибку средних величин (m) при соответствии распределения признака закону нормального с расчетом сравнения групп показателей по критерию Стьюдента (t). При асимметричном распределении рассчитывали медиану (Me), интерквартильный интервал [25%, 75 %], достоверность межгрупповых различий определяли по U-критерию Манна – Уитни. Взаимосвязь признаков оценивали с помощью корреляционного анализа по Спирмену. Минимальный уровень статистической значимости различий верифицировали при р < 0,05. Математическую обработку выполняли на компьютере с применением стандартных пакетов программы Statistica 6.0 (Stat Soft) и программного обеспечения Microsoft Excel.
Результаты исследования и их обсуждение
Результаты наших исследований представлены в табл. 1, из которой видно, что ДХЭ, введенный по указанной схеме, повышает активность свободно радикального окисления в слизистой тонкой кишки. Содержание диеновых конъюгатов гидроперекиси ненасыщенных жирных кислот, являющихся первичными молекулярными продуктами ПОЛ, у крыс опытной группы увеличивается на 93,9 % (p < 0,05) к 30 суткам и несколько снижается на 60 сутки эксперимента. Максимальное накопление МДА наблюдается на 60 сутки эксперимента, увеличиваясь на 70,5 % (p < 0,05). Следует отметить, что высокому содержанию МДА на 60 сутки соответствуют относительно сниженные показатели ДК, что находит свое отражение в коэффициенте МДА/ДК, равном 64,53 ± 4,04 (p < 0,05), по которому в определенной степени можно судить об общей направленности и интенсивности процессов свободно радикального окисления и характеризовать функциональное состояние антиоксидантной системы. Данный показатель свидетельствует об интенсивном переходе первичных в промежуточные и конечные продукты ПОЛ.
Таблица 1
Состояние метаболизма, процессов перекисного окисления липидов и естественной антиоксидантной защиты в слизистой тонкой кишки крыс при хронической интоксикации ДХЭ (M ± m)
|
Исследуемый показатель |
Группы животных (n = 6 в группе) |
Значение показателей на этапах исследования |
||
|
15 сутки |
30 сутки |
60 сутки |
||
|
ДК, (λ = 232) усл.ед. на 1 г ткани |
1-я группа 2-я группа |
2,47 ± 0,20 3,02 ± 0,16 |
2,47 ± 0,20 4,79 ± 0,38* |
2,47 ± 0,20 3,51 ± 0,23* |
|
МДА, мкмоль на 1 г ткани |
1-я группа 2-я группа |
132,8 ± 11,1 139,7 ± 7,75 |
132,8 ± 11,1 180,8 ± 11,26* |
132,8 ± 11,1 226,48 ± 20,74* |
|
СОД, усл.ед. на 1 мг белка |
1-я группа 2-я группа |
18,78 ± 1,14 25,18 ± 1,90* |
18,78 ± 1,14 23,98 ± 0,93* |
18,78 ± 1,14 21,57 ± 1,35 |
|
Каталаза, ммоль в мин на 1 мг белка |
1-я группа 2-я группа |
41,91 ± 3,25 49,61 ± 3,36 |
41,91 ± 3,25 49,06 ± 3,23 |
41,91 ± 3,25 36,81 ± 2,27 |
|
Восстановленный глютатион, мкмоль на 1 г ткани |
1-я группа 2-я группа |
1,03 ± 0,08 0,94 ± 0,08 |
1,03 ± 0,08 0,80 ± 0,09 |
1,03 ± 0,08 0,58 ± 0,06* |
|
Г6ФДГ, мкМоль в мин на 1 г ткани |
1-я группа 2-я группа |
3,12 ± 0,08 2,89 ± 0,11 |
3,12 ± 0,08 2,64 ± 0,07* |
3,12 ± 0,08 2,47 ± 0,07* |
|
Лактат мкмоль на 1 г ткани |
1-я группа 2-я группа |
2,82 ± 0,15 3,66 ± 0,13* |
2,82 ± 0,15 4,05 ± 0,11* |
2,82 ± 0,15 5,9 ± 0,34* |
|
Пируват мкмоль на 1 г ткани |
1-я группа 2-я группа |
0,21 ± 0,012 0,23 ± 0,013 |
0,21 ± 0,012 0,22 ± 0,012 |
0,21 ± 0,012 0,24 ± 0,011 |
|
Коэффициент Лактат/пируват |
1-я группа 2-я группа |
13,88 ± 1,04 16,45 ± 1,48 |
13,88 ± 1,04 19,14 ± 1,58* |
13,88 ± 1,04 24,85 ± 1,22* |
|
Коэффициент МДА/ДК |
1-я группа 2-я группа |
53,65 ± 0,72 47,11 ± 4,68 |
53,65 ± 0,72 38,11 ± 1,31* |
53,65 ± 0,72 64,53 ± 4,04* |
Примечание. * – достоверно (p < 0,05) по сравнению с первой (контрольной) группой.
Важную роль в регуляции процессов ПОЛ играют антиоксидантные ферменты, такие как супероксиддисмутаза (СОД) и каталаза. СОД катализирует реакцию взаимодействия двух супероксидных радикалов, играющих важную роль в инициации свободнорадикального окисления, с образованием перекиси водорода и молекулярного кислорода. Проведенные исследования установили повышение активности СОД в слизистой тонкой кишки на 34,1 % (р < 0,05) и 27,7 % (р < 0,05) соответственно на 15 и 30 сутки, что свидетельствует о мобилизации защитно-приспособительных механизмов, связанных с избыточной продукцией супероксидного анион-радикала. Однако в дальнейшем на фоне применения ДХЭ активность СОД значительно снижается относительно 15 суток исследования. При этом активность каталазы на 15 сутки увеличивается незначительно, а на 60 сутки наблюдается снижение активности фермента ниже контрольных значений на 12,2 % (р > 0,05). Данное обстоятельство может быть связано с повышением концентрации водородных ионов, которые приводят к возникновению протонированной формы фермента, обладающего измененной каталитической активностью.
По мере нарастания интоксикации при введении ДХЭ происходит активное накопление в слизистой тонкой кишки недоокисленных продуктов метаболизма – пирувата и лактата. При этом наиболее интенсивно происходит накопление лактата, уровень которого увеличивается с 2,82 ± 0,15 до 5,9 ± 0,34 мкмоль на гр. ткани (р < 0,05) к 60 суткам эксперимента. Отношение лактат/пируват является отражением интенсивности анаэробного гликолитического пути превращения углеводов. Данный показатель возрастал в 1,79 раз к 60 суткам эксперимента. Полученные результаты свидетельствуют о развитии метаболического ацидоза в слизистой тонкого кишечника при хронической интоксикации ДХЭ, о подавлении аэробного и усилении гликолитического механизма образования энергии, являющегося одним из механизмов адаптации к кислородному голоданию.
В системе неферментативного звена антиоксидантной защиты клетки важная роль принадлежит восстановленному глутатиону. Соотношение окисленных и восстановленных форм глутатиона зависит от скорости реакций пентозного цикла, ключевым ферментом которого является глюкозо-6-фосфатдегидрогеназа (Г6ФДГ). В проведенном исследовании к 30 суткам установлено снижение активности Г6ФДГ на 15,4 % (р < 0,05), а также содержание восстановленного глутатиона на 22,3 % (р > 0,05). Динамика активности Г6ФДГ и содержания восстановленного глутатиона выявило их прогрессирующее снижение к 60 суткам эксперимента. Глутатион участвует как в индуцированной глутатионпероксидазной реакции, так и в поддержании в восстановленном состоянии сульфгидрильных групп белковых молекул, редокс-статуса клетки в целом. При уменьшении содержания восстановленного глутатиона слизистая тонкого кишечника оказывается без защиты от повреждающего действия окислителей.
Сопоставление активности антиоксидантных ферментов с динамикой усиления процесса ПОЛ в слизистой тонкой кишки, а также с показателями, характеризующими метаболизм при хронической интоксикации крыс ДХЭ, выявило их временную последовательность и характер повреждений. Установлен более поздний рост содержания МДА в слизистой тонкой кишки, что может свидетельствовать о вероятной вторичности ПОЛ. Максимальное накопление лактата в слизистой тонкой кишки к 60 суткам эксперимента свидетельствует о том, что в условиях хронической интоксикации ДХЭ изменение активности антиоксидантных ферментов и накопление вторичных продуктов ПОЛ предшествуют подавлению биоэнергетических процессов.
Динамика уровня липополисахарида, кортизола и АКТГ у крыс при введении дихлорэтана представлена на рисунке. Из данных рисунка отчетливо видно, что при длительном введении ДХЭ уровень эндотоксина начинает повышаться с 15 суток с 0,235 [0,182; 0,237] до 0,256 [0,194; 0,295] Ед/мл (р > 0,05). Концентрация эндотоксина в крови в дальнейшем прогрессивно увеличивается до 0,295 [0,251; 0,302] (р = 0,007) и 0,402 [0,337; 0,415] Ед/мл (р = 0,000031) соответственно к 30 и 60 суткам эксперимента.
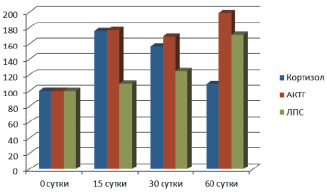
Изменения содержания кортизола, АКТГ и липополисахарида в крови у крыс при хронической интоксикации ДХЭ (n = 6 в каждой группе)
Главным регулятором транслокации эндотоксина из кишечника в системный кровоток считается гипофизарно-надпочечниковая система, активность которой определяет величину сброса крови по порто-кавальным анастомозам [1, 16]. При исследовании гормонов данной системы у крыс при длительном введении ДХЭ было зарегистрировано увеличение АКТГ на 15 сутки с 53,48 ± 6,27 до 94,7 ± 14,5 пг/мл (р < 0,05) с дальнейшим повышением до 106,3 ± 8,47 пг/мл (р < 0,001) к 60 суткам эксперимента. Уровень кортизола в крови был максимальным на 15 сутки, концентрация которого увеличивалась с 110,7 ± 15,2 до 206,0 ± 14,4 нг/мл (р < 0,001). Однако на 60 сутки эксперимента, несмотря на высокое содержание АКТГ, уровень кортизола снижался до 127,4 ± 16,1 нг/мл (р > 0,05), что свидетельствовало о снижении функции надпочечников. Следует отметить, что среди этой группы крыс встречались особи как с низкими показателями кортизола в крови, так и с явно высокими.
Проведенный корреляционный анализ выявил сильную зависимость уровня кортизола от уровня АКТГ на 15 сутки хронической интоксикации ДХЭ (r = 0,94; P = 0,06), на 30 сутки связь между гормонами ослабевала (r = 0,78; P = 0,068), а к 60 суткам наблюдается полное разобщение связи между гормонами (r = –0,33; P = 0,33), что свидетельствует о гормональной дизрегуляции. При исследовании зависимости между уровнем липополисахарида, с одной стороны, и кортизола (маркера стресс-реакции) в сыворотке крови, а также содержанием МДА (маркера выраженности окислительного стресса) и коэффициента лактат/пируват (маркера биоэнергетических процессов) в кишечнике, с другой стороны, выявлены закономерности, которые представлены в табл. 2. Анализ данных свидетельствует, что на 15 сутки хронической интоксикации ДХЭ накопление липополисахарида связано в основном с увеличением концентрации кортизола, способного обеспечить дополнительный сброс портальной крови в общую гемоциркуляцию по шунтам, а на 60 сутки уровень липополисахарида в крови находился в сильной корреляционной зависимости от выраженности окислительного стресса и степени подавления биоэнергетических процессов в слизистой тонкого кишечника, которые в значительной степени способствовали нарушению кишечного барьера.
Таблица 2
Корреляция уровня липополисахарида с концентрацией кортизола в сыворотке крови, содержанием МДА и коэффициентом лактат/пируват в слизистой тонкого кишечника
|
Показатели |
Связь с уровнем липополисахарида (LAL-тест) |
||
|
15-е сутки хронической интоксикации ДХЭ |
30-е сутки хронической интоксикации ДХЭ |
60-е сутки хронической интоксикации ДХЭ |
|
|
Кортизол |
r = 0,871 P = 0,24 |
r = 0,650 P = 0,164 |
r = –0,807 P = 0,052 |
|
МДА |
r = –0,18 P = 0,73 |
r = 0,698 P = 0,123 |
r = 0,918* P = 0,01 |
|
Коэффициент Лактат/пируват |
r = 0,403 P = 0,429 |
r = 0,685 P = 0,133 |
r = 0,892* P = 0,017 |
Примечание. * – достоверная корреляционная связь.
Также необходимо учитывать функциональное состояние печени, регулирующей уровень липополисахарида в крови. Проведенные нами ранее исследования показали, что в условиях хронической интоксикации ДХЭ в печени активируется свободнорадикальное окисление на фоне дисбаланса антиоксидантной системы, которое ведет к нарушению структурно-функциональной организации клеточных мембран [14].
Заключение
Таким образом, проведенные исследования показали, что в условиях длительного введения ДХЭ в слизистой тонкого кишечника развивается окислительный стресс, подавляются биоэнергетические процессы, способствующие развитию гипоксии в стенке кишечника, что ведет к нарушению кишечного барьера и развитию бактериальной транслокации. Полученные нами научные факты свидетельствуют о том, что в условиях хронической интоксикации ДХЭ изменение активности антиоксидантных ферментов и накопление вторичных продуктов ПОЛ предшествуют подавлению биоэнергетических процессов. Данные эксперимента дают основание считать, что прирост концентрации ЛПС в крови в начале интоксикации ДХЭ связан с реакцией напряжения со стороны гипофизарно-надпочечниковой системы, а в дальнейшем зависит от выраженности окислительного стресса в слизистой тонкой кишки.
Рецензенты:
Миннебаев М.М., д.м.н., профессор кафедры патофизиологии, ГБОУ ВПО «Казанский государственный медицинский университет», г. Казань;
Фролов Б.А., д.м.н., профессор, зав. кафедрой патофизиологии, ГБОУ ВПО «Оренбургская государственная медицинская академия», г. Оренбург.
Работа поступила в редакцию 29.12.2014.
Библиографическая ссылка
Срубилин Д.В., Еникеев Д.А. АКТИВАЦИЯ ПРОЦЕССОВ ПЕРЕКИСНОГО ОКИСЛЕНИЯ ЛИПИДОВ В СЛИЗИСТОЙ ТОНКОЙ КИШКИ В МЕХАНИЗМАХ ФОРМИРОВАНИЯ ЭНДОГЕННОЙ ИНТОКСИКАЦИИ ПРИ ДЛИТЕЛЬНОМ ПОСТУПЛЕНИИ ДИХЛОРЭТАНА // Фундаментальные исследования. 2014. № 10-9. С. 1805-1810;URL: https://fundamental-research.ru/ru/article/view?id=36518 (дата обращения: 28.02.2026).



