Курение табака наряду с артериальной гипертонией и дислипидемией входит в тройку лидеров факторов риска, связанных с возникновением хронических неинфекционных заболеваний человека. Курение вносит свой вклад в развитие 71 % случаев рака легких, 42 % хронических болезней легких и 10 % сердечно-сосудистых заболеваний. Наиболее изученным компонентом табачного дыма является никотин, реализующий свои эффекты через никотиновые ацетилхолиновые рецепторы (нАХР). Экспрессия некоторых подтипов нАХР установлена в эндотелиоцитах сосудов и направлена на синтез, транспортировку и метаболизм ацетилхолина [8]. Предполагается, что эндотелиальный пул нАХР обеспечивает участие никотина в ангиогенезе, эффекты которого зависят от продолжительности его воздействия и могут иметь разнонаправленный характер [4]. Помимо никотина прочие компоненты табачного дыма, в частности нитрозамины, фенолы, альдегиды, кетоны, высокоактивные свободные радикалы, способны нарушать клеточную структуру и процессы межклеточного сигналинга за счет усиления процессов апоптоза, стимуляции перекисного окисления липидов в клеточной мембране, поломки нитей ДНК и РНК, нарушения дыхательной митохондриальной цепи [2].
Целью нашего исследования явилось изучение влиянияе табачного дыма на структурную реорганизацию аорты и экспрессию матриксных металлопротеиназ ММР-2 и ММР-9 в её стенке в условиях моделирования хронического табакокурения.
Материалы и методы исследования
Для реализации поставленной цели нами была воспроизведена экспериментальная модель длительного табакокурения in vivo у крыс в соответствии с протоколом H. Zheng и колл. [5]. Материалом исследования послужили 10 крыс-самцов линии Вистар 8-ми недельного возраста, разделенные произвольно на 2 группы. Контрольная группа (4 крысы) дышала атмосферным воздухом, а животных экспериментальной группы (6 крыс) обкуривали табачным дымом в специальной камере для ингаляций в течение 1 часа утром и 1 часа днем ежедневно в течение 6 месяцев. Эксперименты проводились в соответствии с Хельсинской декларацией 1975 года и ее пересмотренным вариант от 2008 года. Через 6 месяцев после ингаляции табачного дыма животных фиксировали и анестезировали путем внутрибрюшинного введения рометара (Xylazinum, «Spora», Praha) в концентрации 5,5 мг/кг. Затем производилась декапитация животных и изготавливались гистологические препараты аорты, часть из которых была окрашена гематоксилином и эозином для изучения архитектоники аортальной стенки. Для оценки локализации и экспрессии матриксных металлопротеиназы-2 (ММP-2) и металлопротеиназы-9 (ММP-9) использовался непрямой иммуногистохимический метод. Была проведена иммунопероксидазная реакция с моно-и поликлональными антителами против MMP-2, МMP-9, а в качестве вторичных антител использованы антитела, меченные пероксидазой хрена. Количественную оценку степени экспрессии MMP-2 и МMP-9 проводили путем измерения суммарной плотности преципитата иммуногистохимической реакции, результат выражали в единицах оптической плотности (ЕОП). Гистологические препараты аорты просматривали в световом микроскопе AxioScope A1 (Carl Zeiss, Германия) и фотографировали при помощи цифрового фотоаппарата AxioCam ICc3 (Carl Zeiss, Германия). Обработку результатов осуществляли с помощью программ Adobe Photoshop 7.0 и Image J. Достоверность различий между группами (при p < 0,05) оценивали с помощью коэффициента Манна ‒ Уитни.
Результаты исследования и их обсуждение
Гистологически стенка аорты состоит из трех слоев: внутренней оболочки (интимы), средней оболочки и адвентиции. Средняя оболочка противостоит давлению в аорте и является самым прочным компонентом аортальной стенки. В норме, согласно концепции ламеллярной единицы средней оболочки аорты, предложенной Wolinsky и Glagov, стенка аорты представлена параллельно расположенными эластическими пластинами и соединяющими их эластическими волокнами, а также коллагеновыми волокнами I и III типов и протеогликанами, заполняющими пространство между пластинами.
Нами обнаружено, что при длительном табакокурении архитектоника стенки аорты имеет выраженное отличие от группы контроля (рис. 1).
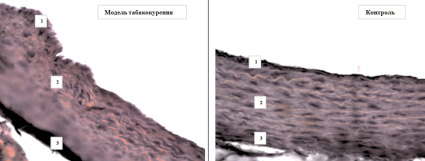
Рис. 1. Реорганизация стенки аорты при табакокурении: 1 – внутренняя оболочка (интима); 2 – средняя оболочка; 3 – адвентиция; окраска гематоксилином и эозином, ув.х20
При этом отмечается утолщение внутренней эластической мембраны, истончение средней оболочки, уменьшение количества рядов гладкомышечных клеток, дезорганизация эластических и коллагеновых волокон в стенке аорты.
Согласно J.L. Ashworth, С. Johnson, S. Oikonomidi одну из ведущих ролей в ремоделировании аорты среди других протеолитических инструментов играют матриксные металлопротеиназы (ММРs). Это единственные протеолитические ферменты, которые способны денатурировать фибриллярные коллагены и поддерживать баланс в составе экстрацеллюлярного матрикса [1, 6, 9].
Нами изучена локализация и экспрессия матриксных металлопротеиназы-2 (ММР-2) и металлопротеиназы-9 (ММР-9) в стенке аорты при длительном воздействии табачного дыма. Данные ММРs относятся к коллагеназам IV типа или желатиназам А и Б, участвующим в деградации эластина. Физиологическая роль MMР-2 заключается в ингибировании процесса ангиогенеза в опухолях. В то же время она вместе с MМР-9 участвует в деградации коллагена IV типа, главного компонента базальных мембран, а также может разрушать другие типы коллагенов (V, VII и X), эластин и фибронектин.
Согласно полученным результатам, комплексы ММР-2 и ММР-9 были локализованы в интиме и медии аортальной стенки, при этом их экспрессия у крыс-курильщиков оказалась достоверно выше, чем в контроле (соответственно 77,42 ± 3,1 ЕОП и 83,61 ± 5,6 ЕОП; в группе контроля 62,13 ± 3,1 ЕОП; при р < 0,05) (рис. 2).
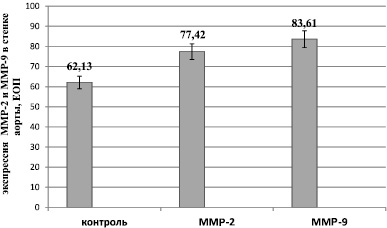
Рис. 2. Экспрессия ММР-2 и ММР-9 в стенке аорты при воздействии табачного дыма
Полученные результаты могут свидетельствовать об участии MMP-2 и ММР-9 в ремоделировании аортальной стенки. Предполагают, что MMP-1,-8,-13,-14 и катепсин K являются ответственными протеазами на первом этапе деградации коллагена, а MMP-2 и ММР-9 ‒ на дальнейших этапах. Creemers и др. продемонстрировали в своих работах, что активность MMP-2 увеличивается одновременно с темпом деградации коллагена [3]. Kerkvliet и др. подтвердили эти результаты и показали, что MMP-2 играет важную роль в разрушении коллагена I, II, IV, V типов [7]. Sung и др. показали, что MMP-9 ответственен приблизительно за 39 % ремоделирования коллагена in vitro в культуре гладкомышечных клеток аорты у мышей [10]. Эти результаты говорят о том, что MMP-2 и ММР-9 ‒ важные регуляторы соединительно тканного матрикса аорты.
Заключение
Очевидно, что курение является одним из триггеров возникновения патологического каскада, запускающего необратимые процессы морфофункциональных изменений сосудистого русла. Полученные нами данные свидетельствуют о дезорганизации архитектоники аортальной стенки, что характеризуется диффузным утолщением интимы, истончением средней оболочки и уменьшением рядов гладкомышечных клеток, изменением экстрацеллюлярного матрикса с повышением содержания и дезорганизацией коллагеновых и эластических волокон. Данные изменения можно связать с увеличенной экспрессией матриксных металлопротеиназы-2 и металлопротеиназы-9.
Рецензенты:
Котельников В.Н., д.м.н., доцент, руководитель учебного военного центра, ГБОУ ВПО «Тихоокеанский государственный медицинский университет» Минздрава России, г. Владивосток;
Калиниченко С.Г., д.м.н., профессор кафедры гистологии, эмбриологии и цитологии ГБОУ ВПО «Тихоокеанский государственный медицинский университет» Минздрава России, г. Владивосток.
Работа поступила в редакцию 29.12.2014.
Библиографическая ссылка
Захарчук Н.В., Невзорова В.А., Гончар Е.Ю. ЭКСПРЕССИЯ МАТРИКСНЫХ МЕТАЛЛОПРОТЕИНАЗ 2 И 9 В СТЕНКЕ АОРТЫ ПРИ ЭКСПЕРИМЕНТАЛЬНОМ МОДЕЛИРОВАНИИ ХРОНИЧЕСКОГО ТАБАКОКУРЕНИЯ // Фундаментальные исследования. 2014. № 10-9. С. 1709-1712;URL: https://fundamental-research.ru/ru/article/view?id=36497 (дата обращения: 28.02.2026).



