До настоящего времени остаются актуальными разработка и внедрение в клиническую практику новых современных диагностических методов, позволяющих выявлять патологические изменения фетоплацентарного комплекса на доклинической стадии заболевания [3, 8]. По данным отечественных авторов фетоплацентарная недостаточность (ФПН) в акушерской практике встречается с частотой от 10 до 24 % [6, 7]. Наиболее ранними проявлениями (еще до заметной задержки развития плода) являются нарушения кровообращения в фетоплацентарном комплексе [7], на разработку методов выявления которой нацелено внимание современных исследователей [1, 2, 9].
На сегодняшний день ведущими методами диагностики плацентарной недостаточности (ПН) являются ультразвуковая биометрия, определение кровотока в сосудах плаценты, определение хорионического гонадотропина и плацентарного лактогена, ретроспективное послеродовое патологоанатомическое исследование последа. Однако диагностика, основанная на клинической оценке данных УЗИ, показателях функционального состояния беременной и признаках морфологической зрелости плода, не позволяет достаточно достоверно и своевременно оценить угрозу плацентарной недостаточности [7, 8].
В связи с этим помимо новейших инструментальных технологий особую актуальность приобретает поиск высокочувствительных иммунохимических маркеров ранней диагностики нарушений фетоплацентарного гомеостаза, к числу которых следует отнести исследование в крови беременных уровня плацентарных белков, в том числе и плацентарной щелочной фосфатазы (ПЩФ) [2, 6, 7, 8, 9].
Цель исследования – оценка значения фермента щелочной фосфатазы и его плацентарного изофермента в диагностике плацентарной недостаточности.
Материалы и методы исследования
У 74 беременных женщин в возрасте от 18 до 35 лет с физиологическим течением периода гестации и у 41 женщины с беременностью, осложненной плацентарной недостаточностью I и II степени, в сроки 10–14, 20–22, 30–32, 39–41 недель гестации комплексно исследована динамика пяти показателей фермента: активность тотальной сывороточной ЩФ, активность и концентрация ПЩФ, их отношение (удельная активность ПЩФ) и отношение ПЩФ/ЩФ.
Клинический материал был собран на базе ГБУЗ АО «Городской клинический родильный дом» г. Астрахани. Все обследованные беременные (115 женщин) на основании оценки особенностей течения беременности и обследования состояния здоровья их 115 новорожденных ретроспективно были разделены на три клинические группы:
1) пациентки с физиологическим течением беременности, условно обозначенные как группа «ФБ» (n = 74);
2) беременные с компенсированной формой ПН, группа «ПН I ст» (n = 28);
3) пациентки с беременностью, осложненной субкомпенсированной формой ПН, группа «ПН II ст» (n = 13).
В качестве контрольной группы использовали 68 образцов сывороток крови женщин-доноров в возрасте от 23 до 50 лет, имевших в анамнезе срочные роды.
Клиническое обследование беременных, плодов и новорожденных осуществлялось с помощью стандартных клинических, лабораторных и биохимических методов, ультразвуковой диагностики, допплерометрии. Диагностика ЗРП до родов основывалась на данных наружного акушерского исследования и фетометрии.
Анализ данных акушерского анамнеза, течения беременности, родов, особенностей течения раннего неонатального периода проведен с использованием обменных карт и историй родов (уч. ф. № 96) и развития новорожденного (уч. ф. № 097/у), протоколов патологоанатомического исследования последов.
Забор крови у беременных для биохимических исследований осуществлялся на базе женской консультации ГБУЗ АО КРД г. Астрахани или в самом родильном доме путем венепункции из локтевой вены.
Сыворотки крови разливались по аликвотам в маркированные пробирки Эппендорфа по 0,5 мл и без добавления консерванта хранились в замороженном виде при –20 °С до момента проведения анализа.
Активность щелочной фосфатазы во всех параллельных образцах нативных и прогретых при 65 °С осветленных центрифугированием сывороток крови (ЩФ и ПЩФ в Е/л) определялась в клинико-диагностической лаборатории Федерального Центра сердечно-сосудистой хирургии (зав. лаб. – к.м.н. Петрова О.В.) на автоматическом биохимическом многоканальном анализаторе «Microlab» с использованием стандартных наборов («Vitalab», Нидерланды) в соответствии с рекомендациями производителя. Для количественного определения плацентарной щелочной фосфатазы (ПЩФ) применяли тест-системы для встречного иммуноэлектрофореза и ИФА, полученные самостоятельно [5]. Антисыворотки к ПЩФ получены нами путем иммунизации и реиммунизации кроликов очищенными антигенами с полным адьювантом Фрейнда по общепринятым схемам [4, 5]. Верификацию моноспецифических тест-систем проводили с референтными наборами на ПЩФ из банка тест-систем кафедры биохимии АГМУ.
Полученные результаты подвергались статистической обработке с вычислением средних величин и их ошибок (М ± m), достоверными считались различия при р < 0,05. В соответствии с критериями ВОЗ для оценки диагностической информативности полученных значений определяли чувствительность и специфичность с помощью ROC-анализа с использованием пакета Deductor Studio Pro версии 5.2. Диагностической эффективность тестов оценивали путем расчета площади под ROC-кривой – AUC (Area Under Curve).
Результаты исследования и их обсуждение
В сыворотках крови женщин доноров общая активность ЩФ составила 98,8 ± 10,65 Е/л, а средняя активность термостабильной фракции ЩФ (то есть ПЩФ), измеренная в этих же образцах сыворотки после прогревания и обнаруживаемая только у 9 из 68 доноров (13,2 %) составила 1,7 ± 0,75 Е/л. Доля ПЩФ от общего пула активности щелочных фосфатаз (отношение ПЩФ/ЩФ) составила в среднем всего 1,0 ± 0,41 %. Средняя концентрация ПЩФ в 68 сыворотках крови доноров, выявленная методом ИФА с чувствительностью 20 нг/мл у 4 из 68 доноров (5,9 %), составила 1,2 ± 0,57 мкг/л, а удельная активность фермента КПЩФ у 9 серопозитивных доноров – 0,54 ± 0,24 Е/мкг.
Динамика изменения всех показателей ЩФ сыворотки крови при физиологической беременности (ФБ) демонстрировала одинаковую тенденцию к плавному нарастанию всех значений с 10–12 к 30–32 неделе гестации и плато до родов (таблица).
При сравнении беременных групп «ФБ» и «ПН» на 10–12 неделях гестации при наличии ПН уровень активности сывороточной ЩФ достоверно выше (на 25–50 %), чем при физиологической беременности, и повышается пропорционально степени ПН, однако в начале 3-го триместра, наоборот, достоверно ниже, чем при ФБ, и снижается пропорционально степени ПН (таблица).
Все остальные показатели ПЩФ у беременных с ПН на 10–12 и 20–22 неделях гестации статистически достоверно не отличались от соответствующего показателя при ФБ (табл. 1). К 30–32 неделе беременности активность ПЩФ, концентрация ПЩФ и отношение ПЩФ/ЩФ снижались максимально по сравнению с группой «ФБ», независимо от степени тяжести ПН (таблица), и сохранялись на низком уровне до родов.
Концентрация и активность ПЩФ в сыворотках крови беременных с различным сроком гестации во взаимосвязи со степенью выраженности ПН
|
Показатель |
Срок гестации, нед. |
ФБ (n = 74) |
ПН I ст (n = 28) |
ПН II ст (n = 13) |
Доноры (n = 68) |
|
ЩФ (Е/л) |
10–12 20–22 30–32 39–41 |
82,9 ± 5,15 120,1 ± 6,69 246,5 ± 11,00 228,2 ± 10,95 |
104,7 ± 8,98* 121,5 ± 9,09 201,5 ± 13,37* 204,5 ± 10,09 |
123,1 ± 11,39* 126,8 ± 9,43 204,3 ± 11,54* 217,4 ± 11,86 |
98,8 ± 10,65 |
|
ПЩФ (Е/л) |
10–12 20–22 30–32 39–41 |
10,7 ± 1,47 33,3 ± 3,22 152,5 ± 9,38 132,6 ± 7,94 |
11,6 ± 1,94 30,8 ± 3,36 85,5 ± 6,25* 94,8 ± 9,23* |
11,9 ± 5,41 29,9 ± 4,26 93,3 ± 9,79* 93,8 ± 12,50* |
1,7 ± 0,75 |
|
ПЩФ (мкг/л) |
10–12 20–22 30–32 39–41 |
12,7 ± 2,23 43,8 ± 4,12 162,2 ± 10,72 150,8 ± 11,19 |
13,6 ± 2,53 38,6 ± 3,70 102,9 ± 8,59* 112,9 ± 11,28* |
15,4 ± 4,02 40,0 ± 6,79 101,5 ± 11,65* 126,2 ± 20,18 |
1,2 ± 0,57 |
|
КПЩФ (Е/мкг) |
10–12 20–22 30–32 39–41 |
0,47 ± 0,06 0,75 ± 0,033 0,96 ± 0,014 0,94 ± 0,020 |
0,61 ± 0,077 0,78 ± 0,034 0,88 ± 0,038* 0,86 ± 0,055 |
0,52 ± 0,104 0,79 ± 0,039 0,97 ± 0,069 0,77 ± 0,039* |
0,54 ± 0,24 |
|
ПЩФ/ЩФ (%) |
10–12 20–22 30–32 39–41 |
10,1 ± 1,23 25,7 ± 1,79 60,1 ± 1,78 57,0 ± 1,43 |
13,7 ± 1,45 26,0 ± 2,40 43,9 ± 2,61* 47,0 ± 4,32* |
14,4 ± 2,17 23,9 ± 3,07 46,0 ± 4,41* 42,5 ± 5,00* |
1,0 ± 0,41 |
Примечание. * – р < 0,05 статистически значимые различия по сравнению с физиологической беременностью соответствующего срока гестации (группа «ФБ»).
Коэффициент удельной активности КПЩФ в сыворотке крови у беременных с ПН был достоверно ниже физиологической нормы только в конце беременности, причем на 30–32-й неделях гестации при ПН I достоверно еще ниже, чем при ПН II (таблица). Таким образом, депрессия ферментативной активности ПЩФ на фоне ФПН связана не только со снижением биосинтеза фосфатазы, но и с угнетением ее активности, что кардинально изменяет тактику медикаментозной коррекции ПН (рекомендуются активаторы и реактиваторы фермента ЩФ, например ионы магния).
Проведенный ROC-анализ показал, что для диагностики ПН на 10–12 неделях гестации наибольшую диагностическую значимость с чувствительностью модели – 76,9 % и специфичностью – 79,3 % имеет повышение уровня ЩФ в крови более 100 Е/л (AUC = 0,802).
На 20–22 неделях гестации из пяти исследованных параметров фосфатазы ROC-анализ не выявил ни одного эффективного диагностического теста для диагностики ПН.
Однако на 30–32 неделях гестации ROC-анализ позволил обнаружить максимальное число высокоинформативных диагностических моделей ПН: тест на ЩФ, на все варианты и отношения ПЩФ. Для всех диагностических моделей р < 0,05.
Самым эффективным (AUC = 0,884) тестом диагностики ПН II в этот срок является выявление в сыворотке крови беременных (рисунок) ПЩФ в концентрации ниже 80 мкг/л (чувствительность модели – 69,2 % и специфичность – 94,6 %), снижение активности ПЩФ ниже 114 Е/л (AUC = 0,803, чувствительность – 85,7 % и специфичность – 71,6 %) и снижение отношения ПЩФ/ЩФ ниже 45 % (AUC = 0,784, чувствительность – 71,4 % и специфичность – 85,1 %).
Перед родами на 39–41 неделях гестации ROC-анализ показал, что в диагностике ПН информативными диагностическими моделями хорошего качества является определение в сыворотке крови у беременных всех вариантов ПЩФ (≤ 84 Е/л, ≤ 80 мкг/л и ≤ 0,78 Е/мкг) и отношения ПЩФ/ЩФ (≤ 37 %).
Таким образом, по повышению сывороточного уровня ЩФ можно прогнозировать наличие ПН на ранних стадиях гестации в конце 1-го триместра, а по пониженному уровню ЩФ, ПЩФ и коэффициентов их отношения между собой в начале 3-го триместра можно достоверно прогнозировать наличие ПН на поздних стадиях беременности.
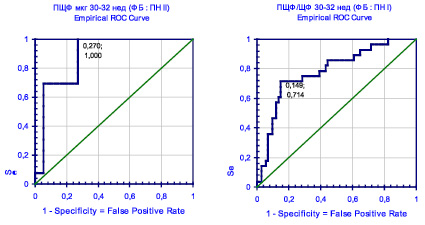
ROC-кривые диагностических моделей высокого качества на 30–32 неделе: ПЩФ для ПН II и отношение ПЩФ/ЩФ для ПН I
Полученные нами результаты указывают на важную роль ПЩФ в становлении фетоплацентарного гомеостаза: несоответствующий сроку гестации уровень биосинтеза ПЩФ в организме матери, а также снижение удельной активности этого фермента отражаются на развитии плаценты и являются факторами формирования ПН.
Выводы
1. В сыворотках крови беременных уровни активности ЩФ, ПЩФ, концентрации ПЩФ и коэффициенты их отношений коррелируют со степенью тяжести ПН. Для каждого параметра определены референтные значения и точки отсечения (cut-off) физиологической беременности от беременности, осложненной ПН.
2. Для доклинической оценки беременности, осложненной ПН, рекомендуется определять коэффициент удельной активности ПЩФ (Е/мкг) и отношение ПЩФ/ЩФ (%). Определение ЩФ, ПЩФ и коэффициентов их отношений повышает эффективность комплексной диагностики ПН и может применяться для контроля ранних негативных изменений фетоплацентарного гомеостаза.
3. Установлено, что депрессия ферментативной активности ПЩФ на фоне ПН объясняется не только снижением биосинтеза фермента в плаценте, но также угнетением энзиматической активности фосфатазы, что следует учитывать при медикаментозной коррекции ПН.
Рецензенты:Николаев А.А., д.м.н., профессор, заведующий кафедрой химии, Астраханский государственный медицинский университет, г. Астрахань;
Тризно Н.Н., д.м.н., профессор, заведующий кафедрой патологической физиологии, Астраханский государственный медицинский университет, г. Астрахань.
Работа поступила в редакцию 25.12.2014.
Библиографическая ссылка
Коханов А.В., Ямпольская И.С., Бисалиева Р.А., Мамиев О.Б., Мяснянкин А.А. ПЯТЬ ПАРАМЕТРОВ ФЕРМЕНТА ЩЕЛОЧНОЙ ФОСФАТАЗЫ В СЫВОРОТКАХ КРОВИ БЕРЕМЕННЫХ ЖЕНЩИН И ИХ ЗНАЧЕНИЕ ДЛЯ ДИАГНОСТИКИ ПЛАЦЕНТАРНОЙ НЕДОСТАТОЧНОСТИ // Фундаментальные исследования. 2014. № 10-8. С. 1509-1513;URL: https://fundamental-research.ru/ru/article/view?id=36347 (дата обращения: 08.02.2026).



