К настоящему времени синтезировано и получило широкое применение значительное количество антиоксидантов (АО). Особые требования предъявляются к ингибиторам окисления, применяемым в медицине, фармации и пищевой промышленности. Перечень нетоксичных, официально разрешенных к использованию антиоксидантов невелик [1, 3]. Ведется поиск перспективных антиоксидантов из числа традиционных лекарственных препаратов с целью расширения спектра их фармакологического действия. В настоящей работе, являющейся продолжением ранее начатых исследований [4], приведены результаты анализа кинетики каталитического окисления субстратов в водно-липидной среде в присутствии аминофенолов в зависимости от концентрации и структуры, без учета спектра их фармакологического действия.
Цель исследования – изучение ингибирующих свойств аминофенолов: адреналина, метилдопы и леводопы в сравнении с реперными антиоксидантами: дибунолом, a-токоферолом и полупродуктом – пирокатехином.
Экспериментальная часть
Антиоксидантную активность соединений (АОА) изучали волюмометрическим методом поглощения кислорода в модифицированной установке типа Варбурга при окислении этилолеата (ЭО) в присутствии 1∙10−3 М цетилтриметиламмоний бромида (ЦТМАБ) в качестве поверхностно-активного вещества (ПАВ), с добавками 2∙10−3 М хлорида меди (II) в пробе при t = (60 ± 0,2) °С, Wi = 6,7∙10-5 М∙с–1. Антиоксиданты добавляли в диапазоне концентраций (1∙10-8–1∙10−1) М. Соотношение липидов и воды составляло 1:3, общий объем пробы 4 мл. Кинетическая модель тестирования антиоксидантов, подбор концентраций катализатора и ПАВ описывается в работе [5]. В качестве критериев оценки антиоксидантных свойств соединений использовали – периоды индукции (t), начальные и максимальные скорости окисления (Wнач, Wmax). Кинетику накопления гидропероксидов изучали при аутоокислении метилолеата (МО) методом обратного йодометрического титрования в среде хлорбензола при t = (60 ± 0,2) °С. Скорость инициирования определяли уравнением
Wi = f[InH]/τi, где f – стехиометрический коэффициент ингибирования, [InH] – концентрация ингибитора (дибунола), τi – период индукции. Комплексы пирокатехина с катионами меди идентифицировали методом УФ-спектроскопии в области 220–450 нм с использованием спектрофотометра «Specord М-40» в стандартных 1 см кварцевых кюветах.
Результаты исследования
и их обсуждение
В присутствии катализатора известны следующие реакции зарождения цепей [2]:
Me(n+1)+ + RH + O2 → Men+ + R● + HO2●;
Me(n+1)+ + RH → Men+ + R● + H+.
Возможно участие катализатора в продолжении цепей:
Men+ + ROOH → Me(n+1)+ + RO● + OH–;
Me(n+1)+ + ROOH → Men+ + RO2● + H+;
Me(n+1)+ + ROOH → Men+ + RO● + OH●.
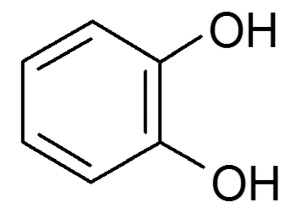
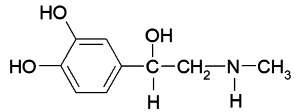
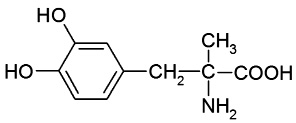
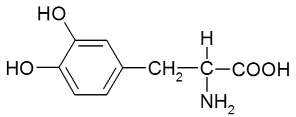
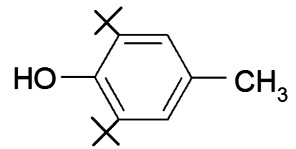
В табл. 1 представлены формулы изучаемых соединений. Адреналин известен как «гормон стресса» и используется в медицине как гипергликемическое, бронхолитическое, гипертензивное, противоаллергическое, сосудосуживающее средство. Препарат метилдопа (3-гидрокси-a-метил-L-тирозин) применяют как гипотензивное средство при разных формах гипертонической болезни. Леводопа (3-гидрокси-L-тирозин) – комбинированный противопаркинсонический препарат, содержащий предшественник дофамина и ингибитор переферической декарбоксилазы ароматических L-аминокислот. По химической структуре соединения адреналин, метилдопа и леводопа относятся к аминофенолам.
Таблица 1
Химические формулы изучаемых антиоксидантов
|
№ п/п |
Название АО |
Формула |
|
I |
Пирокатехин (1,2-дигидрокси-бензол) |
|
|
II |
Адреналин
(1-(3ʹ,4′-дигидроксифенил)- |
|
|
III |
Метилдопа
(2-амино-2-метил-3- |
|
|
IV |
Леводопа (2-амино-3-(3ʹ,4ʹ-дигидрокси)-фенилпропановая кислота) |
|
|
V |
Дибунол (2,6-ди-трет-бутил- |
|
|
VI |
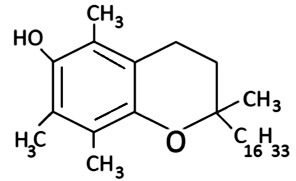
a-Токоферол (6-гидрокси-2,5,7,8-тетраметил-2-фитилхроман) |
|
В соответствии с механизмом окисления аминофенолы могут участвовать в различных элементарных реакциях:
● реакции обрыва цепей, что должно приводить к увеличению периода индукции и уменьшению начальных скоростей процесса пропорционально концентрации:
![]()
● реакции разветвления, продолжения, инициирования цепей, что должно приводить к увеличению скорости процесса, сокращению периода индукции:
In● + RH → R● + InH;
InH + ROOH → In● + RO● + H2O;
● реакции разрушения гидропероксидов по молекулярному механизму, что приведет к уменьшению скорости процесса пропорционально концентрации аминофенола:
ROOH + InH → молекулярные продукты.
В процессе окисления должны конкурировать различные элементарные реакции за счет фенольного гидроксила и аминогруппы, что сказывается на суммарной антиоксидантной активности соединения.
На рис. 1 приведены типичные кинетические кривые (КК) окисления этилолеата в зависимости от концентрации АО. По характеру КК можно разделить соединения на две группы. В первую группу входят пирокатехин, дибунол и a-токоферол. Все добавки этих соединений тормозят процесс окисления: наблюдается период индукции, период аутоускорения и достижения максимальной скорости окисления. Во вторую группу входят аминофенолы: адреналин, метилдопа и леводопа. Наблюдается другой характер КК с добавками соединений: незначительные периоды индукции, снижение начальной и максимальной скоростей окисления в 4–6 раз по сравнению с контролем.
При увеличении концентрации пирокатехина повышается максимальная скорость процесса. Увеличение максимальной скорости процесса окисления (табл. 2) в присутствии пирокатехина, вероятно, связано с участием гидроксильных групп в образовании хелатов с катионами меди (II), при этом снижается их эффективность в процессе ингибирования. Пирокатехин существенно тормозит окисление этилолеата только при концентрациях 1∙10−2 М и выше, когда его соотношение с катализатором составляет 5:1. В этих условиях большая часть пирокатехина не задействована в комплексообразовании и проявляет антиоксидантную активность. Характер КК в присутствии аминофенолов предполагает подавление антиоксидантных свойств фенольного гидроксила за счет образования хелатных комплексов с катионами меди (II) и проявление ингибирующего эффекта только за счет аминогруппы.
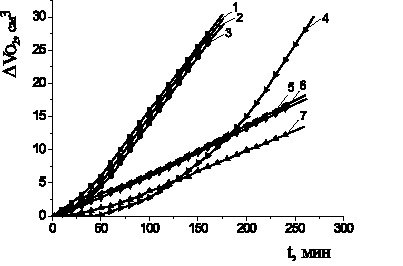
Рис. 1. Кинетика окисления этилолеата в водно-липидной среде
в присутствии добавок антиоксидантов, 1∙10–3 М:
1 – контроль; 2 – a-токоферол; 3 – пирокатехин; 4 – 1∙10–4 М дибунол;
5 – леводопа; 6 – метилдопа; 7 – адреналин; 2∙10−3 М CuCl2 1∙10−3 М ЦТМАБ, t = 60 °С
На рис. 2 представлены спектры оптической плотности пирокатехина в присутствии хлорида меди (II) и ПАВ при длине волны (230–340) нм. Максимум поглощения пирокатехина прослеживается при длине волны 276 нм. Область спектра 240–260 нм характерна для образования хинонов, а полоса 290–320 нм обусловлена образованием комплексных соединений пирокатехина с катионами меди (II) [6, 7].
На рис. 3 показаны зависимости периодов индукции антиоксидантов от их концентраций: наблюдалась экстремальная зависимость с максимумом в 5∙10–4 М для a-токоферола, для пирокатехина периоды индукции возрастали с увеличением концентрации соединения, периоды индукции адреналина, метилдопы и леводопы возрастали до 5∙10–4 М и в дальнейшем не изменялись.
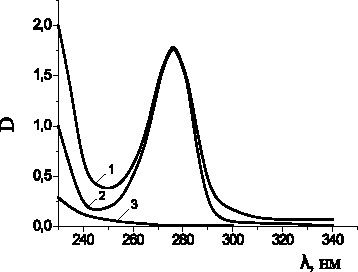
Рис. 2. Спектры оптической плотности смеси: пирокатехин
(5∙10–4 М) + ЦТМАБ (1∙10–3 М) + CuCl2 (2∙10–3 М) (1);
пирокатехин (5∙10–4 М) + ЦТМАБ (1∙10–3 М) (2);
ЦТМАБ (1∙10–3 М) + CuCl2 (2∙10–3 М) (3); растворитель – вода; l = 1 см, t = 20 °С
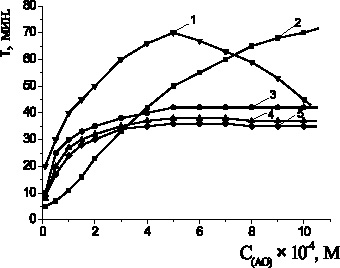
Рис. 3. Зависимости периода индукции от концентрации антиоксидантов:
1 – a-токоферол; 2 – пирокатехин; 3 – адреналин; 4 – метилдопа;
5 – леводопа; 2∙10−3 М CuCl2, 1∙10−3 М ЦТМАБ, t = 60 °С
В работе была проанализирована закономерность изменения максимальной скорости окисления этилолеата с добавками различных концентраций изучаемых АО. Указанные кинетические параметры практически не изменялись с ростом концентрации дибунола и пирокатехина, но существенно уменьшались при введении ингибиторов, содержащих аминогруппу. Для a-токоферола максимальная скорость изменяется экстремально, до концентрации 5∙10-4 М снижалась, свыше 5∙10-4 М резко увеличивалась. Снижение максимальной скорости окисления у аминофенолов (табл. 2) может свидетельствовать об участии соединений в реакциях с гидропероксидами с образованием молекулярных продуктов.
Таблица 2
Кинетические параметры окисления этилолеата в водно-липидной среде в присутствии 2∙10−3 М CuCl2 в зависимости от концентрации АО, Wi = 6,7∙10-5 М∙с–1, t = 60 °С
|
С(АО), М |
τi, мин |
Wнач∙10–5, М∙с–1 |
Wmax∙10–5, М∙с–1 |
Wmax ЭO/Wmax AO |
|
Контроль ЭО |
15 |
7,5 |
14,0 |
– |
|
Пирокатехин |
||||
|
5∙10−5 |
10 |
10,1 |
14,0 |
1,0 |
|
1∙10−4 |
9 |
12,0 |
17,3 |
0,8 |
|
5∙10−4 |
50 |
8,3 |
15,1 |
0,9 |
|
1∙10−3 |
70 |
5,1 |
14,2 |
1,0 |
|
5∙10−3 |
90 |
2,2 |
15,2 |
0,9 |
|
1∙10−2 |
120 |
1,9 |
16,8 |
0,8 |
|
Адреналин |
||||
|
5∙10−5 |
25 |
4,5 |
4,9 |
2,9 |
|
1∙10−4 |
30 |
3,4 |
4,6 |
3,0 |
|
5∙10−4 |
35 |
2,8 |
6,1 |
2,3 |
|
1∙10−3 |
40 |
2,1 |
4,5 |
3,1 |
|
5∙10−3 |
45 |
1,6 |
4,0 |
3,5 |
|
1∙10−2 |
60 |
0,9 |
3,8 |
3,7 |
|
Метилдопа |
||||
|
5∙10−5 |
20 |
7,1 |
9,4 |
1,5 |
|
1∙10−4 |
30 |
6,8 |
8,8 |
1,6 |
|
5∙10−4 |
35 |
3,6 |
6,6 |
2,1 |
|
1∙10−3 |
35 |
3,4 |
5,1 |
2,7 |
|
5∙10−3 |
45 |
1,8 |
2,9 |
4,8 |
|
1∙10−2 |
60 |
0,9 |
2,4 |
5,8 |
|
Леводопа |
||||
|
5∙10−5 |
18 |
7,3 |
9,6 |
1,5 |
|
1∙10−4 |
26 |
7,0 |
9,0 |
1,6 |
|
5∙10−4 |
32 |
3,9 |
6,8 |
2,1 |
|
1∙10−3 |
33 |
3,5 |
5,3 |
2,6 |
|
5∙10−3 |
42 |
1,9 |
3,1 |
4,5 |
|
1∙10−2 |
57 |
0,9 |
2,5 |
5,6 |
|
Дибунол |
||||
|
1∙10−5 |
65 |
7,0 |
12,3 |
1,1 |
|
5∙10−5 |
110 |
2,6 |
9,3 |
1,5 |
|
1∙10−4 |
140 |
2,1 |
8,7 |
1,6 |
|
5∙10−4 |
360 |
1,3 |
8,4 |
1,7 |
|
1∙10−3 |
600 |
1,0 |
8,0 |
1,8 |
|
a-Токоферол |
||||
|
1∙10−5 |
30 |
4,3 |
8,8 |
1,6 |
|
5∙10−5 |
35 |
4,1 |
8,2 |
1,7 |
|
1∙10−4 |
40 |
3,8 |
7,4 |
1,9 |
|
5∙10−4 |
70 |
3,0 |
7,9 |
1,8 |
|
1∙10−3 |
45 |
4,3 |
16,8 |
0,8 |
Для подтверждения гипотезы о возможном разрушении гидропероксидов под действием АО был проведен эксперимент по прямому тестированию кинетики накопления гидропероксидов (ROOH) после введения соединений в частично окисленный субстрат (время эксперимента 8 часов). В течение первого часа наблюдалось снижение концентрации гидропероксидов (рис. 4), в контрольном опыте ROOH продолжали накапливаться. Установлено, что все исследуемые добавки АО способствовали разрушению гидропероксидов
на 50–60 %.
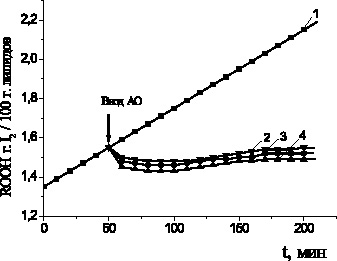
Рис. 4. Кинетика накопления гидропероксидов при аутоокислении метилолеата
в присутствии равных концентраций АО:
1 – контроль; 2 – леводопа; 3 – адреналин; 4 – метилдопа.
Стрелкой показан ввод АО. С(АО) = 2∙10–4 M, t = 60 °C
Полученные данные могут быть методологической основой для разработки синтеза новых высокоэффективных полифункциональных соединений. Экранированная двумя трет-бутильными заместителями фенольная ОН-группа в соединениях должна находиться в пара-положении к заместителю с аминогруппой, что снизит возможность образования хелатных комплексов с катионами металлов переменной валентности, а способность аминогруппы разрушать гидропероксиды молекулярным путем приведет к увеличению периодов индукции.
Выводы
1. Установлено, что синтетический ингибитор окисления дибунол в водно-липидной среде превосходит по своему действию природный антиоксидант a-токоферол.
2. Выявлены слабые антиоксидантные свойства у адреналина, метилдопы и леводопы в водно-липидных катализируемых субстратах, уступающие пирокатехину.
3. Показана возможность адреналина, метилдопы и леводопы снижать максимальную скорость окисления в 4–6 раз по сравнению с контролем.
4. Установлено, что адреналин, метилдопа и леводопа в процессе окисления липидных субстратов разрушают гидропероксиды молекулярным путем, вероятно, за счет аминогруппы на 50–60 %.
Рецензенты:Ерёмин Д.И., д.б.н., профессор кафедры почвоведения и агрохимии, ФГБОУ ВПО «Государственный аграрный университет Северного Зауралья», г. Тюмень;
Грехова И.В., д.б.н., профессор кафедры общей химии, ФГБОУ ВПО «Государственный аграрный университет Северного Зауралья», г. Тюмень.
Работа поступила в редакцию 28.11.2014.
Библиографическая ссылка
Перевозкина М.Г. КАТАЛИТИЧЕСКОЕ ОКИСЛЕНИЕ ЭТИЛОЛЕАТА В ПРИСУТСТВИИ АДРЕНАЛИНА, МЕТИЛДОПЫ И ЛЕВОДОПЫ // Фундаментальные исследования. 2014. № 12-2. С. 289-294;URL: https://fundamental-research.ru/ru/article/view?id=36219 (дата обращения: 31.01.2026).