Гены раннего ответа (ГРО) привлекают пристальное внимание исследователей в силу ряда причин. При действии на клетки различных стимулов они включаются первыми и запускают сложные генные сети, формирующие физиологические реакции клетки. Важной особенностью ГРО является консервативность, которая является отражением их ключевой роли в клеточной регуляции. Существенные нарушения, приводящие к деактивации или гиперэкспрессии этих генов, могут быть причиной различных заболеваний, в частности онкологических, связанных с системными нарушениями на организменном уровне [8].
Ярким представителем генов раннего ответа является ген c-fos, который вместе с белком c-Jun, образует транскрипционный фактор АР-1, играющий важную роль в клеточной регуляции [5]. Показано, что изменение экспрессивной активности c-fos может быть связано с атеросклерозом, воспалением дыхательных путей, ишемической болезнью сердца [3, 10–12].
Для понимания механизмов модификации генной экспрессии активно исследуются полиморфные варианты гена c-fos, их влияние на работу гена и активность кодируемого белка. В базе данных ENSEMBL представлено 6 вариантов SNP, из них по пяти генам проведено исследование в рамках 1000 Genomes [7]. Выявлены три наиболее распространённые однонуклеотидные замены: rs1046117, rs2239615 и rs7101. В настоящее время проводится анализ их распространенности при различных заболеваниях [9].
В настоящей работе представлены результаты исследования распространенности полиморфизмов rs2239615, rs7101 в группах доноров и больных с эндотоксикозом, а также экспрессивной активности гена c-fos с целью выявления механизмов, лежащих в основе хронизации воспалительных заболеваний и развития эндотоксикоза.
Материалы и методы исследования
Работу проводили на образцах ДНК и РНК, выделенных из цельной венозной крови доноров и больных с острым аппендицитом, осложненным перитонитом, у которых зарегистрированы явления эндогенной интоксикации различной степени тяжести. Параметрами формирования выборок и оценки эндотоксикоза являлись общепринятые лабораторно-клинические и биохимические показатели [1].
Выделение ДНК проводили по методу L.-L. Boodram (2004) с модификациями [4]. Анализ полиморфизмов проводили методом PCR-SSCP. Амплификацию проводили согласно следующим параметрам: для полиморфизма rs2239615: 95 °С – 180 с, 30 циклов 60 °С – 10 сек, 95 °С – 10 с (длина продукта 95 п.н.); для полиморфизма rs7101: 95 °С – 180 с, 30 циклов 63 °С – 50 с, 95 °С – 20 с (длина продукта 258 п.н.) с использованием специфических праймеров (rs2239615 F.: 5’-GGC GCC TCG TAC TCC AAC C-3’, R.: 5’-GAG CAC GGT CAC TGC TCG TT-3’ [6]; rs7101 F.: 5’-CGA GCA GTG ACC GTG CTC CT-3’, R.: 5’-GAG TGG TAG TAA GAG AGG CTA T-3’ [14]) («Синтол», Россия).
Для анализа экспрессивной активности использовали метод ОТ-ПЦР. РНК выделяли с помощью набора РНК-Экстран («Синтол», Россия). кДНК была синтезирована из тотальной РНК с использованием праймера Олиго(dT) и MMLV-RT («Синтол», Россия). Амплификацию проводили согласно следующим параметрам: 40 циклов 95 °С – 15 с, 60 °С – 40 с, 72 °С – 40 c с использованием специфических праймеров на кДНК c-fos: F 5´-GGA GGA CCT TAT CTG TGC GTG A-3´, R 5´-GAA CAC ACT ATT GCC AGG AAC ACA-3 [12]. Внутренний контроль проводили с использованием ПЦР реакции на ген AKTB, набором фирмы «Синтол».
Ампликоны, синтезированные для анализа SNP, денатурировали в формамиде в течение 6 мин при 96 °С, резко охлаждали на льду для получения однонитевых фрагментов и разделяли в 10 % полиакриламидном геле, содержащем 0,5×ТБЕ, в присутствии глицерола, при температуре 25 °С. Электрофорез проводили при постоянном напряжении 150 В в течение 8,5 часов для rs7101 и 11 часов для rs2239615. Окраска геля проводилась с помощью бромистого этидия и азотнокислого серебра.
Полученные данные статистически обрабатывали методом вариационной статистики с использованием t-критерия Стьюдента. Популяционно-генетический анализ проводили стандартными методами [2, 13].
Результаты исследования и их обсуждение
Проведенное нами исследование SNP показало наличие всех вариантов генотипов в выборках доноров и больных с эндотоксикозом (таблица).
Частота встречаемости аллелей и генотипов по изучаемым полиморфизмам
|
Выборка |
Ген/полиморфизм |
Частота генотипов, % |
Частота аллелей |
χ2 |
OR аллель (95 %) |
|||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
Доноры (n = 51) |
rs2239615 + 71Т/А |
АА |
АТ |
ТТ |
А |
Т |
0,191 |
0,74 (0,29–1,75) |
|
45,10 (n = 23) |
35,29 (n = 18) |
19,61 (n = 10) |
0,63 |
0,37 |
||||
|
Больные с эндотоксикозом (n = 41) |
51,22 (n = 21) |
36,58 (n = 15) |
12,20 (n = 5) |
0,70 |
0,30 |
0,048 |
||
|
Доноры (n = 51) |
rs7101 + 146 С/Т |
ТТ |
ТС |
СС |
Т |
С |
0,022 |
2,19 (0,82–6,21) |
|
70,59 (n = 36) |
25,49 (n = 13) |
3,92 (n = 2) |
0,83 |
0,17 |
||||
|
Больные с эндотоксикозом (n = 41) |
43,90 (n = 18) |
51,22 (n = 21) |
4,88 (n = 2) |
0,70 |
0,30 |
0,111 |
||
Известно, что полиморфизм rs2239615 (14:g.75745551T > A, с.–135T > A, n.21T > A) обусловлен заменой Т/А в 5´-лидерной области 71 нуклеотида от начала единицы транскрипции. Частоты генотипов и аллелей полиморфизма у доноров и больных с эндотоксикозом представлены в таблице. Ассоциации аллеля Т с предрасположенностью к развитию эндотоксикоза нами не выявлено.
Полученные данные соответствуют результатам исследования 1000 Genomes, в котором было показано, что частоты аллелей полиморфизма rs2239615 в целом по миру составили А – 72 %, Т – 28 %, в европейской популяции – 75 и 25 % соответственно.
Полиморфизм rs7101 гена c-fos обусловлен заменой С/Т в 5´-лидерной области 146 нуклеотида от начала единицы транскрипции (14:g.75745626C > T, c.–60C > T, n.96C > T). В исследуемой группе доноров частоты данных аллелей составили Т – 83 % и С – 17 %, в группе больных с эндотоксикозом – 70 и 30 % соответственно (таблица). Выявлена ассоциация аллеля С с предрасположенностью к развитию эндотоксикоза (OR > 1). Однако в целом частоты встречаемости данного аллеля в группе больных с эндотоксикозом соответствуют данным, полученным в исследовании 1000 Genomes. Выявленные нами различия в частотах аллелей могут отражать наличие популяционных особенностей, а также различий в критериях формирования выборок обследуемых.
Таким образом, полученные нами данные не позволяют с абсолютной уверенностью говорить о вкладе полиморфных вариантов гена c-fos в формирование и развитие эндотоксикоза.
Для поиска механизма участия гена c-fos в возникновении эндотоксикоза нами исследована его экспрессивная активность в норме и при эндотоксикозе. Для реализации данной цели нами был проведен анализ уровня мРНК гена c-fos относительно содержания мРНК гена b-актина (AKTB) по накоплению кДНК фрагментов. В норме ген c-fos экспрессируется в малых и недектируемых количествах, при этом он способен быстро активироваться в ответ на внешние воздействия [8].
В целом анализ крови доноров и больных показал относительное увеличение в эксперименте накопления кДНК гена c-fos в клетках в зависимости от тяжести эндотоксикоза (рисунок).
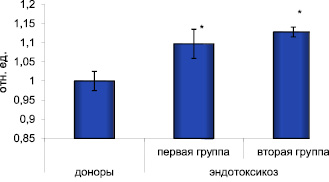
Возрастание относительного содержания кДНК гена c-fos при эндотоксикозе. Примечание: * – достоверность отличия по отношению к уровню в группе доноров при p < 0,01
Так, в группе больных с легкой формой эндотоксикоза (1 группа) содержание кДНК увеличилось в среднем на 9 % относительно контроля и составило 1,097 ± 0,038. При увеличении выраженности эндотоксикоза содержание кДНК возрастало и составляло в среднем 1,128 ± 0,013.
Таким образом, при эндотоксикозе отмечается повышенный уровень экспрессии гена c-fos в клетках крови, что может рассматриваться в качестве одного из механизмов систематизации воспалительного процесса и его хронизации с развитием эндотоксикоза.
Заключение
Эндотоксикоз как следствие воспаления характеризуется глубокими и стабильными нарушениями метаболизма, накоплением продуктов патологического обмена, обладающих токсическим действием и развитием дизрегуляционных процессов в организме. Изучение молекулярных механизмов формирования и развития эндотоксикоза является актуальной задачей биомедицины.
В настоящей работе изучены частоты генотипов и аллелей полиморфизмов гена c-fos у доноров и больных с эндотоксикозом. Нами не выявлено ассоциации полиморфизмов rs7101 и rs2239615 с эндотоксикозом. В то же время показано, что при эндотоксикозе в клетках крови больных отмечается повышенный уровень экспрессивной активности гена по сравнению со здоровыми людьми.
По-видимому, участие гена c-fos в формировании эндотоксикоза как системного заболевания может быть связано с изменением его экспрессируемости, вследствие глубоких биохимических и метаболических изменений в организме, приводящих к нарушению спектра биомолекул, влияющих на работу гена раннего ответа. Изменение экспрессируемости гена c-fos может приводить к изменению уровня экспрессивной активности контролируемых им генов (ngf, DNMT1, NF-kB и других) и изменению активности клеточных процессов, включая регуляцию (или дезрегуляцию) липидного метаболизма, противовоспалительных реакций организма, пролиферативной активности клеток и даже апоптоза, в конечном итоге влияющих на жизнеспособность и функциональную активность клеток.
Рецензенты:Ледяйкина Л.В., д.м.н., доцент, ГБУЗ РМ «Мордовский республиканский клинический перинатальный центр», г. Саранск;
Шубина О.С., д.б.н., профессор, зав. кафедрой биологии, географии и методик обучения, ФГБОУ ВПО «МГПИ им. М.Е. Евсевьева», г. Саранск.
Работа поступила в редакцию 16.12.2014.
Библиографическая ссылка
Трофимов В.А., Лопухова Е.Н., Власов А.П. РАСПРОСТРАНЕННОСТЬ ПОЛИМОРФИЗМОВ ГЕНА c-fos И ЕГО ЭКСПРЕССИВНАЯ АКТИВНОСТЬ В НОРМЕ И ПРИ ЭНДОТОКСИКОЗЕ // Фундаментальные исследования. 2014. № 12-4. С. 770-773;URL: https://fundamental-research.ru/ru/article/view?id=36186 (дата обращения: 14.12.2025).



