Нефриты – это группа заболеваний, характеризующихся поражением почечной ткани, как структурным (воспаление, клеточная пролиферация, утолщение базальной мембраны, фиброз, нарушение структуры эпителиальных клеток), так и функциональным (повышенная проницаемость эндотелия клубочковых капилляров является причиной протеинурии и гематурии клубочкового происхождения, повреждение канальцевого аппарата приводит к прогрессивному нарушению концентрационной функции почек и водно-электролитного баланса).
Несмотря на различные причины и проявления, имеется ряд общих патогенетических механизмов развития нефритов: это воспалительно-пролиферативные изменения в клубочковом аппарате, а также поражение канальцев нефронов. Воспалительные процессы могут быть, как инфекционной этиологии, так и неинфекционной, однако, и в том и другом случае они имеют характер воспалительно-аллергического процесса, с общесистемными изменениями в организме. Образование иммунных комплексов, поражающих почечную ткань, и активизация клеточного иммунитета ведут к усилению воспалительной реакции в почечной ткани, а нарушение почечной гемодинамики, микроциркуляции и реологических свойств крови усугубляет поражение. В связи с этим можно предположить, что хороших результатов лечения можно добиться только при комплексном воздействии на все звенья патогенеза.
На сегодняшний день имеется ряд работ, посвященных изучению эффектов клеточных препаратов на различные формы экспериментальных нефритов, как токсических тубулоинтерстициальных, так и гломерулонефритов. При этом в большинстве работ отмечаются положительные результаты клеточной терапии. В частности, при использовании аллогенных МСК костного мозга показано проникновение их в почечную ткань, восстановление эндотелия капилляров клубочков, нормализация ультраструктуры клеток эпителия канальцев и повышение их пролиферации [3]. Также показан ангиогенный эффект МСК, выражающийся в повышении плотности капилляров после трансплантации клеток [5]. Более того, доказано ингибирование воспалительной реакции, а также усиление протективных эффектов, выражающихся в том числе в активации антиоксидантной системы и секреции цитокинов и ростовых факторов [4]. В целом положительные эффекты МСК выражаются в нормализации функции почек, а именно: в снижении содержания креатинина и мочевины в крови, а также протеинурии.
Однако имеющихся на сегодняшний день знаний оказывается недостаточно для применения клеточных препаратов на основе МСК в клинической практике. Нет достаточных данных о механизмах действия стволовых клеток. Более того, необходимо иметь представление о возможных побочных эффектах клеточной терапии, способах их устранения и профилактики. Также нет четких представлений о наиболее эффективном при данной патологии типе клеток для клеточной терапии, их дозе, сроках и способе трансплантации. В связи с этим необходимо тщательное изучение действия МСК в условиях эксперимента.
Материалы и методы исследования
Работа проводилась на 40 крысах-самцах линии Wistar. Животные содержались в стандартных условиях со свободным доступом к пище и воде.
Модель токсического нефрита воспроизводилась у животных опытной (n = 20) и контрольной (n = 20) групп путем внутримышечного введения 50 % раствора глицерина из расчета 0,8 мл/100 г веса. Внутримышечное введение глицерина приводит к развитию рабдомиолиза, миоглобинурии с токсическим поражением как клубочкового, так и канальцевого аппарата почек.
Опытным животным на 2 сутки после создания модели нефрита вводили внутривенно в бедренную вену 1 мл суспензии, содержащей 1 млн МСК плаценты человека в физиологическом растворе. Контрольным животным аналогичным образом вводили физиологический раствор. Фоновые животные содержались в таких же условиях, что и животные опытных и контрольных групп, однако они были интактны.
Выделение МСК из тканей плаценты человека производили ферментативным способом, как было описано ранее [1]. Для получения клеток использовали фрагмент ткани плаценты после нормальных родов вблизи пупочного канатика. После промывания его раствором Хэнкса (ПанЭко, РФ), содержащим антибиотики, и механического воздействия полученную взвесь инкубировали в 0,1 %-м растворе коллагеназы I типа (Gibco, США) в течение 30 мин при 37 °C. По окончании инкубации суспензию отмывали раствором Хэнкса (5 мин, 300 g). Осадок ресуспендировали в DMEM-F12 (Gibco, США) с добавлением 10 % фетальной телячьей сыворотки (HyClone, США), 100 мкг/мл стрептомицина, 100 U/мл пенициллина, 2 мМ L-глютамина (все – Gibco, США) и суспензию помещали в культуральные флаконы (площадью 75 см2 с фильтром (Greiner, Германия)). Культивирование проводили в СО2инкубаторе со следующими параметрами: 37 °С, 5 % СО2, 80 % влажности. При достижении 80-90 % конфлюентности клетки снимали с пластика раствором трипсина-версена (ПанЭко, РФ) (в соотношении 1:1) и рассаживали в концентрации 2,5∙105 клеток/флакон. Подсчет клеток проводили в камере Горяева.
Исследование функции почек. На 3, 5, 7, 10 и 14 сутки после создания модели токсического нефрита проводились исследования функциональных показателей мочеобразования. Исследования мочеобразовательной функции почек проводили в условиях спонтанного диуреза. Для этого крыс помещали в специальные клетки-воронки, где производился сбор выделенной мочи в течение 6 часов.
В моче и плазме крови забитых крыс спектрофотометрически определяли содержание эндогенного креатинина (по классической методике, основанной на его реакции с пикратом натрия, общего белка в плазме крови (биуретовым методом с помощью диагностического набора Агат), в моче (по Лоури, набор Синтакон), а также мочевины в плазме крови и моче (наборами «Лахема»), как это было описано ранее [2].
В работе использовались классические формулы для расчёта диуреза и скорости клубочковой фильтрации (мл/ч/100 г), канальцевой реабсорбции воды (%), а также экскреции мочевины. Полученные результаты обрабатывались статистически параметрическим методом сравнения средних величин с применением t-критерия Стьюдента. Для построения графиков использовалась программа «GrahpPad Prism 5.03».
Результаты исследования и их обсуждение
Как было показано во многих исследованиях, внутримышечное введение глицерина вызывает миолиз, следствием чего является выброс большого количества свободного миоглобина в кровь. Миоглобин, согласно исследованиям, вызывает токсическое повреждение различных систем и органов, в большей степени – почек, где развивается токсический нефрит.
В нашем исследовании введение глицерина привело к выраженному снижению диуреза уже на 3-й день эксперимента, что, несмотря на достоверное значительное уменьшение канальцевой реабсорбции, было обусловлено практически десятикратным снижением клубочковой ультрафильтрации. В те же сроки (3-й день) у крыс с введением МСК на фоне токсического глицеринового нефрита диурез, напротив, достоверно увеличился, в данном случае за счет снижения канальцевой реабсорбции, при том, что была снижена и клубочковая фильтрация (рис. 1).
Вследствие прогрессивного снижения канальцевой реабсорбции воды и небольшого восстановления скорости клубочковой фильтрации, у контрольных животных к 5-му дню уровень диуреза имел тенденцию к восстановлению. В те же сроки у опытных животных отмечалось менее выраженное снижение клубочковой фильтрации и канальцевой ребсорбции, чем у контрольной группы.
На 7-й день эксперимента у животных контрольной группы (глицерин) отмечено увеличение диуреза относительно величин интактных крыс, это было обусловлено небольшим восстановлением клубочковой фильтрации, которая все же оставалась вдвое ниже, чем у интактных животных, на фоне сниженной канальцевой реабсорбции.
У животных же, которым вводили МСК, на 7-е сутки снижение клубочковой фильтрации и менее выраженное снижение канальцевой реабсорбции также сохраняется, однако в меньшей степени, чем у контрольных животных, что проявилось в небольшом снижении диуреза.
С 10-х на 14-е сутки эксперимента у животных с моделью токсического нефрита отмечена тенденция к восстановлению скорости клубочковой фильтрации, что, однако, сопровождалось значительным снижением канальцевой реабсорбции воды и привело к выраженному, трехкратному, увеличение экскреции воды. При незначительном снижении уровня канальцевой реабсорбции и более прогрессивном нарастании (восстановлении) скорости клубочковой фильтрации, на 14-й день не отмечалось достоверного изменения диуреза у животных опытной группы. Указанные изменения водовыделительной функции почек свидетельствуют о выраженных изменениях в канальцевом аппарате.



Рис. 1. Изменения водовыделительной функции почек у животных опытной и контрольной групп
На выраженность нарушений процессов мочеобразования, как клубочковой ультрафильтрации, так и концентрационной функции канальцевого аппарата почек, также косвенно указывает изменение концентрации креатинина в плазме крови и моче. Так, у контрольных животных практически двукратное уменьшение концентрации креатинина в моче во все сроки, на фоне увеличения его концентрации в плазме крови, является проявлением снижения скорости клубочковой фильтрации, что может быть связано либо со сниженной фильтрационной способностью клубочков нефронов, либо нарушениями в гемодинамике. У животных с терапевтической трансплантацией МСК также отмечается первичное снижение уровня креатинина в моче на 3-й и 5-й день, при меньшем, чем у контрольных животных, увеличении его концентрации в плазме крови. В дальнейшем у опытных животных на 7-й и 10-й день увеличению концентрации метаболита в плазме крови соответствует повышение его концентрации в моче (рис. 2).
Повреждающее действие свободного миоглобина на почки подтверждается явлением протеинурии, с максимумом его экскреции, на фоне измененных процессов мочеобразования, на третий день у опытных животных и на пятый день у контрольных. В последующие дни, соответственно росту диуреза, концентрация белка в моче у животных контрольной группы снижалась, однако его шестичасовая экскреция оставалась повышенной более чем вдвое. У опытных животных экскреция белка была значительно выше фоновых значений только на 3-й день эксперимента, в другие сроки исследования этот показатель приблизительно соответствовал фоновым значениям (рис. 3).
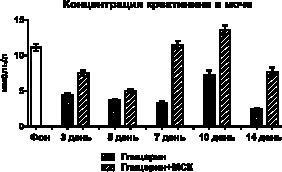
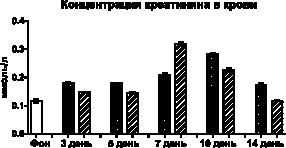
Рис. 2. Изменения концентрации креатинина в крови и моче после внутримышечного введения глицерина и трансплантации МСК
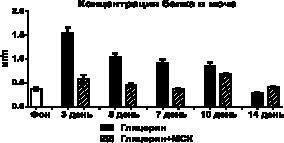
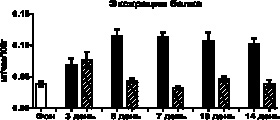
Рис. 3. Изменения концентрации белка в моче и его экскреции после внутримышечного введения глицерина и трансплантации МСК
Выводы
1. Однократное внутримышечное введение 50 % раствора глицерина из расчета 0,8 мл/100 г веса вызывает развитие токсического нефрита с нарушением основных процессов мочеобразования, о чем свидетельствуют выраженные нарушения клубочковой фильтрации и канальцевой реабсорбции.
2. Концентрация креатинина в крови опытных животных на фоне лечения достоверно ниже, а его экскреция с мочой к 14 суткам сравнялась с таковыми значениями у интактных животных, в то время как у контрольных животных на всем протяжении эксперимента наблюдалось повышение уровня креатинина в крови при сниженной его экскреции с мочой.
3. Экскреция белка с мочой уже к 5 суткам достигла нормальных значений у опытных животных, а у контрольных на всем протяжении эксперимента отмечались достоверно высокие значения протеинурии.
4. Трансплантация МСК способствует более быстрому и полному восстановлению мочеобразовательной и мочевыделительной функции почек у животных с острым токсическим нефритом.
Работа выполнена за счет средств Гранта для государственной поддержки научных исследований в Республике Северная Осетия – Алания по договору № 5 от 18.09.14.
Рецензенты:Албегова Ж.К., д.м.н., проректор по УВР, доцент кафедры нормальной физиологии, ГБОУ ВПО «Северо-Осетинская государственная медицинская академия» Министерства здравоохранения Российской Федерации, г. Владикавказ;
Джиоев И.Г., д.м.н., профессор, заведующий ЦНИЛ, ГБОУ ВПО «Северо-Осетинская государственная медицинская академия» Министерства здравоохранения Российской Федерации, г. Владикавказ.
Работа поступила в редакцию 10.12.2014.
Библиографическая ссылка
Цебоева А.А., Кокаев Р.И., Бибаева Л.В., Оганесян Д.Х., Маликиев И.Е., Гуцаева Э.А., Ислаев А.A. ВОЗМОЖНОСТИ ПРИМЕНЕНИЯ КЛЕТОЧНОЙ ТЕРАПИИ НА ФОНЕ ТОКСИЧЕСКОГО НЕФРИТА // Фундаментальные исследования. 2014. № 10-7. С. 1394-1398;URL: https://fundamental-research.ru/ru/article/view?id=36128 (дата обращения: 22.12.2025).



