Процесс отложения биогенного кремнезема (гидратированный кварц (SiO2×nH2O)n) широко распространен в природе как у простейших, так и у многоклеточных организмов [13]. Одним из наиболее ярких представителей животных, формирующих кремниевый скелет, являются губки классов Hexactinellida и Demospongiae. Структурными элементами скелета губок являются спикулы – цилиндрические белково-кварцевые образования видоспецифичной формы, скрепленные аналогом коллагена – спонгином [14]. Основными белковыми компонентами спикул губок класса Demospongiae являются силикатеины [9]. Результаты исследований влияния силикатеинов на процесс полимеризации кремниевой кислоты in vitro, а также разнообразия генов силикатеинов у губок и их дифференциальной экспрессии in vivo позволили выдвинуть гипотезу о ключевой роли этих белков в процессе спикулогенеза [3, 8, 10, 12]. Однако, поскольку интерпретация данных, полученных в экспериментах in vivo, значительно затруднена, а анализ in vitro не позволяет корректно оценить степень участия силикатеинов в формировании спикул в живом организме губки, было принято решение использовать в качестве модели трехмерную клеточную культуру губок – примморф [6]. Примморфы являются промежуточным звеном между единичной клеткой и полноценной губкой и могут служить удобной моделью ex vivo для решения многих проблем физиологии, клеточной и молекулярной биологии [6, 11].
У пресноводной губки Lubomirskia baiсalensis (Demospongiae) к настоящему времени идентифицированы четыре силикатеина альфа и определены последовательности их генов [1]. Кроме того, нами разработаны условия получения и длительного культивирования клеточной культуры примморф ex vivo [4].
Цель работы – оценить влияние индукции силикатом натрия клеточной культуры примморф байкальской губки L. baiсalensis на экспрессию генов силикатеинов в процессе спикулогенеза.
Материалы и методы исследования
Губки L. baiсalensis собирали в ноябре 2013 г. с помощью водолазного снаряжения в оз. Бaйкал на глубинах от 10 до 20 м в районе п. Листвянка и Большие Коты. Образцы губок транспортировали при температуре 3–4 °С. Примморфы получали по ранее разработанной методике [4]. Полученные примморфы культивировали в 24-луночных пластиковых планшетах (Nalge Nunc International) в натуральной байкальской воде (НБВ) и искусственной байкальской воде (ИБВ) при 3–6 °С и естественном световом режиме с доступом кислорода в течение 1 месяца [4]. Затем часть культивированных на ИБВ примморф индуцировали добавлением силиката натрия до конечной концентрации 70 мкМ. После индукции в первый, второй, третий и шестой дни примморфы размером 3–5 мм в диаметре отбирали в количестве 20 штук в 5 повторах для последующей экстракции РНК. В качестве контроля отбирали примморфы, культивированные на НБВ и ИБВ без индукции силикатом натрия. За динамикой образования и ростом кремниевых спикул вели ежедневное прижизненное наблюдение с помощью светового флуоресцентного микроскопа AxioCam MRM (Zeiss, Германия), для детального рассмотрения спикул использовали сканирующий электронный микроскоп SEM 525M (Philips, Holland) по опубликованной методике [5]. Кроме того, ежедневно на предметных слайдах готовили препараты спикул, количество которых определяли с помощью калиброванных окуляров с увеличением 200× с помощью оптического микроскопа (XDS-1B, COIC), просматривая не менее 10 полей зрения, в соответствии с ранее описанными методами [7]. Дополнительно были сделаны снимки с помощью цифрового фотоаппарата Panasonic DMC-FZ3. В ходе данного эксперимента было обработано более 500 штук примморф, размером 2–5 мм в диаметре.
Суммарную РНК из примморф и взрослой губки выделяли с использованием Trizol (Life Science, США), обрабатывали ДНКазой 1, свободной от РНКаз (Thermo Fisher Scientific) и проводили реакцию обратной транскрипции с набором First Strand cDNA Synthesis Kit (Thermo Fisher Scientific) в соответствии с инструкциями производителей. Полученные образцы кДНК использовали в качестве матриц при проведении ПЦР в реальном времени с неспецифической детекцией iQ SYBR Green Supermix (BioRad, USA) на амплификаторе Rotor-Gene 6000 (QIAGEN). Референсными последовательностями в анализе были housekeeping-гены: β-актин (ACTB) и фактор элонгации 1 α (eEF1a1). Пары праймеров для детекции генов силикатеина, ACTB и eEF1a1 разработали на основе ранее опубликованных последовательностей (GenBank: AJ968947; AJ968946; AJ968945; AJ872183) и собственных данных:
Silf 5’AGTCACAGGGTCAGTGTGG / Silr 5’CATCACCACCACTGCAACC;
qActf 5’ACTGGGACGACATGGAGAAG / qActr 5’TGGCTAGGGTGTTGAAGGTC;
qEf1af 5’GCAGCTAATCGTTGGTGTCA / qEf1ar 5’GTAGGTCGGTGCTTCTCTCG.
Они позволяют амплифицировать фрагменты генов силикатеинов, ACTB и eEF1a1 длиной 159, 162 и 188 п.н. соответственно.
Результаты исследования и их обсуждение
Долгоживущая культура примморф губок является важным инструментом в анализе белков и генов, вовлеченных в процесс метаболизма интересующих исследователя соединений. Она позволяет проводить в контролируемых условиях индукцию синтеза мРНК, кодирующих целевые белки, с одновременным контролем морфологических параметров. Объектом настоящего исследования служила культура примморф пресноводной эндемичной байкальской губки L. baicalensis (Porifera, Demospongiae, Lubomirskiidae), являющаяся хорошим модельным объектом для прикладных исследований, в частности изучения метаболизма кремния, благодаря своим культуральным характеристикам.
После диссоциации клеток губки L. baiсalensis в течение первого дня отдельные клетки собирались вместе и формировалась клеточная культура примморф ex vivo. Примморфы образовывали конгломераты неправильной формы с неровной поверхностью, которые постепенно становились сферическими. Через 1–2 дня молодые примморфы имели сферическую форму до 2 мм в диаметре и ровный гладкий эпителий (рис. 1).
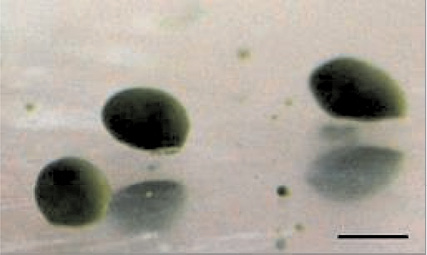
Рис. 1. Культура примморф, полученная из байкальской губки L. baicalensis. Масштаб изображения 1 мм
При культивировании примморф на НБВ отмечен интенсивный рост спикул в течение всего эксперимента. Количество спикул составило 40–50 на 10 полей зрения в каждом образце (рис. 2, A).
С целью получения максимально истощенной по кремнию культуры для изучения индуцированного спикулогенеза часть примморф культивировали на ИБВ в течение месяца. При этом активного образования молодых спикул не отмечали, на 10 полей зрения обнаруживали 2–10 спикул (рис. 2, Б). После добавления силиката натрия на 2 день наблюдали образование и рост ювенильных спикул. На шестой день после индукции на 10 полей зрения определили до 100 и более спикул для каждого образца (рис. 2, В).
Молодые спикулы были тонкими, хрупкими и гладкими, а затем по мере роста на них образовывались шипики. Спикулы в контрольном образце взрослой губки L. baiсalensis незначительно отличались от спикул, образовавшихся в примморфах, они также были изогнуты и покрыты шипиками (рис. 3 А, Б).
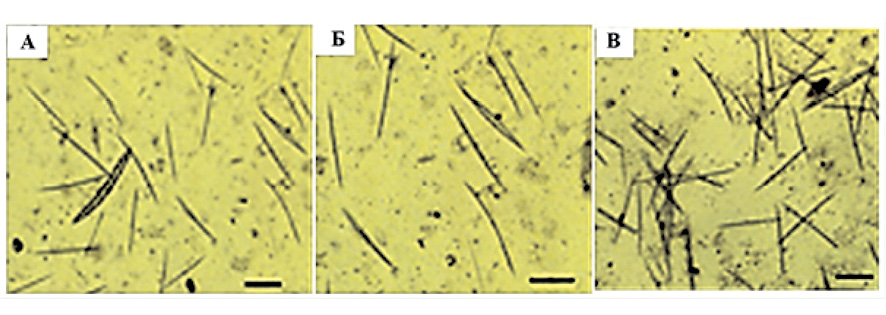
Рис. 2. Световая микроскопия образования кремниевых спикул при культивировании клеточной культуры примморф на 6 день на различных средах: А – образование спикул на НБВ; B – образование спикул на ИБВ; С – образование спикул при индукции силикатом натрия. Масштаб изображения 60 μm

Рис. 3. СЭМ микроскопия кремниевых спикул из взрослой губки L. baiсalensis (А) и примморф после индукции силикатом натрия (Б). Масштаб изображения: 20 μm
Для анализа влияния увеличения концентрации солей кремниевой кислоты на уровень экспрессии генов силикатеинов с помощью PCR в реальном времени использовали образец взрослой губки (контрольный базовый уровень in vivo), образцы культивированных на НБВ примморф (контрольный базовый уровень ex vivo), примморф, культивированных на ИБВ (экспериментальный истощенный уровень ex vivo), и примморф, индуцированных силикатом натрия на первый, второй, третий и шестой дни индукции (экспериментальные уровни индукции ex vivo). Несмотря на то, что интенсивность образования спикул во всех образцах существенно отличалась, различия в количестве специфичной мРНК силикатеинов отмечены не были. Образцы примморф, индуцированных добавлением силиката натрия, не продемонстрировали роста дельта Ct для генов силикатеинов по сравнению с другими образцами на фоне массового развития спикул. Определение уровня экспрессии генов силикатеинов относительно референс-генов актина и фактора элонгации eEF1a1 осуществляли для каждого препарата кДНК по методу дельта дельта Ct. Уровень экспрессии мРНК силикатеинов претерпевал незначительные изменения и составлял 1,7–2 относительных единиц. Такие значения не могут считаться статистически значимыми изменениями в уровне экспрессии, так как лежат в пределах погрешности, что говорит о практически полном отсутствии индукции синтеза мРНК силикатеинов при индукции спикулогенеза силикатом натрия.
Заключение
Таким образом, результаты проведенных экспериментов показали, что уровень экспрессии генов силикатеинов в байкальских губках напрямую не зависит от увеличения концентрации солей кремниевой кислоты, которое стимулирует образование кремнистых спикул. По-видимому, силикатеины непосредственно не связаны с отложением биогенного кремнезема и не принимают активного участия в начальных этапах метаболизма кремния. Можно предположить, что гены силикатеинов активизируются на более поздних стадиях спикулогенеза, а начало процесса контролируют другие белки, которые либо остаются в теле клетки и не детектируются в составе спикул, либо откладываются затем в спикулах в виде комплекса с кремнеземом [2]. Поиск таких белков или других биологически активных соединений, отвечающих за отложение биогенного кремнезема, остается насущ ной задачей.
Работа выполнена в рамках проекта VI.50.1.4 «Молекулярная экология и эволюция живых систем Центральной Азии на примере рыб, губок и ассоциированной с ними микрофлоры», № гос. рег. 01201353444 при частичной финансовой поддержке гранта РФФИ № 13-04-00482.
Рецензенты:Огарков О.Б., д.м.н., зав. лабораторией эпидемически и социально значимых инфекций, ФГБНУ НЦ «Проблем здоровья семьи и репродукции человека» ФАНО, г. Иркутск;
Астафьев В.А., д.м.н., профессор, ведущий научный сотрудник лаборатории эпидемически и социально значимых инфекций, ФГБНУ НЦ «Проблем здоровья семьи и репродукции человека» ФАНО, г. Иркутск.
Работа поступила в редакцию 28.11.2014.
Библиографическая ссылка
Черногор Л.И., Кондратов И.Г., Кулакова Н.В., Деникина Н.Н., Беликов С.И. ЭКСПРЕССИЯ СИЛИКАТЕИНОВ НА МОДЕЛЬНОЙ КЛЕТОЧНОЙ КУЛЬТУРЕ ПРИММОРФ БАЙКАЛЬСКОЙ ГУБКИ LUBOMIRSKIA BAICALENSIS // Фундаментальные исследования. 2014. № 11-11. С. 2455-2459;URL: https://fundamental-research.ru/ru/article/view?id=35965 (дата обращения: 27.02.2026).
DOI: https://doi.org/10.17513/fr.35965



