В структуре онкологической заболеваемости в Якутии рак легкого занимает лидирующие позиции [2]. Острота проблемы обусловлена не только высокой распространенностью заболевания, но и поздней диагностикой [3; 4]. Кроме того, рак легкого характеризуется неудовлетворительными результатами лечения и, как следствие, высокой летальностью.
Рак легкого, как и многие онкологические болезни, является многофакторным заболеванием, в развитии которого важную роль играют как внешнесредовые, так и генетические факторы. Многие исследователи связывают развитие рака с мутациями (полиморфизмом) в генах, кодирующих ферменты биотрансформации ксенобиотиков [18].
Глутатион-S-трансферазы (GST) – большая группа ферментов, которая подразделяется на 4 класса: α, μ, π, θ; они вовлечены во вторую фазу биотрансформации эндогенных и экзогенных ксенобиотиков. Глутатион-S-трансферазы обладают широкой субстратной специфичностью, метаболизируя многие субстраты. Ферменты детоксикации имеют широкий изоферментный спектр, что определяется полиморфизмом кодирующих их генов. Различия в составе изоэнзимов приводят к разной способности метаболизма чужеродных веществ у различных людей, что может обуславливать неодинаковую степень предрасположенности к заболеваниям, развитие которых тесно связано с факторами внешней среды.
Полиморфизм в гене GSTM1, кодирующего фермент глутатион-S-трансферазу класса μ, характеризуется делецией по обеим аллелям, которая приводит к полному отсутствию синтеза белкового продукта, результатом чего является глубокое подавление функции фермента. По литературным сведениям имеются противоречивые данные относительно ассоциации ноль-генотипа GSTM1 с риском возникновения рака легкого. Так же, как в случае с GSTM1, обширная делеция в структурной части гена GSTT1 ассоциируется с низкой эффективностью детоксикации потенциальных канцерогенов, что может быть связано с широкой предрасположенностью к раку [1].
Целью настоящей работы являлось изучение полиморфных вариантов генов ферментов 2-ой фазы детоксикации ксенобиотиков – GSTT1 и GSTM1 у больных раком легкого.
Материалы и методы исследования
Молекулярно-генетические и клинико-биохимические исследования проведены у 36 человек якутской национальности больных раком легкого, поступивших в Якутский республиканский онкологический диспансер. Контрольная группа была подобрана с учетом возраста, этнической принадлежности и включала 65 человек. Основным критерием отбора в контрольную группу было отсутствие онкологических заболеваний.
Для выделения ДНК использовался стандартный метод фенольно-хлороформной экстракции [9]. Анализ полиморфных вариантов специфических участков генов GSTM1, GSTT1, CYP1A1 проводили с использованием метода полимеразной цепной реакции, используя структуру праймеров описанных ранее [8; 13; 21].
Результаты ПЦР анализировали электрофоретически в 7 % полиакриламидном геле с добавлением бромистого этидия (0,5 мкг/мл) и визуализацией в проходящем УФ-свете. Гомозиготы по «нулевым» аллелям генов GSTM1 (GSTM(0/0)) и GSTT1 (GSTT(0/0)) выделялись по отсутствию соответствующих фрагментов 271 и 480 п.н. при электрофорезе. Наличие этих фрагментов свидетельствовало о присутствии, по крайней мере одной нормальной (без делеции) копии генов гомозиготы (GSTM(+/+); GSTT(+/+)) и гетерозиготы (GSTM(0/+); GSTT(0/+)) (рис. 1, 2). Участок гена CYP1A1 размером 183 п.н. использовали в качестве внутреннего контроля амплификации.
Биохимические показатели: активность аланин-аминотрансферазы (АЛТ), аспартат-аминотрансферазы (АСТ), γ-глутамилтрансферазы (γ-ГТ) определяли на биохимическом автоматическом анализаторе Cobas mira plus (La Roche Ltd).
Статистическую обработку полученных данных проводили с помощью пакета прикладных статистических программ SPSS for Windows 10.0. Применяли стандартные методы вариационной статистики: вычисление средних величин, стандартных ошибок, 95 % доверительного интервала. Достоверность различий между средними значениями оценивали с помощью критерия t Стьюдента для независимых выборок. Данные в таблицах представлены в виде M ± m, где M – средняя, m – ошибка средней. Вероятность справедливости нулевой гипотезы принимали при p < 0,05.
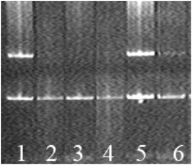
Рис. 1. Пример идентификации 0/0 и +/+ генотипов по гену GSTT1; CYP1A1 – внутренний контроль ПЦР (183 п.н.); 2, 3, 4, 6 – «0/0» генотип; 1, 5 – «+/+» генотип
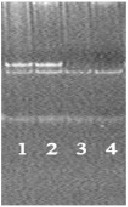
Рис. 2. Пример идентификации 0/0 и +/+ генотипа по гену GSTM1; CYP1A1 – внутренний контроль ПЦР (183 п.н.); (3, 4 – «0/0» генотип; 1, 2 – «+/+» генотип)
При сравнении частот генотипов использовался стандартный критерий χ2. Относительный риск (OR) развития заболевания при определенном генотипе рассчитывался по стандартной формуле
OR = a/b∙d/c,
где a и b – количество больных, имеющих и не имеющих мутантный генотип соответственно и d, c – количество человек в контрольной группе, имеющие и не имеющие мутантный генотип. OR указан с 95 %-м доверительным интервалом.
Результаты исследований и их обсуждение
Согласно полученным нами данным в исследуемых выборках у больных раком легкого и в контроле обнаружено, что частота встречаемости «нулевого» генотипа GSTM1(0/0) в группе больных выше (66,6 %), чем у здоровых индивидов (43,0 %), различия достигли уровня статистической значимости – χ2 = 5,16, р = 0,023. Относительный риск развития рака легкого при носительстве нулевого генотипа повышен в 2,6 раза (OR 2,64 (CI 95 %: 1,04 – 6,77)) (табл. 1).
Проведенный анализ делеционного полиморфизма гена GSTT1 значимых отличий в распределении частот генотипов в зависимости от онкопатологии не выявил.
Таблица 1
Частота нулевых (0/0) и ненулевых (+ / +) генотипов GSTT1, GSTM1 у больных раком легкого и здоровых
|
Ген |
Генотип |
Больные раком легкого |
Контрольная группа |
|
|
GSTT1 |
0/0 |
N |
15 |
21 |
|
% |
41,7 |
32,3 |
||
|
χ2(p); OR |
5,16 (0,023) 0,38 (0,15–0,96) |
|||
|
+/+ |
N |
21 |
44 |
|
|
% |
58,3 |
67,7 |
||
|
χ2(p); OR |
5,16 (0,023) 2,64 (1,04–6,77) |
|||
|
GSTM1 |
0/0 |
N |
24 |
28 |
|
% |
66,6 |
43 |
||
|
χ2(p); OR |
0,88 (0,347) 0,67 (0,26–1,69) |
|||
|
+/+ |
N |
12 |
37 |
|
|
% |
33,4 |
57 |
||
|
χ2(p); OR |
0,88 (0,347) 1,50 (0,59–3,78) |
|||
Примечание. р – достигнутый уровень значимости для χ2 соответственно для сравнения выборок больных раком легкого со здоровыми.
В обследование больных раком легкого входило определение биохимических показателей (АЛТ, АСТ, ГГТ), позволяющих судить о функциональном состоянии печени. Активность учитываемых нами ферментов у больных раком легкого была выше по сравнению с контролем. Активность АЛТ в крови больных была больше в 1,2 раза (11,50 ± 0,51 МЕ), АСТ в 1,1 раза (26,27 ± 0,89 МЕ), а ГГТ в 1,5 раза (54,72 ± 2,01 МЕ) по сравнению с контрольной группой.
Анализ зависимости активности АЛТ, АСТ и γ-ГТ от комбинации генотипов GSTT1 и GSTM1 у пациентов выявил общую закономерность: носители комбинации GSTT1(+/+)/GSTM1(+/+) имели наиболее низкие значения этого показателя, у обладателей хотя бы одного мутантного гена (комбинации генотипов GSTT1(0/0)/GSTM1(+/+) или GSTT1(+/+)/GSTM1(0/0)) активность АЛТ была повышена, а у пациентов с наличием мутации в обоих генах (комбинация генотипов GSTT1(0/0)/GSTM1(0/0)) наблюдался самый высокий уровень активности ферментов (табл. 2).
Таблица 2
Средние значения активности АЛТ, АСТ и γ-ГТ в сыворотке крови у пациентов с раком легкого с различными комбинациями генотипов GSTM1/GSTТ1
|
Комбинации генотипов |
γ-ГТ |
АЛТ |
АСТ |
|
GSTT1(+/+)GSTM1(+/+) |
37,01 ± 3,23 |
9,30 ± 3,21 |
31,00 ± 4,02 |
|
GSTT1(0/0)GSTM1(+ / +) |
64,12 ± 5,20** |
9,60 ± 2,14 |
32,12 ± 4,21 |
|
GSTT1(+/+)GSTM1(0/0) |
57,02 ± 7,51* |
12,01 ± 3,05* |
40,00 ± 3,54 |
|
GSTT1(0/0)GSTM1(0/0) |
107,40 ± 23,54* |
18,20 ± 4,02* |
38,80 ± 5,89* |
Примечание. * p < 0,01 (при сравнении GSTT1(+/+)GSTM1(+/+) и GSTT1(0/0)GSTM1(0/0)); **p < 0,01 (при сравнении GSTT1(+/+)GSTM1(+/+) и GSTT1(+/+)GSTM1(0/0)).
Согласно литературным данным, гены GST, особенно GSTM1, вовлечены в патогенез различных раков и выступают в качестве модификаторов и факторов риска при самых различных заболеваниях, связанных с неблагоприятным действием факторов внешней среды.
Ранее установлено, что полиморфизм GST-генов ассоциируется с развитием многочисленных злокачественных опухолей: рака легкого [11; 15; 16], мочевого пузыря [10; 12], прямой кишки [17], желудка [20], пищевода [5], груди [14], яичников и кожи [19]. Есть работы, показывающие связь полиморфизма генов, кодирующих ферменты 2-й фазы детоксикации, с хроническими и наследственными заболеваниями: хроническим бронхитом, бронхиальной астмой [6; 7]. Кроме того, показано, что делеция генов GSTM1 и GSTT1 приводит к повышенной чувствительности к ксенобиотикам (в частности, к продуктам термического разложения табака). Полученные нами данные подтверждают, что у якутов делеционный полиморфизм гена GSTM1 достоверно ассоциирует с развитием рака легкого.
Заключение
В нашей работе впервые показано, что повышенный риск развития рака легкого в якутской популяции может быть связан с нулевым генотипом гена GSTМ1. При этом нами впервые обнаружена взаимосвязь между делеционными генотипами генов GSTM1, GSTT1 и активностью ферментов АЛТ, АСТ и γ-ГТ. В организме больных с генотипом GSTT1(0/0)GSTM1(0/0) отмечена достоверно высокая активность указанных выше ферментов. Вероятно, высвобождение АЛТ, АСТ и γ-ГТ в кровь происходит в результате повышения токсичных (канцерогенных) веществ в организме, которые накапливаются в результате отсутствия ферментативной активности GSTM1 и GSTT1.
Рецензенты:
Сазонов Н.Н., д.б.н., доцент, профессор кафедры биохимии и биотехнологии биолого-географического факультета, ФГАОУ ВПО «Северо-Восточный федеральный университет им. М.К. Аммосова», г. Якутск;
Иванов П.М., д.м.н., профессор медицинского института, ФГАОУ ВПО «Северо-Восточный федеральный университет им. М.К. Аммосова», г. Якутск.
Работа поступила в редакцию 18.11.2014
Библиографическая ссылка
Николаев В.М., Николаев В.М., Иванова Ф.Г., Чирикова Н.К., Александрова Е.Н., Григорьева Л.В., Хуснутдинова Э.К., Федорова С.А., Федорова С.А. ИЗУЧЕНИЕ ПОЛИМОРФИЗМА ГЕНОВ GSTT1 И GSTM1 У БОЛЬНЫХ РАКОМ ЛЕГКОГО В РЕСПУБЛИКЕ САХА (ЯКУТИЯ) // Фундаментальные исследования. 2014. № 11-9. С. 1949-1953;URL: https://fundamental-research.ru/ru/article/view?id=35875 (дата обращения: 11.03.2026).



