Увеличение продолжительности жизни в развитых странах мира и связанное с этим повышение доли лиц пожилого возраста ведет к тому, что среди различных форм патологий доминирующее положение начинают занимать нейродегенеративные заболевания. Наиболее распространенной формой этих заболеваний является болезнь Альцгеймера (БА). К настоящему времени число людей с БА составляет около 20 млн человек во всем мире, что наносит экономический ущерб, оцениваемый в 100 миллиардов долларов ежегодно [5]. Для лечения БА используется крайне ограниченное число препаратов, причем ни один из них не позволяет полностью остановить патологический процесс. Поэтому поиск высокоэффективных средств для лечения БА, обладающих оптимальным соотношением нейропротекторных и когнитивностимулирующих свойств, рассматривается в качестве одного из перспективных направлений современной медицинской химии и фармакологии. Анализ литературных данных показывает, что производные тетрагидро-γ-карболинов являются перспективными соединениями в качестве препаратов нового поколения для лечения различных нейродегенеративных заболеваний, в том числе и БА [3].
В последние годы пристальное внимание привлекают нейропротекторные свойства известного антигистаминного препарата Димебон 1 (рис. 1) [1].
Как следствие, модификация структуры Димебона является весьма перспективной в плане создания новых биологически активных соединений с большим терапевтическим потенциалом. Мы предлагаем в качестве такой модификации замену пиридинового цикла в молекуле Димебона на оксадиазольный фрагмент.
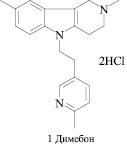
Рис. 1
Результаты исследования и их обсуждение
Предлагаемая нами схема синтеза целевых оксадиазольных производных тетрагидро-g-карболинов включает три стадии (рис. 2). Исходные тетрагидро-g-карболины (2) получали реакцией Фишера из соответствующих фенилгидразинов и 1-метил-4-пиперидона [4]. Тетрагидро-g-карболины (2) присоединяли по реакции Михаэля к акрилонитрилу в присутствии каталитических количеств тритона Б. В результате образуются 3-(2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индол-5-ил)-пропионитрилы (3a–e). В этой реакции нами использовался двукратный избыток акрилонитрила в отличие от более ранней работы, где акрилонитрил использовали в качестве растворителя [2]. Кипячение полученных пропионитрилов (3a–e) с гидроксиламином в этаноле приводит к N-гидрокси-3-(2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индол-5-ил)пропионамидинам (4a–e). Последние конденсировали с этилбензоатом в кипящем этаноле в присутствии этилата натрия с образованием 2-метил-5-[2-(5-фенил[1,2,4]оксадиазол-3-ил)этил]-2,3,4,5-тетрагидро-1H-пиридо-[4,3-b]индолов (5a–e). При использовании в реакции эквимолярных количеств реагентов выходы составляют не более 50 %. Избыток этилбензоата и этилата натрия (15–70 %) позволяет повысить выход целевых соединений до 60–67 %.
Таким образом, авторами разработан подход к синтезу неописанных ранее в литературе оксадиазольных производных тетрагидро-g-карболина – аналогов известного препарата Димебон, что позволяет расширить номенклатуру соединений при поиске новых высокоэффективных препаратов для терапии различных нейродегенеративных заболеваний.
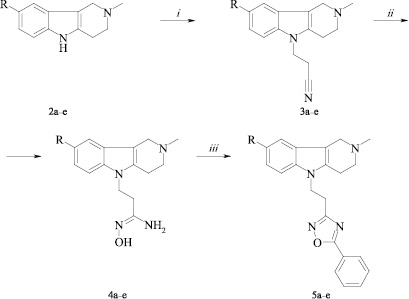
Рис. 2
Экспериментальная часть
Спектры ЯМР 1H записывали на приборе «BrukerCXP-200» при частоте 200,13 МГц относительно SiMe4 (внутренний эталон). Температуры плавления определяли на нагревательном столике Боётиуса без коррекции. Упаривание растворов проводили на роторном испарителе в вакууме водоструйного насоса. Колоночную хроматографию осуществляли с использованием силикагеля L (Chemapol, Чехия), ход разделения контролировали с помощью ТСХ. ТСХ выполняли на пластинках Silufol UV 254 (Kavalier, ЧССР), обнаружение йодом.
N_Гидрокси_3_(2_метил_2,3,4,5_тетрагидро-1H-пиридо[4,3_b]индол-5-ил)-пропионамидин (4a). К раствору 1,86 г (10 ммоль) γ-карболина 2a и 1,33 мл (1,06 г, 20 ммоль) акрилонитрила в 5 мл ДМФА при перемешивании и охлаждении прибавляли по каплям 100 мкл тритона Б и перемешивали 16 ч при комнатной температуре. Реакционную смесь разбавляли водой (20 мл) и экстрагировали этилацетатом (3×10 мл). Объединенный органический экстракт промывали водой, насыщенным водным раствором NaCl, высушивали над безводным Na2SO4. Осушитель отфильтровывали, фильтрат упаривали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, элюент: этилацетат - триэтиламин, 9:1. Получали 1,89 г 3-(2-метил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индол-5-ил)-пропионитрила 3а, выход 79 %.
В 3 мл воды растворяли 0,7 г (10 ммоль) NH2OH·HCl и 0,4 г (10 ммоль) NaOH и разбавляли 15 мл этанола. К полученному раствору добавляли 1,2 г (5 ммоль) пропионитрила 3a и кипятили 6 ч. Реакционную смесь разбавляли водой (15 мл). Выпавший осадок отфильтровывали, промывали водой, этанолом, эфиром. Получали 0,99 г пропионамидина 4a, выход 72 %. Бесцветные кристаллы, Тпл 218-219,5 °С (MeOH, разл.). Найдено (%): С, 66,03; H, 7,26; N, 20,71, C15H20N4O. Вычислено (%): C, 66,15; H, 7,40; N, 20,57; O, 5,87, 1H NMR (DMSO_d6, δ, м.д.): 2,31 (2H, т, J = 7,6 Гц, CH2), 2,41 (3H, c, СН3), 2,77 (4H, м, 2×CH2), 3,50 (2H, c, CH2), 4,23 (2H, т, J = 7,6 Гц, CH2), 5,56 (2H, c, NH2), 7,01 (2H, м, Hаром), 7,32 (1H, д, J = 7,3 Гц, Hаром), 7,42 (1H, д, J = 7,9 Гц, Hаром), 8,87 (1H, с, NOH).
N-Гидрокси-3-(2,8-диметил-2,3,4,5-тетрагидро-1H-пиридо[4,3-]индол-5-ил)-пропионамидин (4b). Синтезирован аналогично пропионамидину 4a из 1,26 г (5 ммоль) пропионитрила 3b. Получено 1,07 г пропионамидина 4b, выход 75 %. Бесцветные кристаллы, Тпл 218-220 °С (MeOH, разл.). Найдено (%): С, 67,30; H 7,63; N, 19,41, C16H22N4O. Вычислено (%): C, 67,11; H, 7,74; N, 19,56, O, 5,59, 1H NMR (DMSO_d6, δ, м.д.): 2,31 (8H, м, 2×CH3, CH2), 2,75 (4H, м, 2×CH2), 3,46 (2H, c, CH2), 4,18 (2H, т, J = 7,1 Гц, CH2), 5,54 (2H, c, NH2), 6,88 (1H, д, J = 8,3 Гц, 7_Hаром), 7,10 (c, 1H, 9_Hаром), 7,29 (д, 1H, J = 8,3 Гц, 6_Hаром), 8,86 (с, 1H, NOH).
N-Гидрокси-3-(2-метил-8-метокси-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индол-5-ил)-пропионамидин (4c). Синтезирован аналогично пропионамидину 4a из 1,35 г (5 ммоль) пропионитрила 3c. Получено 0,98 г пропионамидина 4с, выход 65 %. Бесцветные кристаллы, Тпл 211-213 °С (MeOH, разл.). Найдено (%): С, 63,38; H 7,21; N, 18,68, C16H22N4O2, Вычислено (%): C, 63,56; H, 7,33; N, 18,53; O, 10,58, 1H NMR (DMSO_d6, δ, м.д.): 2,28 (2H, т, J = 6,9 Гц, CH2), 2,41(3H, c, СН3), 2,74 (4H, м, 2×CH2), 3,46 (2H, c, CH2), 3,73 (3H, c, СН3O), 4,17 (2H, т, J = 6,9 Гц, CH2), 5,55 (2H, c, NH2), 6,69 (1H, д, J = 8,8 Гц, 7_Hаром), 6,83 (1H, c, 9_Hаром), 7,31 (1H, д, J = 8,8, 6_Hаром), 8,86 (1H, с, NOH).
N-Гидрокси-3-(2-метил-8_фтор-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индол-5-ил)-пропионамидин (4d). Синтезирован аналогично пропионамидину 4a из 1,29 г (5 ммоль) пропионитрила 3d. Получено 1,03 г пропионамидина 4d, выход 71 %. Бесцветные кристаллы, Тпл 222-224°С (MeOH, разл.). Найдено (%): С, 61,86; H, 6,49; F, 6,67; N, 19,46, C15H19FN4O. Вычислено (%): C, 62,05; H, 6,60; F, 6,54; N, 19,30; O, 5,51, 1H NMR (DMSO_d6, δ, м.д.): 2,31 (2H, т, J = 7,2 Гц, CH2), 2,41 (3H, c, СН3), 2,75 (4H, м, 2×CH2), 3,46 (2H, c, CH2), 4,22 (2H, т, J = 7,2 Гц, CH2), 5,54 (2H, c, NH2), 6,88 (1H, ддд, JHF = 9,8 Гц, JHH = 9,2 Гц, JHH = 2,4 Гц, 7_Hаром), 7,09 (1H, дд, JHF = 9,8 Гц, JHH = 2,4 Гц, 9_Hаром), 7,42 (1H, дд, JHH = 9,2 Гц, JHF = 4,4 Гц, 6_Hаром), 8,85 (1H, с, NOH).
N-Гидрокси-3- (2-метил-8_хлор-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индол-5-ил)-пропионамидин (4e). Синтезирован аналогично пропионамидину 4a из 1,37 г (5 ммоль) пропионитрила 3e. Получено 1,04 г пропионамидина 4е, выход 68 %. Бесцветные кристаллы, Тпл 222-224 °С (MeOH, разл.). Найдено (%): С, 58,56; H, 6,11; Cl, 11,49; N, 18,38, C15H19ClN4O. Вычислено (%): C, 58,73; H, 6,24; Cl, 11,56, N, 18,26; O, 5,21, 1H NMR (DMSO_d6, δ, м.д.): 2,31 (2H, т, J = 7,0 Гц, CH2), 2,41 (3H, c, СН3), 2,76 (4H, м, 2×CH2), 3,47 (2H, c, CH2), 4,23 (2H, т, J = 7,0 Гц, CH2), 5,55 (2H, c, NH2), 7,04 (1H, дд, J = 8,5, 2 Гц, 7_Hаром), 7,36 (1H, д, J = 2 Гц, 9_Hаром), 7,46 (1H, д, J = 8,5 Гц, 6_Hаром), 8,85 (1H, с, NOH).
2-Метил-5-[2-(5-фенил[1,2,4]оксадиазол-3_ил)этил]-2,3,4,5-тетрагидро-1H-пиридо-[4,3-b]индол (5а). В 15 мл абсолютного EtOH растворяли 0,102 г (0,0044 г-атом) Nа. К полученному раствору этилата натрия прибавляли 1,206 г (4,4 ммоль) N-гидрокси-3-(2-метил-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индол-5-ил)пропионамидина 4a и 0,72 мл (0,761 г, 5,1 ммоль) этилбензоата. Реакционную смесь кипятили 14 ч и упаривали в вакууме. Остаток заливали водой и этилацетатом. Нерастворившийся осадок непрореагировавшего пропионамидина 4a отфильтровывали, органический слой отделяли, промывали водой, насыщенным водным раствором NaCl, высушивали над безводным Na2SO4, Осушитель отфильтровывали, фильтрат упаривали в вакууме. Остаток очищали колоночной хроматографией на силикагеле, элюент: этилацетат - триэтиламин, 9:1, Получали 0,958 г пиридоиндола 5а, выход 60 %. Светло-желтые кристаллы, Тпл 111-112°С (ацетон _ пентан). Найдено (%): С, 73,54; H, 6,10; N, 15,52, C22H22N4O. Вычислено (%): C, 73,72; H, 6,19; N, 15,63; O, 4,46, 1H NMR (дейтероацетон, δ, м.д.): 2,43 (3H, c, СН3), 2,81 (4H, м, 2×CH2), 3,26 (2H, т, J = 6,9 Гц, CH2), 3,53 (2H, c, CH2), 4,59 (2H, т, J = 6,9 Гц, CH2), 7,01 (2H, м, Hаром), 7,35 (1H, д, J = 7,1 Гц, Hаром), 7,43 (1H, д, J = 7,6 Гц, Hаром), 7,66 (3H, м, Hаром), 8,14 (2H, м, Hаром).
2,8-Диметил-5-[2-(5-фенил[1,2,4]оксадиазол-3-ил)этил]-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индол (5b). Синтезирован аналогично пиридоиндолу 5a из 1,33 г (4,7 ммоль) пропионамидина 4b, 0,69 мл (0,725 г, 4,8 ммоль) этилбензоата и 0,107 г (0,0047 г-атом) Na. Получено 0,842 г пиридоиндола 5b, выход 48 %. Светло-желтые кристаллы, Тпл 120-120,5 °С (EtOAc _ пентан). Найдено (%): С, 73,99; H, 6,38; N, 15,21, C23H24N4O. Вычислено (%): C, 74,17; H, 6,49; N, 15,04; O, 4,30, 1H NMR (дейтероацетон, δ, м.д.): 2,36 (3H, c, СН3), 2,42 (3H, c, СН3), 2,76 (4H, м, 2×CH2), 3,23 (2H, т, J = 7,1 Гц, CH2), 3,50 (2H, c, CH2), 4,54 (2H, т, J = 7,1 Гц, CH2), 6,89 (1H, д, J = 8,1 Гц, 7_Hинд), 7,13 (1H, с, 9_Hинд), 7,30 (1H, д, J = 8,1 Гц, 6_Hинд), 7,68 (3H, м, Hаром), 8,14 (2H, м, Hаром).2-Метил-8-метокси-5-[2-(5-фенил[1,2,4]оксадиазол-3-ил)этил]-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индол (5с). Синтезирован аналогично пиридоиндолу 5a из 1,274 г (4,2 ммоль) пропионамидина 4с, 0,61 мл (0,639 г, 4,3 ммоль) этилбензоата и 0,097 г (0,0042 г-атом) Na. Получено 0,828 г пиридоиндола 5с, выход 50,6 %. Светло-желтые кристаллы, Тпл 77,5-79 °С (ацетон _ пентан). Найдено (%): С, 70,92; H, 6,12; N, 14,26, C23H24N4O2, Вычислено (%): C, 71,11; H, 6,23; N, 14,42; O, 8,24, 1H NMR (дейтероацетон, δ, м.д.): 2,42 (3H, c, СН3), 2,77 (4H, м, 2×CH2), 3,23 (2H, т, J = 6,9 Гц, CH2), 3,49 (2H, c, CH2), 3,77 (3H, c, СН3O), 4,54 (2H, т, J = 6,9 Гц, CH2), 6,70 (1H, дд, J = 8,4, 2,2 Гц, 7_Hинд), 6,88 (1H, д, J = 2,2 Гц, 9_Hинд), 7,32 (1H, д, J = 8,4 Гц, 6_Hind), 7,68 (3H, м, Hаром), 8,15 (м, 2H, Hаром).
2-Метил-8-фтор-5-[2-(5-фенил[1,2,4]оксадиазол-3-ил)этил]-2,3,4,5-тетрагидро-1H-пиридо[4,3-b]индол (5d). Синтезирован аналогично пиридоиндолу 5a из 1,19 г (4,1 ммоль) пропионамидина 4d, 1,0 мл (1,051 г, 7,0 ммоль) этилбензоата и 0,158 г (0,0068 г-атом) Na. Получено 1,034 г пиридоиндола 4d, выход 67 %. Светло-желтые кристаллы, Тпл 121,5-122,5 °С (EtOAc _ пентан). Найдено (%): С, 70,03; H, 5,74; F, 4,96; N, 14,73, C22H21FN4O. Вычислено (%): C, 70,20; H, 5,62; F, 5,05; N, 14,88; O, 4,25, 1H NMR (дейтероацетон, δ, м.д.): 2,42 (3H, c, СН3), 2,80 (4H, м, 2×CH2), 3,27 (2H, т, J = 7,0 Гц, CH2), 3,50 (2H, c, CH2), 4,59 (2H, т, J = 7,0 Гц, CH2), 6,84 (1H, ддд, JHF = 9,8 Гц, JHH = 9,2 Гц, JHH = 2,5 Гц, 7_Hинд), 7,06 (1H, дд, JHF = 9,8 Гц, JHH = 2,5 Гц, 9_Hинд), 7,42 (1H, дд, JHH = 9,2 Гц, JHF = 4,3 Гц, 6_Hинд), 7,68 (3H, м, Hаром), 8,14 (2H, м, Hаром).
2_Метил_8_хлор_5_[2_(5_фенил[1,2,4]оксадиазол_3_ил)этил]_2,3,4,5_тетрагидро_1H_пиридо[4,3_b]индол (5e). Синтезирован аналогично пиридоиндолу 5a из 1,279 г (4,2 ммоль) пропионамидина 4е, 1,02 мл (1,072 г, 7,1 ммоль) этилбензоата и 0,16 г (0,007 г-атом) Na. Получено 1,052 г пиридоиндола 5е, выход 64 %. Светло-желтые кристаллы, Тпл 122-123 °С (EtOAc _ пентан). Найдено (%): С, 67,05; H, 5,26; Cl, 8,87; N, 14,39, C22H21ClN4O. Вычислено (%): C, 67,26; H, 5,39; Cl, 9,02; N, 14,26; O, 4,07, 1H NMR (дейтероацетон, δ, м.д.): 2,42 (3H, c, СН3), 2,81 (4H, м, 2×CH2), 3,27 (2H, т, J = 6,9 Гц, CH2), 3,51 (2H, c, CH2), 4,60 (2H, т, J = 6,9 Гц, CH2), 7,03 (1H, дд, J = 8,7, 2,0 Гц, 7_Hинд), 7,36 (1H, д, J = 2 Гц, 9_Hинд), 7,46 (1H, д, J = 8,7 Гц, 6_Hинд), 7,67 (3H, м, Hаром), 8,13 (2H, м, Hаром).
Работа выполнена за счет средств Российского научного фонда, проект № 14-23-00160.
Рецензенты:
Безуглов В.В., д.х.н., профессор, заведующий лабораторией, ФГБУ «Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова» РАН, Федеральное агентство научных организаций, г. Москва;
Лермонтов С.А., д.х.н., профессор, заведующий лабораторией, ФГОБУ «Институт физиологически активных веществ» РАН, Федеральное агентство научных организаций, г. Черноголовка.
Работа поступила в редакцию 12.11.2014.
Библиографическая ссылка
Устинов А.К., Серков И.В., Прошин А.Н., Бачурин С.О. γ-КАРБОЛИНЫ, МОДИФИЦИРОВАННЫЕ 2-(5-ФЕНИЛ-[1,2,4]ОКСАДИАЗОЛ-3-ИЛ) ЭТИЛЬНЫМ ФРАГМЕНТОМ // Фундаментальные исследования. 2014. № 11-8. С. 1723-1727;URL: https://fundamental-research.ru/ru/article/view?id=35835 (дата обращения: 08.02.2026).



