Актуальность проведенного исследования определяется широкой распространенностью ишемической болезни сердца (ИБС) и метаболических нарушений, объединенных развитием состояния инсулинорезистентности, к которым, в частности, относят сахарный диабет 2 типа (СД 2 типа) и артериальную гипертензию (АГ). Выделено более 200 факторов риска ИБС, из которых наиболее существенными являются нарушение липидного обмена, артериальная гипертензия, малоподвижный образ жизни, ожирение, хронический стресс. Комплекс таких нарушений сопровождается изменениями со стороны многих органов и систем, в том числе наблюдается высокая частота атеросклеротических поражений сосудов сердца, периферических и церебральных сосудов, а также нарушений микроциркуляторного русла [2].
Эритроциты периферической крови являются универсальной моделью для оценки степени и глубины повреждения мембран при патологическом процессе [3]. С другой стороны, нарушения структурно-функционального состояния мембраны эритроцитов могут рассматриваться как одно из звеньев патогенеза ряда заболеваний, в частности, ИБС и СД 2 типа. При этих заболеваниях наблюдаются нарушения липидного и углеводного обмена, повышенная продукция активных форм кислорода, что приводит к изменению структурно-функциональных свойств мембраны эритроцитов. Одним из важнейших нарушений при СД 2 типа и ИБС является снижение деформируемости эритроцитов и сокращение времени их жизни, что часто связывают с повышением внутриклеточной концентрации ионов кальция.
В изменении деформируемости и программируемой гибели эритроцитов определенную роль играют Са2+-активируемые калиевые каналы (К+(Са2+)-каналы) средней проводимости, или Gardos-каналы этих клеток [5, 8].
Регуляция К+(Са2+)-каналов эритроцитов осуществляется несколькими путями. Один из них связан с белками цитоскелета эритроцитов без участия протеинкиназ [1], другой опосредован активными формами кислорода [6].
Возможно, в эритроцитах больных ИБС и СД 2 типа нарушена регуляция К+(Са2+)-каналов, что является одной из причин снижения деформируемости красных клеток крови и сокращения продолжительности их жизни.
В связи с вышесказанным представляется весьма актуальным изучение регуляции К+(Са2+)-каналов эритроцитов при патологическом процессе, сопровождающемся окислительным повреждением клеток.
Цель исследования: изучить влияние пероксида водорода на Ca2+-активируемую К+-проницаемость мембраны эритроцитов больных ИБС и СД 2 типа при изменении объема клеток.
Материал и методы исследования
В исследовании использовались упакованные эритроциты, выделенные из венозной крови. Группу больных ИБС составили 20 человек в возрасте от 36 до 62 лет (9 мужчин и 11 женщин). В группу больных СД 2 типа в сочетании с АГ вошли 13 человек в возрасте от 34 до 58 лет (6 мужчин и 7 женщин). Клинический диагноз верифицировали с помощью клинико-лабораторных методов исследования на базе отделения атеросклероза и хронической ишемической болезни сердца НИИ кардиологии (руководитель – академик РАМН Р.С. Карпов). В контрольную группу вошли 15 практически здоровых добровольцев, не страдающих ишемической болезнью сердца, сахарным диабетом, ожирением, с нормальным артериальным давлением, без сосудистых и эндокринных заболеваний в анамнезе, сопоставимых по полу и возрасту с группами больных.
Для исследования Са2+-активируемой К+-проницаемости был применен метод регистрации мембранного потенциала в суспензии эритроцитов по изменениям рН среды инкубации в присутствии протонофора, основанный на том, что в этих условиях распределение протонов зависит от мембранного потенциала [4]. В качестве параметров, характеризующих Са2+-зависимую калиевую проницаемость, использовали амплитуду гиперполяризационного ответа (ГО) (параметр DЕ) – значение мембранного потенциала, соответствующие максимальному уровню гиперполяризации мембраны в ответ на добавление А23187 (мВ), а также скорость развития гиперполяризации (параметр V1) (мэкв/мин мл клеток).
Для сжатия клеток упакованные эритроциты помещали в среду, содержащую 150 мМ NaCl, 1 мМ KCl, 1 мM MgCl2, 10 мM глюкозы, 10 мкМ СаСl2 и 200 мМ сахарозы. Кроме того, стандартными методами определяли параметры, характеризующие углеводный и липидный обмен обследованных лиц (таблица).
Математическую обработку результатов проводили с использованием пакета программ SPSS for Windows 11.5. Для каждого параметра определяли значения медианы (М) и квартилей (Q2-Q3). Достоверность различий между группами определяли по непараметрическому критерию Вилкоксона.
Результаты исследования и их обсуждение
Проведенное исследование показало, что ряд параметров, характеризующих углеводный и липидный обмен, достоверно отличается у больных обеих групп и здоровых лиц. В частности, это касалось уровня гликозилированного гемоглобина А1, а также показателей липидного обмена (таблица). Следует отметить, что в большей степени увеличение этих параметров отмечалось у больных СД 2 типа в сочетании с АГ.
Обнаруженные у больных обеих групп нарушения углеводного и липидного обмена закономерно отражаются и на структурно-функциональном состоянии эритроцитарной мембраны [3] и тесно связанных с ней белков цитоскелета, что может изменить функционирование мембранносвязанных белков, в частности транспортных белков.
Действительно, исследование параметров, отражающих активность К+(Са2+)-каналов эритроцитов, показало существенные изменения в их функционировании у больных по сравнению со здоровыми донорами.
Так, амплитуда ГО, полученного в изоосмотической среде инкубации, оказалась достоверно ниже по сравнению с контрольными значениями у больных СД 2 типа в сочетании с АГ, но не у больных ИБС (рис. 1).
Сниженная Са2+ -активируемая калиевая проницаемость мембраны эритроцитов у больных СД 2 типа в сочетании с АГ может свидетельствовать о более глубоких повреждениях мембраны клеток и белков цитоскелета при этом заболевании по сравнению с больными ИБС. Известно, что важную роль в регуляции ион-транспортирующих систем эритроцитов играют белки цитоскелета, в частности спектрин [1]. У больных СД 2 типа отмечается гликозилирование не только гемоглобина, но и основного белка цитоскелета эритроцитов – спектрина [8], что может оказывать влияние на деятельность мембранносвязанных белков ионных каналов. Действительно, содержание гликозилированного гемоглобина выше у больных СД 2 типа в сочетании с АГ, чем у больных ИБС (таблица).
Клинико-лабораторная характеристика больных ишемической болезнью сердца, больных сахарным диабетом 2 типа в сочетании с артериальной гипертензией и здоровых добровольцев
|
Показатель |
Больные ИБС |
Больные СД 2 типа в сочетании с АГ |
Здоровые добровольцы |
|
Длительность диабета, года |
11 ± 3 |
Не выявлено |
|
|
Длительность артериальной гипертензии, года |
6 ± 2 |
9 ± 2 |
Не выявлено |
|
Длительность ИБС, года |
7 ± 2 |
4 ± 1 |
Не выявлено |
|
Показатели контроля артериального давления |
|||
|
Систолическое артериальное давление, мм рт.ст. |
130 ± 5,60 |
146 ± 9,80* |
121 ± 10,60 |
|
Диастолическое артериальное давление, мм рт.ст. |
90 ± 6,98 |
91 ± 2,34* |
88 ± 1,98 |
|
Показатели углеводного обмена |
|||
|
Гликозилированный гемоглобин А1, % от общего гемоглобина |
6,5 ± 0,54* |
8,71 ± 0,39* |
5,21 ± 0,39 |
|
Глюкоза (базальная концентрация), ммоль/л |
5,1 ± 0,26 |
6,89 ± 0,56* |
4,29 ± 0,15 |
|
Глюкоза (постпрандиальный уровень), ммоль/л |
5,4 ± 0,34 |
9,50 ± 0,72* |
4,40 ± 0,13 |
|
Показатели липидного обмена |
|||
|
Общий холестерин, ммоль/л |
5,4 ± 0,06* |
6,09 ± 0,21* |
4,12 ± 0,19 |
|
ЛПНП, ммоль/л |
2,81 ± 0,29* |
3,81 ± 0,17* |
2,5 ± 0,05 |
|
ЛПВП, ммоль/л |
1,12 ± 0,21 |
1,02 ± 0,06* |
1,34 ± 0,12 |
|
Триглицериды, ммоль/л |
2,45 ± 0,57* |
2,84 ± 0,30* |
1,42 ± 0,17 |
|
Показатель массы тела |
|||
|
Индекс массы тела, кг/м2 |
28,42 ± 1,34* |
32,63 ± 1,79* |
24 ± 0,94 |
Примечание. Отмечены параметры, достоверно отличающиеся от показателей здоровых доноров.
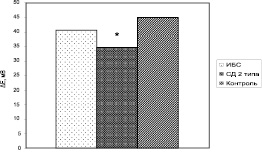
Рис. 1. Амплитуда гиперполяризационного ответа (ΔЕ) эритроцитов больных ИБС, СД 2 типа в сочетании с АГ и практически здоровых добровольцев (контроль) в условиях изоосмотической среды инкубации. * отмечены параметры, достоверно отличающиеся от контрольных (р < 0,05)
Изменение объема эритроцитов сопровождается структурными перестройками белков мембранного каркаса этих клеток, что отражается на активности ионтранспортных систем клеток [1].
Сжатие эритроцитов вследствие помещения их в среду с повышенной осмолярностью (520 мосм) достоверно не изменяло амплитуду гиперполяризационного ответа у больных ИБС и СД 2 типа, но существенно увеличивало этот параметр у здоровых доноров (рис. 2).
В то же время в этих условиях наблюдалось достоверное увеличение скорости нарастания ГО как у больных ИБС, так и у здоровых доноров (рис. 3). Ранее нами было показано, что активные формы кислорода, в том числе и пероксид водорода, участвуют в регуляции К+(Са2+)-каналов эритроцитов [6].
В следующей серии экспериментов в изоосмотическую и гиперосмотическую среду инкубации эритроцитов добавляли Н2О2 (10–5 М). Оказалось, что в изоосмотической среде амплитуда ГО достоверно снижалась у больных ИБС и здоровых доноров, но не больных СД 2 типа в сочетании с АГ (рис. 4).
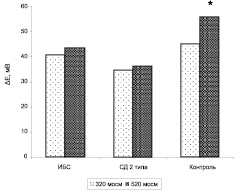
Рис. 2. Амплитуда гиперполяризационного ответа (ΔЕ) эритроцитов больных ИБС, СД 2 типа и практически здоровых добровольцев (контроль) в условиях повышенной осмолярности (520 мосм). * отмечены параметры, достоверно отличающиеся от контрольных (р < 0,05)
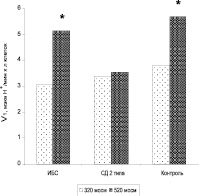
Рис. 3. Скорость развития гиперполяризационного ответа (V1) эритроцитов больных ИБС, СД 2 типа и практически здоровых добровольцев (контроль) в изоосмотической среде (320 мосм) инкубации и в условиях повышенной осмолярности (520 мосм). * отмечены параметры, достоверно отличающиеся от контрольных (р < 0,05)
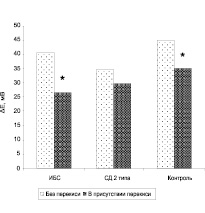
Рис. 4. Влияние пероксида водорода (10–5 М) на амплитуду гиперполяризационного ответа (ΔЕ) эритроцитов больных ИБС, СД 2 типа в условиях изоосмотической среды инкубации (320 мосм). * отмечены параметры, достоверно отличающиеся от контрольных (р < 0,05)
Добавление пероксида водорода в среду с повышенной осмолярностью (520 мосм) не вызывало достоверных изменений амплитуды ГО эритроцитов больных обеих групп по сравнению со значениями амплитуды ГО в среде той же осмолярности. В то же время в этих условиях наблюдалось достоверное снижение амплитуды ГО у практически здоровых доноров-добровольцев (рис. 5). Кроме того, у здоровых доноров достоверно снижалась и скорость развития ГО. Наиболее вероятной причиной обнаруженного эффекта является воздействие пероксида водорода на белки цитоскелета, что приводит к снижению Са2+ -активируемой калиевой проницаемости мембраны эритроцитов в условиях повышенной осмолярности [7]. Полученные данные свидетельствуют об изменении спектрин-обусловленной регуляции К+(Са2+)-каналов эритроцитов у больных обеих групп.
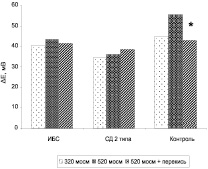
Рис. 5. Влияние пероксида водорода (10-5 М) на амплитуду гиперполяризационного ответа (ΔЕ) эритроцитов больных ИБС, СД 2 типа и практически здоровых доноров-добровольцев (контроль) в условиях сжатия клеток. * отмечены параметры, достоверно отличающиеся от значений, полученных в гиперосмотической среде инкубации в отсутствие пероксида водорода. (р < 0,05)
Заключение
Таким образом, наиболее существенные изменения Са2+-активируемой калиевой проницаемости мембраны эритроцитов отмечаются у больных СД 2 типа в сочетании с АГ, что свидетельствует о существенных изменениях в регуляции Са2+-зависимых калиевых каналов, связанных с белками цитоскелета.
Рецензенты:
Степовая Е.А., д.м.н., профессор кафедры биохимии и молекулярной биологии, ГБОУ ВПО СибГМУ Минздрава России, г. Томск;
Ласукова Т.В., д.б.н., профессор кафедры медико-биологических дисциплин, ГБОУ ВПО «Томский государственный педагогический университет» Министерства образования и науки Российской Федерации, г. Томск.
Работа поступила в редакцию 14.10.2014.
Библиографическая ссылка
Трубачева О.А., Петрова И.В., Гусакова А.М., Суслова Т.Е. ВЛИЯНИЕ ПЕРОКСИДА ВОДОРОДА НА Ca2+-АКТИВИРУЕМУЮ K+-ПРОНИЦАЕМОСТЬ МЕМБРАНЫ ЭРИТРОЦИТОВ У БОЛЬНЫХ С СЕРДЕЧНО-СОСУДИСТЫМИ НАРУШЕНИЯМИ В УСЛОВИЯХ ИЗМЕНЕНИЯ ОБЪЕМА КЛЕТОК // Фундаментальные исследования. 2014. № 10-4. С. 742-746;URL: https://fundamental-research.ru/ru/article/view?id=35615 (дата обращения: 15.02.2026).



