По данным ВОЗ, среди злокачественных новообразований у мужского и женского населения рак желудка занимает четвёртое и пятое место в мире соответственно [1]. В России рак желудка по распространенности занимает седьмое место среди онкологических заболеваний, но характеризуется более высокой летальностью [2].
Исследования механизмов канцерогенеза необходимы для разработки новых терапевтических подходов и поиска потенциальных молекулярных маркеров, пригодных для ранней диагностики и прогнозирования течения заболевания [3].
Изменение числа копий гена (сopy number variation, CNV) является одним из основных механизмов изменения степени экспрессии потенциальных онкогенов и генов-супрессоров опухолей раковыми клетками [4]. CNV – вид генетического полиморфизма, возникающий в результате несбалансированных хромосомных перестроек, таких как делеции и дупликации. Результатом вариации может явиться снижение или повышение числа копий определенного гена и, следовательно, пониженная или повышенная экспрессия продукта гена – белка или некодирующей РНК [5].
В работах Chen Z. [6] и Y.-D. Wang [7] было установлено, что изменение степени экспрессии генетических локусов OCT4 и SOX2 может рассматриваться в качестве потенциальных биомаркеров малигнизации тканей желудка. Ген OCT4 кодирует транскрипционный фактор, участвующий в самообновлении недифференцированных эмбриональных стволовых клеток и широко используется как маркёр для недифференцированных клеток. Нокдаун гена OCT4 вызывает дифференцировку эмбриональных стволовых клеток человека. Белок Oct4 образует гетеродимер с белком Sox2. Sox2 связывается с ДНК совместно с Oct4 в непалиндромной последовательности, чтобы активировать транскрипцию ключевых факторов плюрипотентности [8]. Удивительно, но регулирование энхансеров Oct4-Sox2 может происходить без Sox2, вероятно, за счет экспрессии других Sox белков. Тем не менее группа исследователей пришла к выводу, что основная роль SOX2 в эмбриональных стволовых клетках – контролировать экспрессию OCT4, и оба этих гена поддерживают экспрессию друг друга [9].
Опухолевые клетки характеризуются измененными сигнальными путями, обеспечивающими, в частности, приобретение независимых или автономных сигналов к росту и неограниченного потенциала к пролиферации [10].
Поэтому целью нашего исследования стало изучение изменения относительной копийности генетических локусов OCT4 и SOX2 при малигнизации тканей желудка.
Материалы и методы исследования
Клиническим материалом для исследования послужили ткани (опухолевые и условно здоровые) 29 пациентов Юга России с гистологически подтвержденным диагнозом рак желудка: аденокарциномы G1-G2 (15 пациентов), G3 (5 пациентов), перстневидноклеточным раком (5 пациентов) и смешанного типа (аденокарцинома G3-перстневидноклеточный рак) (4 пациента). Образцы тканей были получены в процессе хирургического вмешательства в Ростовском научно-исследовательском онкологическом институте (РНИОИ) с 2013 по 2014 гг. Все пациенты, вошедшие в данное исследование, имели ECOG статус от 0 до 2. Для верификации образцов тканей проводилось стандартное патолого-морфологическое исследование с окрашиванием фиксированных срезов гематоксилин-эозином. Биоптаты тканей после проведения патолого-морфологического исследования классифицировали на две группы: опухолевые (малигнизированные) и контрольные (не малигнизированные) образцы.
Получение препаратов геномной ДНК
Геномную ДНК экстрагировали из свежезамороженных операционных биоптатов тканей желудка с использованием лизирующего SDS-содержащего буфера в присутствии протеиназы-К и последующей фенол-хлороформной экстракцией [11]. Концентрацию полученных препаратов ДНК измеряли на флюориметре Qubit 2.0® (Invitrogen, США) с использованием набора Quant-iT™ dsDNA High-Sensitivity (HS) Assay Kit (Invitrogen, США). Для проведения Real-Time qPCR концентрацию образцов ДНК нормализовывали до величины 2 нг/мкл.
Определение относительной копийности генетических локусов методом Real-Time qPCR (RT-qPCR)
RT-qPCR используется для оценки относительной копийности генов наряду с другими методами [12]. Принцип метода заключается в одновременной амплификации гена-мишени и референтного гена в опытной и контрольной пробах. Вывод об изменении дозы гена делается на основании анализа соотношения сигналов, продуцируемых амплификатами изучаемой и референсной последовательностей, относительная величина определяется методом ΔCt [13]. Прямые и обратные праймеры были разработаны с использованием референтных последовательностей ДНК NCBI GenBank (таблица). Каждые 25 мкл ПЦР-смеси для анализа содержали 10 нг геномной ДНК, 0,2 mM dNTP’s, по 100 нМ прямого и обратного праймеров для референтного гена или гена-мишени, 2,5 mM MgCl2, ПЦР-буфер, 0,05 u/µl ДНК-полимераза Thermus aquaticus («Синтол», Россия). В качестве красителя использовали SYBR®Green I (Invitrogen, США). Амплификация каждой из проб осуществлялась в трех повторностях.
Количественная RT–PCR амплификация проводилась с использованием термоциклера Bio-Rad CFX96 (Bio-Rad, USA) в соответствии с инструкциями производителя по следующей программе: 95 °C 3 мин, и 40 циклов при 95 °C 10 с, 58 °C 30 секунд (чтение оптического сигнала красителя FAM для красителя SYBR-Green) и 72 °C 15 секунд. Первичные данные RT-qPCR получали с использованием программного обеспечения Bio-Rad CFX Manager (ver. 2.1). Генетический локус B2M [14] использовали в качестве референтного для нормализации полученных показателей количественной RT-qPCR.
Усредненные данные по каждому генетическому локусу нормировались по усредненному показателю референтного гена B2M для получения величины ΔCt (ΔCt = Ct (исследуемого гена) – Ct(B2M)) Относительную копийность генетического локуса (RQ) рассчитывали по формуле 2-ΔCt. Далее вычисляли медиану [15] RQоп опухолевых образцов и медиану RQк контрольных (условно нормальная ткань) для каждого генетического локуса и рассчитывали соотношение относительной копийности генов в опухолевой ткани по отношению к нормальной ткани желудка: RQоп/RQк.
Статистический анализ выполняли с использованием прикладных пакетов программ Microsoft Excel 2013 и Statistica 8.0. Оценку различий проводили с использованием критерия Манна – Уитни [15] для порогового уровня статистической значимости р < 0,05.
Праймеры для определения относительной копийности генов
|
№ п/п |
Наименование |
№ NCBI GenBank |
Хромосомная локализация |
|
1. |
B2M |
NM_004048.2 |
15q21-q22.2 |
|
2. |
OCT4 (POU5F1) |
NM_001285987.1 |
6p21.31 |
|
3. |
SOX2 |
NM_003106.3 |
3q26.3-q27 |
Результаты исследования и их обсуждение
Приблизительно 90 % всех случаев рака желудка – это аденокарциномы эпителиального происхождения [16]. Желудочные аденокарциномы различаются по степени дифференцировки их клеток на высоко-, умеренно- (соответственно стадии G 1-2) и низкодифференцированные аденокарциномы (стадия G3). Для высокодифференцированных опухолей характерно строение клеток, близкое строению клеток нормальной ткани, из которой образовалась данная опухоль. В случае средне- и малодифференцированных опухолей сходство структуры клеток в опухоли и исходной ткани снижается, становится «стёртым». В рамках настоящего исследования у пациентов с аденокарциномой желудка стадии G 1-2 обнаружено достоверное (p < 0,05) снижение относительной копийности генов Oct4 и Sox2 в опухолевой ткани желудка по сравнению с нормальной тканью на 41 % и 32 % соответственно (рисунок). У пациентов с аденокарциномой желудка (стадия G3) также обнаружено статистически достоверное (p < 0,05) снижение копийности Oct4 и Sox2 на 73,5 и 77,4 % соответственно. Полученные результаты являются весьма интересными, потому как и OCT4 и SOX2 являются маркерами недифференцированных клеток, и предполагаемым результатом было бы увеличение их копийности в опухолевой ткани желудка по мере дедифференцировки опухолевых клеток. Данный эффект можно объяснить возможными мутациями нуклеотидных последовательностей локусов, к которым были подобраны праймеры. Эти мутации могут изменить эффективность взаимодействия праймеров с ДНК-матрицей, что приводит к понижению наработки продукта амплификации, а при расчетах – к проявлению снижения относительной копийности генов в низко-дифференцированной опухолевой ткани по сравнению с нормальной. Правда, следует отметить, что и в этом случае можно говорить о понижении относительной копийности нормальной матрицы генетического локуса. Поэтому постепенное снижение относительной копийности нормальной матрицы генов Oct4 и Sox2 при переходе от нормальной ткани к аденокарциноме желудка стадии G 1-2 и далее к аденокарциноме желудка стадии G3 может служить маркером как малигнизации ткани, так и разной стадии этого процесса.
При смешанном типе рака (аденокарцинома G3+ перстневидноклеточный рак) обнаружена только тенденция к амплификации гена Sox2 и отсутствие изменения копийности OCT4 по сравнению с условно нормальной тканью желудка. Эти данные согласуются с литературными, согласно которым при некоторых видах рака, в частности при плоскоклеточном раке легких, наблюдается увеличение числа копий гена SOX2 [17].
Перстневидноклеточный рак желудка – одна из гистологических форм желудочной карциномы. При раке желудка перстневидноклеточного типа достоверных изменений копийности генов OCT4 и SOX2 относительно условно нормальной ткани желудка не обнаружено, относительная копийность этих генов находится на одинаковом уровне (рисунок).
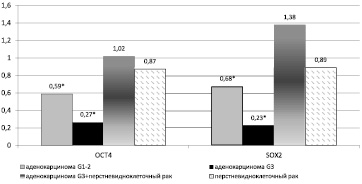
Изменение копийности генов OCT4 и SOX2 при разных гистологических типах рака желудка (* отмечены статистически достоверные отличия для порогового уровня p < 0,05)
Таким образом, наше исследование показало, что изменение относительной копийности генов OCT4 и SOX2 можно использовать в качестве молекулярного биомаркера, позволяющего дифференцировать аденокарциномы G1-2 и G3 от других гистологических типов рака желудка. Полученные данные свидетельствуют об интенсивном мутационном процессе в генетических локусах OCT4 и SOX2 и сонаправленном изменении копийности этих генов при рассматриваемых гистологических типах рака желудка.
Рецензенты:
Непомнящая Е.М., д.м.н., профессор, главный научный сотрудник, ФГБУ «Ростовский научно-исследовательский онкологический институт» МЗ РФ, г. Ростов-на-Дону;
Франциянц Е.М., д.м.н., профессор, руководитель лаборатории изучения патогенеза злокачественных опухолей, ФГБУ «Ростовский научно-исследовательский онкологический институт» МЗ РФ, г. Ростов-на-Дону.
Работа поступила в редакцию 07.10.2014.
Библиографическая ссылка
Кит О.И., Водолажский Д.И., Геворкян Ю.А., Кутилин Д.С., Малейко М.Л., Двадненко К.В., Енин Я.С., Гудуева Е.Н. ИЗМЕНЕНИЕ ОТНОСИТЕЛЬНОЙ КОПИЙНОСТИ ГЕНОВ OCT4 И SOX2 ПРИ МАЛИГНИЗАЦИИ ТКАНЕЙ ЖЕЛУДКА // Фундаментальные исследования. 2014. № 10-4. С. 671-674;URL: https://fundamental-research.ru/ru/article/view?id=35601 (дата обращения: 15.02.2026).



