Ранее нами в плодах представителей североамериканских видов рода Боярышник были обнаружены гидроксикоричные кислоты, флавоноиды, гидроксикумарины, изучен их качественный состав и количественное содержание [2, 3, 4, 8].
Изучение других классов биологически активных веществ этих объектов представляет несомненный интерес, в том числе для клинической медицины [5]. Известно, что плоды боярышников содержат липофильные вещества (жирные кислоты, каротиноиды, хлорофилл), но липиды большинства боярышников практически не изучены [1, 6, 9].
Целью нашей работы явилось определение возможности комплексной переработки сырья и более углубленное изучение химического состава липофильных соединений плодов боярышника [6, 7, 9, 11, 12].
Материалы и методы исследования
Объектами исследования стали липофильные фракции 5 видов боярышника североамериканской группы, культивируемых на территории Центрального федерального округа России: боярышника зеленого Crataegus viridis Sarg,, боярышника мягкого С. mollis (Torr. et Grey) Schelle, боярышника густоцветкового C. densiflora Sarg., боярышника арканзасского С. arkansana Sarg., боярышника вееровидного C. flabellatа (Bosc) C. Koch [10].
Для получения липофильной фракции 10,0 измельченных плодов боярышника помещали в пакет из фильтровальной бумаги и брали навеску на аналитических весах. Экстракцию проводили хлороформом в аппарате Сокслета на водяной бане до обесцвечивания экстракта в заливном патрубке и негативной реакции на жир. Колбу-приемник взвешивали до и после экстракции. Для удаления паров экстрагента колбу помещали в сушильный шкаф на 30 минут при температуре 60 °С. Затем определяли процентное содержание липофильной фракции в сырье.
Исследование жирнокислотного состава плодов. Для определения качественного состава и количественного содержания жирных кислот использовали навески массой 100 мг. Экстракцию кислот из проб проводили раствором Фолча (хлороформ – метанол в соотношении 2:1) при нагревании до 40 °С в течение 5 минут. Затем пробы центрифугировали при скорости 3000 об/мин в течение 10 минут. Метилирование жирных кислот проводили следующим образом: из пробирки для центрифугирования отбирали хлороформный слой и помещали в реакционную пробирку объемом 25 мл, упаривали раствор досуха в струе газообразного азота при температуре 60 °С, прибавляли 5 мл 1 % раствора кислоты серной в спирте метиловом, пробирку помещали на водяную баню на 30 минут при температуре 80 °С; охлаждали, прибавляли 3 мл воды дистиллированной и 5 мл смеси гексан – эфир в соотношении 1:1, перемешивали и после отстаивания верхнюю фракцию переносили в пробирку для центрифугирования, раствор концентрировали; остаток растворяли в 0,5–1 мл гексана, отбирали 1 мкл для внесения в газовый хроматограф.
Разделение и регистрацию жирных кислот проводили на газовом хроматографе «Хром 5» на металлической колонке длиной 2,6 метра и внутренним диаметром 0,32 см, заполненной сорбентом «Хроматон-супер» с 10 % полидитэтиленгликольсукцинатом. Анализ проб свободных жирных кислот проводили в изотермическом режиме при 195 °С и нагревании пламенного ионизационного детектора до 250 °С. Скорость газа-носителя 50 мл/мин, воды 30 мл/мин, воздуха 300 мл/мин. Идентификацию свободных жирных кислот проводили путём сравнения времени их выхода с известными метилированными эфирами жирных кислот.
Количественный анализ проводили методом абсолютной калибровки каждой жирной кислоты отдельно, а также по их смесям с построением калибровочных кривых, по которым и определяли концентрацию каждой жирной кислоты в пробе.
Качественное определение хлорофиллов и каротиноидов. Для идентификации хлорофиллов и каротиноидов использовали одно- и двумерную хроматографию в тонком слое сорбента на пластинках «Silufol» в системах растворителей гексан – ацетон (6:4) – 1 направление, гексан – ацетон (6:3) – 2 направление.
Наличие каротиноидов определяли по характерным жёлтым и жёлто-коричневым окраскам пятен и коричневой флюоресценции в УФ-свете. В качестве проявителя использовали 2 % раствор n-диметиламинобензальдегида в смеси спирта этилового и кислоты хлористоводородной (реактив А). Пятна, которые соответствовали каротиноидам, имели розово-фиолетовую окраску [7]. Каротиноиды проявляли с помощью 10 % этанольного раствора кислоты фосфорномолибденовой (реактив Б) и дальнейшим нагреванием в сушильном шкафу при 60–80 °С на протяжении 5 минут. На желто-зелёном фоне обнаруживались синие пятна каротиноидов.
Хлорофиллы на хроматограммах в дневном свете имели темно-зелёное окрашивание и ярко-красную флюоресценцию в УФ-свете.
Количественное определение каротиноидов. Для количественного определения содержания каротиноидов в липофильной фракции точную навеску (m = 0,0185 г) помещали в мерную колбу объёмом 25 мл, растворяли в гексане и доводили до метки. К 2 мл полученного раствора (V1) прибавляли 2 мл гексана, таким образом, получали 4 мл раствора (V2). Оптическую плотность определяли на спектрофотометре СФ-2000.
Результаты исследования и их обсуждение
Полученные липофильные фракции представляют собой смолистые жидкости жёлто-коричневого (C. densiflora, C. flabellata), и желто-зеленого (C. mollis, C. viridis, C. arkansana) цвета, с характерным запахом, нерастворимые в воде и спирте, растворимые в хлороформе, гексане, этилацетате.
Выход липофильной фракции, в пересчёте на абсолютно сухое сырьё, рассчитывали по формуле
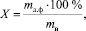
где mл.ф – масса липофильной фракции; mн – масса навески сырья.
При влажности сырья 14 % выход липофильной фракции равняется
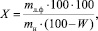
где mл.ф – масса липофильной фракции; mн – масса навески сырья, взятой для анализа; W – влажность сырья.
Результаты определения выхода липофильной фракции представлены в табл. 1.
Таблица 1
Выход липофильной фракции плодов боярышников
|
№ п/п |
Вид боярышника |
Масса навески сырья |
Масса липофильной фракции |
Выход липофильной фракции (на абсолютно сухое сырьё) (%) |
Выход липофильной фракции (с учётом влажности сырья) ( %) |
|
1 |
C. viridis |
20,7425 |
0,2400 |
1,16 |
1,34 |
|
2 |
C. mollis |
21,5000 |
0,2800 |
1,3 |
1,55 |
|
3 |
C. densiflora |
20,5991 |
0,1500 |
0,72 |
0,85 |
|
4 |
C. arkansana |
20,6046 |
1,6000 |
7,76 |
9,02 |
|
5 |
C. flabellata |
20,4157 |
0,1000 |
0,49 |
0,57 |
Наибольший выход липофильной фракции, как видно из таблицы, установлен для плодов C. arkansana (9,02 %), наименьший – плодов C. flabellata (0,57 %). По результатам флюоресценции, окраске пятен после обработки хромогенными реактивами и значению Rf вещества 6–8 отнесены к хлорофиллам, вещества 1–5 и 9 – к каротиноидам (табл. 2).
Таблица 2
Результаты хроматографического анализа хлорофиллов и каротиноидов
|
Номер пятна |
Флюоресценция до проявления |
Окраска после проявления (реактив А) |
Значение Rf |
|
|
I |
II |
|||
|
1 |
Жёлтая |
Розово–фиолетовая |
0,5 |
0,7 |
|
2 |
Жёлтая |
Розово–фиолетовая |
1,9 |
2,2 |
|
3 |
Жёлтая |
Розово–фиолетовая |
2,1 |
2,3 |
|
4 |
Жёлтая |
Розово–фиолетовая |
2,5 |
2,7 |
|
5 |
Жёлтая |
Розово–фиолетовая |
3,6 |
3,9 |
|
6 |
Красная |
Синяя |
3,5 |
3,9 |
|
7 |
Красная |
Синяя |
4,0 |
4,2 |
|
8 |
Красная |
Синяя |
4,7 |
5,0 |
|
9 |
Жёлтая |
Розово-фиолетовая |
5,3 |
5,6 |
В результате хроматографического анализа в плодах исследуемых видов боярышника определено присутствие хлорофиллов и каротиноидов.
Результаты количественного определения жирных кислот приведены в табл. 3.
Как видно из табл. 3, жирнокислотный состав плодов исследуемых видов боярышников неоднороден. Так, в плодах C. viridis найдено 11 жирных кислот; C. mollis и C. arkansana – 8; C. densiflora – 7; C. flabellata – 9. В исследуемых видах идентифицировано 11 жирных кислот, 2 из которых (линолевая и линоленовая) являются незаменимыми (входят в состав комплекса витамина F) [10, 11, 12]. Доминирующими во всех видах являются (мкг/100 мг): пальмитиновая (182,5–1735), олеиновая (625–6667), стеариновая (20–667) и линолевая (960–24000) кислоты. Декановая и лауриновая кислоты обнаружены в C. viridis; тридекановая – в C. viridis и C. mollis; пентадекановая – C. viridis и C. flabellata; гептодециновая – в C. viridis и C. mollis.
Таблица 3
Жирнокислотный состав липофильной фракции плодов боярышников
|
№ п/п |
Название кислоты |
Общая формула |
Содержание жирных кислот в плодах боярышников, мкг/100 мг |
||||
|
C. viridis |
C. mollis |
C. densiflora |
C. arkansana |
C. flabellata |
|||
|
1 |
Декановая |
С10:0 |
2,50 |
– |
– |
– |
– |
|
2 |
Лауриновая |
С12:0 |
5,00 |
– |
– |
– |
– |
|
3 |
Тридекановая |
С13:0 |
6,25 |
9,00 |
– |
– |
сл. |
|
4 |
Миристиновая |
С14:0 |
25,00 |
80,00 |
120,00 |
270,00 |
50,00 |
|
5 |
Пентадекановая |
С15:0 |
5,00 |
– |
– |
– |
40,00 |
|
6 |
Пальмитиновая |
С16:0 |
182,50 |
1160,00 |
1080,00 |
1735,00 |
500,00 |
|
7 |
Гептодециновая |
С16:1 |
20,00 |
100,00 |
сл. |
сл. |
сл. |
|
8 |
Стеариновая |
С18:0 |
75,00 |
240,00 |
360,00 |
667,00 |
20,00 |
|
9 |
Олеиновая |
С18:1 |
625,00 |
2300,00 |
3780,00 |
6667,00 |
2200,00 |
|
10 |
Линолевая |
С18:2 |
960,00 |
6600,00 |
9300,00 |
24000,00 |
5600,00 |
|
11 |
Линоленовая |
С18:3 |
45,00 |
120,00 |
сл. |
сл. |
140,00 |
|
Сумма ненасыщенных кислот |
1650,00 |
9120,00 |
13080,00 |
30667,00 |
7940,00 |
||
|
Сумма насыщенных кислот |
301,25 |
1489,00 |
1560,00 |
2672,00 |
610,00 |
||
Для установления содержания каротиноидов показатели оптической плотности определяли на приборе СФ-2000. Для C. viridis. он составляет 0,939; для C. mollis – 0,978; для C. densiflora – 0,796; для C. arkansana – 1,054; для C. flabellatа – 0,911. Удельное поглощение (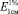 ) для суммы каротиноидов в гексане при длине волны 453 нм принимается равным 2592. Содержание суммы каротиноидов определяли по формуле
) для суммы каротиноидов в гексане при длине волны 453 нм принимается равным 2592. Содержание суммы каротиноидов определяли по формуле
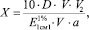
где D – оптическая плотность исследуемого раствора при определённой длине волны (45 нм); 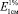 – для ?-каротина при длине волны 453 нм составляет 2592; 10 – содержание каротина в 1 мл 1 %-го раствора, мг; V – общий объём экстракта, мл; V1 – объём экстракта, взятый для хроматографирования, мл; V2 – объём элюата, мл; а – навеска, г.
– для ?-каротина при длине волны 453 нм составляет 2592; 10 – содержание каротина в 1 мл 1 %-го раствора, мг; V – общий объём экстракта, мл; V1 – объём экстракта, взятый для хроматографирования, мл; V2 – объём элюата, мл; а – навеска, г.
Метрологическая характеристика определения каротиноидов представлена в табл. 4.
Таблица 4
Метрологическая характеристика количественного определения каротиноидов в плодах боярышников
|
m |
n |
Xi |
Хср |
S2 |
Scp |
P |
t (P, n) |
Доверительный интервал |
ε, % |
|
C.viridis |
|||||||||
|
5 |
4 |
9,3125 |
9,6669 |
0,063904175 |
0,11305236 |
0,95 |
2,78 |
9,6669 ± 0,3143 |
3,2512 |
|
9,5020 |
|||||||||
|
9,7535 |
|||||||||
|
9,8540 |
|||||||||
|
9,9125 |
|||||||||
|
C.mollis |
|||||||||
|
5 |
4 |
9,7630 |
9,8688 |
0,006975825 |
0,03735191 |
0,95 |
2,78 |
9,8688 ± 0,1038 |
1,0522 |
|
9,8125 |
|||||||||
|
9,8670 |
|||||||||
|
9,9435 |
|||||||||
|
9,9580 |
|||||||||
|
C.densiflora |
|||||||||
|
5 |
4 |
7,8950 |
8,0166 |
0,010883550 |
0,04665522 |
0,95 |
2,78 |
8,0166 ± 0,1297 |
1,6179 |
|
7,9565 |
|||||||||
|
7,9865 |
|||||||||
|
8,1525 |
|||||||||
|
8,0925 |
|||||||||
|
C.arkansana |
|||||||||
|
5 |
4 |
10,45 |
10,8048 |
0,101014142 |
0,14213665 |
0,95 |
2,78 |
10,8048 ± 0,3951 |
3,6571 |
|
10,65 |
|||||||||
|
10,76 |
|||||||||
|
10,86 |
|||||||||
|
11,31 |
|||||||||
|
C.flabellatа |
|||||||||
|
5 |
4 |
9,0257 |
9,2941 |
0,066702823 |
0,11550136 |
0,95 |
2,78 |
9,2941 ± 0,3211 |
3,4548 |
|
9,1015 |
|||||||||
|
9,2370 |
|||||||||
|
9,6535 |
|||||||||
|
9,4530 |
|||||||||
Количественное содержание каротиноидов для C. viridis составляет 9,66 мг %, C. mollis – 9,86 мг %, C. densiflora – 8,01 мг %, C. arkansana – 10,8 мг %, C. flabellatа – 9,29 мг %.
Выводы
Определено содержание липофильных веществ в плодах боярышника зеленого Crataegus viridis Sarg,, боярышника мягкого С. mollis (Torr. et Grey) Schelle, боярышника густоцветкового C. densiflora Sarg., боярышника арканзасского С. arkansana Sarg., боярышника вееровидного C. flabellatа (Bosc) C. Koch, относящихся к североамериканской группе боярышников. Исследован качественный состав хлорофиллов, каротиноидов, жирных кислот. Выход липофильных фракций из плодов исследуемых боярышников с учётом влажности сырья составляет от 0,57 до 9,02 %. В плодах идентифицировано 11 жирных кислот. Установлено, что доминирующими во всех видах (мкг/100 мг) являются пальмитиновая (182,5–1735), олеиновая (625–6667), стеариновая (20–667) и линолевая (960–24000) кислоты. Содержание каротиноидов в плодах составляет от 8,01 до 10,8 мг %. Полученные данные расширяют сведения о химическом составе растений рода Боярышник и могут быть использованы для создания новых фитопрепаратов.
Рецензенты:
Покровский М.В., д.м.н., заведующий кафедрой фармакологии, руководитель центра доклинических и клинических исследований, ФГАОУ ВПО НИИ «БелГУ» Министерства науки и образования РФ, г. Белгород;
Кочкаров В.И., д.б.н., ведущий научный сотрудник, ООО «Научный центр «Белфарма», г. Белгород.
Работа поступила в редакцию 06.10.2014.
Библиографическая ссылка
Гончаров Н.Н., Михайлов И.В., Гончаров Н.Ф., Терешонок Е.В. ИЗУЧЕНИЕ СОСТАВА ЛИПОФИЛЬНЫХ СОЕДИНЕНИЙ ПРЕДСТАВИТЕЛЕЙ РОДА БОЯРЫШНИК // Фундаментальные исследования. 2014. № 11-2. С. 357-361;URL: https://fundamental-research.ru/ru/article/view?id=35527 (дата обращения: 31.01.2026).



