Одним из важных звеньев патогенеза опухолевого процесса является дисбаланс процессов перекисного окисления липидов и антиоксидантной защиты (Маньчева Т.А. и соавт., 2011). Взгляд на гиперактивацию ПОЛ при неоплазиях неоднозначен. С одной стороны, активация приводит к вторичным органным повреждениям и усиливает явления эндотоксикоза (Зорькина А.В., Скопин П.И., 2009). С другой, она может быть следствием активации иммунных процессов, направленных на уничтожение чужеродных опухолевых клеток. Считается признанной негативная роль гиперлипопероксидации, развивающейся при проведении химиотерапии (Дерябина О.Н., 2010). Данные обстоятельства создают предпосылки для изучения эффекта антиоксидантов при злокачественных новообразованиях.
В ряде работ последних лет было показано, что применение антиоксидантов на фоне химиотерапии экспериментальных неоплазий сопровождается положительным эффектом, выражающимся в уменьшении выраженности эндотоксикоза и потенцированием эффекта цитостатиков (Сипров А.В., 2009, Пятаев Н.А., 2011).
Среди антиоксидантов наиболее изученными являются производные 3-гидроксипиридина, в частности 3-гидроксипиридина сукцинат (мексидол). В основе его антиоксидантного действия лежит способность ингибировать стадию инициации свободной радикальной реакции, тем самым снижая возможность неоплазии (Деримедведь Л.В., 1998). Кроме того, имеются сообщения о применении в качестве средства сопроводительной терапии мелатонина – гормона гипофиза, обладающего биоритмологическим, иммуномодулирующим и антиоксидантным эффектами. (Анисимов В.Н., 2008).
Однако до настоящего времени недостаточно исследовано собственное влияние препаратов с антиоксидантным эффектом на течение неопластического процесса. В частности, представляет интерес динамика патоморфологических изменений в ткани экспериментальных новообразований при использовании данных препаратов.
Целью настоящего исследования явилось изучение динамики патоморфологических изменений в ткани первичного опухолевого узла перевиваемой карциномы легкого Льюиса (LLC) при коррекции препаратами антиоксидантного типа действия.
Материалы и методы исследования
Эксперименты выполнены на 50 мышах-самках линии C57Bl/6 массой 20–22 г. питомника ГУ НЦБМТ РАМН «Столбовая». Всем животным суспензию клеток карциномы легкого Льюиса (106 клеток в растворе Хенкса) перевивали внутримышечно в область бедра. Животные были распределены на 3 группы. Дизайн исследования представлен в таблице.
Дизайн исследования
|
Условное обозначение экспериментальных групп |
Схема введения препаратов |
|
I – LLC |
1•106 опухолевых клеток LLC внутримышечно (в/м) |
|
II – Мелатонин |
Ежедневно, в/м, в дозе 45 мг/кг, начиная с 7-х суток после имплантации опухолевых клеток, в течение 14 дней |
|
III – Мексидол |
Ежедневно, в/м, в дозе 50 мг/кг, начиная с 7-х суток, в течение 14 дней |
Мексидол и мелатонин как средства с антиоксидантным действием вводились, начиная с 7-х суток после имплантации опухолевых клеток, в течение 14 дней внутримышечно в дозах 50 и 45 мг/кг соответственно. По окончанию эксперимента, на 22-е сутки, животные подвергались эвтаназии. Материалом изучения явилась ткань первичного опухолевого узла, патогистологическую структуру которой исследовали светооптическим методом при окраске гематоксилином и эозином.
Результаты исследования и их обсуждение
У животных всех экспериментальных групп в месте имплантации суспензии клеток развивались опухолевые узлы карциномы Льюиса. При микроскопическом исследовании первичных опухолевых узлов у мышей I экспериментальной группы (LLC) ткань узла была представлена скоплением крайне полиморфных, атипичных опухолевых клеток (рис. 1). Встречалось большое количество клеток с крупными ядром и ядрышками. В связи с выраженной конденсацией зерен хроматина в крупные глыбки встречались светлоокрашенные участки кариоплазмы.
Среди клеток карциномы обнаруживались также гигантские полиморфные клетки. В отдельных опухолевых клетках наблюдались фигуры митоза (анафаза), что отражает их высокую пролиферативную активность. В строме опухолевой ткани выявлялись множественные массивные очаги некроза с перифокальными воспалительными инфильтратами.
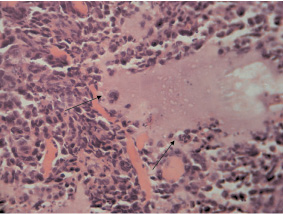
Рис. 1. Гистологическая картина ткани первичного опухолевого узла. Гигантские полиморфные клетки. Фигуры митоза (гематоксилин и эозин; об. 40, ок. 10)
В ткани перевиваемых неоплазий у мышей II экспериментальной группы (мелатонин) при микроскопическом исследовании узлов отмечалось уменьшение признаков полиморфизма клеток карциномы. Опухолевые клетки имели преимущественно округло-овальную форму, небольшие размеры, встречались клетки с сегментированными ядрами, состоящими из 3–4 фрагментов.
В отдельных участках опухолевых узлов выявлялись единичные гигантские клетки с округлыми и бобовидными ядрами. При этом отмечалось рыхлое расположение клеток, в отдельных участках опухолевая ткань имела ячеистое строение (рис. 2). Фигуры митоза выявлялись редко.
Строма опухоли представлена тонкопетлистой соединительнотканной сетью с небольшими участками склероза. В ткани карциномы обнаруживались обширные очаги некроза с наличием умеренно выраженной перифокальной воспалительно-клеточной реакции.
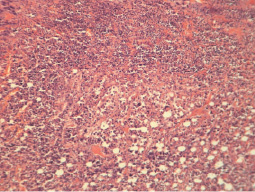
Рис. 2. Гистологическая картина ткани первичного опухолевого узла мышей II экспериментальной группы. Рыхлое расположение клеток, опухолевая ткань имеет ячеистое строение (гематоксилин и эозин; об. 10, ок. 10)
Патогистологическая картина ткани новообразований экспериментальных животных III группы (мексидол), была представлена рыхло расположенными, округлыми опухолевыми клетками. При этом заметно снижался полиморфизм клеток карциномы (рис. 3). Встречались единичные гигантские клетки.
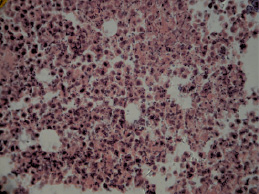
Рис. 3. Гистологическая картина ткани первичного опухолевого узла мышей III экспериментальной группы. Рыхло расположенные, округлые опухолевые клетки (гематоксилин и эозин; об. 40, ок. 10)
Стромальный компонент опухолевой ткани был представлен тонкими прослойками соединительной ткани с небольшим количеством сосудов микроциркуляторного русла. В ткани неоплазий выявлялись отдельные небольшие очаги некроза.
Заключение
У животных всех экспериментальных групп в месте имплантации суспензии клеток развивались опухолевые узлы карциномы Льюиса. При использовании антиоксидантной терапии отмечался менее выраженный полиморфизм опухолевых клеток, уменьшалось количество гигантских клеток и фигур митоза. Обращало на себя внимание рыхлое расположение клеток карциномы в первичном опухолевом узле, а также наличие мелкоочаговых некрозов.
Полученные экспериментальные данные подтверждают онкостатический эффект антиоксидантов (мексидол) и препаратов с антиоксидантным эффектом (мелатонин).
Рецензенты:
Мозеров С.А., д.м.н., зав. кафедрой морфологии медицинского факультета, Обнинский институт атомной энергетики НИЯУ МИФИ Минобрнауки России, г. Обнинск;
Сабиров А.Х., д.м.н., профессор кафедры онкологии с курсами лучевой диагностики и лучевой терапии, Тюменская государственная медицинская академия Минздрава России, г. Тюмень.
Работа поступила в редакцию 18.09.2014.
Библиографическая ссылка
Плотникова Н.А., Пятаев Н.А., Канаев П.М., Кокорев А.В., Кемайкин С.П., Харитонов С.В., Громова С.В. ОСОБЕННОСТИ МОРФОЛОГИИ КАРЦИНОМЫ ЛЕГКОГО ЛЬЮИСА НА ФОНЕ КОРРЕКЦИИ ОПУХОЛЕВОГО РОСТА МЕЛАТОНИНОМ И 3-ГИДРОКСИПИРИДИНОМ // Фундаментальные исследования. 2014. № 10-3. С. 549-552;URL: https://fundamental-research.ru/ru/article/view?id=35461 (дата обращения: 28.02.2026).



