В настоящее время не вызывает сомнений, что сердечная недостаточность как исход многих сердечно-сосудистых заболеваний (ССЗ) имеет существенные гендерные различия. Накоплено большое количество экспериментальных и клинических наблюдений о половых особенностях в адаптации сердца к стрессу и повреждениям [6]. Большое внимание продолжает уделяться идентификации различных нейроэндокринных факторов, участвующих в регуляции тканевого гомеостаза, а также процессов репаративных гистогенезов в миокарде [5]. В большинстве исследований на животных самки демонстрируют более низкую смертность, менее выраженную гипертрофию и лучше сохраняющуюся сердечную функцию по сравнению с самцами. Данные подтверждают гипотезу, что женский пол и/или половые гормоны эстрогены могут вносить свой вклад в половой диморфизм в сердце и лучший исход ССЗ у женщин [8]. Тем не менее молекулярно-генетические механизмы, лежащие в основе этого феномена, полностью так и не ясны.
В связи с этим важна роль гормона эпифиза – мелатонина. Уже в начале 90-х годов прошлого столетия проводились сравнительные исследования, где было доказано, что у женщин уровень мелатонина в среднем на 25 % выше, чем у мужчин. Последние данные показали, что треть мелатонина вырабатывается экстрапинеально: в различных органах и тканях, в том числе и в самом сердце [12]. В немногочисленных работах последних лет продемонстрировано снижение уровня мелатонина в моче у больных с хронической сердечной недостаточностью (ХСН) по сравнению со здоровыми обследуемыми [9]. Однако значение мелатонина в развитии ремоделирования сердца и ХСН до настоящего времени не определено.
Мелатонин реализует свои эффекты, воздействуя через рецептор-зависимые и рецептор-независимые механизмы [12]. Мембранные мелатониновые рецепторы (MT1 и MT2) присутствуют в сердце и во всей сосудистой системе. Существует немало свидетельств, предполагающих взаимодействие эпифизарных и половых гормонов между собой, хотя основные механизмы их влияния друг на друга и кардиопротективные эффекты на миокард при ХСН до сих пор не понятны [14].
Таким образом, целью настоящего исследования явилась оценка экспрессии МТ2-рецепторов мелатонина (МТР2) и структурно-функциональных изменений в миокарде левого желудочка (ЛЖ) крыс-самок и самцов в условиях экспериментальной сердечной недостаточности (ЭСН) и гипоэстрогении (у самок).
Материал и методы исследования
Исследование проведено на 55 крысах: самцах (n = 20) и самках (n = 35) линии Wistar массой 180–230 г. Контролем служили 20 интактных крыс: самцов (n = 10) и самок (n = 10). С целью моделирования гипоэстрогении у 15 крыс основной группы под анестезией эфирным рауш-наркозом проводили билатеральную овариэктомию. Влияние гипоэстрогении на миокард оценивалось через 2 мес. пребывания крыс (n = 5) в обычных условиях вивария. 30 животным: самцы (n = 10), овариоэктомированные (ОЭ) самки (n = 10), интактные самки основной группы (n = 10) – ЭСН моделировали по методике В.И. Инчиной с соавт. [2000] путем подкожного введения в течение 14 сут 0,1 мл 1 % раствора мезатона с последующим плаванием до глубокого утомления. На 14-е сут ЭСН животных декапитировали под эфирным рауш-наркозом. Содержание крыс в виварии и проведение экспериментов соответствовали «Правилам проведения работ с использованием экспериментальных животных», утвержденных приказами МЗ СССР № 1045 от 6.04.73 г., № 1179 от 10.10.83 г. Миокард ЛЖ контрольных и экспериментальных крыс был подвергнут стандартной однотипной обработке и изучен с помощью световой микроскопии – после окраски парафиновых срезов гематоксилином Майера - эозином, иммуноцитохимических реакций (оценка экспрессии кроличьих поликлональных антител Anti-MTNR1B (AB1) (Sigma-Aldrich, USA) в разведении 1:100, для выявления иммунного окрашивания использовали мультимерную безбиотиновую систему детекции (R&D, HRP-DAB Systems, USA), затем осуществляли докрашивание ядер водным гематоксилином Майера), методов морфометрии. Оценку локализации и интенсивности иммунной реакции проводили полуколичественным методом +/+++ в случайно выбранных 20 полях зрения (100 %): (-) нет иммунопозитивных кардиомиоцитов (ИКМЦ); (+) легкая, один ИКМЦ; (++) умеренная, более 5 ИКМЦ; (+++) высокая иммунореактивность, почти все кардиомиоциты иммунопозитивны. Морфометрию осуществляли в соответствии со сложившимися принципами системного количественного анализа [1]. Цитологический анализ структурно-функциональной реорганизации мышечной и стромальной частей миокарда осуществляли в условных полях зрения микроскопа OPTIKA B-350 (Италия), микрофотографии получали с использованием цифровой фотокамеры ScopeTek DCM 500 (Италия) и программы ScopePhoto с указанной окулярной вставкой при исследовании 20 полей зрения гистологических срезов (об. 40, ок. 20). Статистическую обработку результатов проводили с помощью программы «Statistica 6.0»
Результаты исследования и их обсуждение
Морфологический анализ миокарда ЛЖ интактных животных показал определенные половые особенности в строении. Кардиомиоциты (КМЦ) в миокарде располагаются параллельно, имеют одинаковую форму и размеры. В цитоплазме КМЦ определяется характерная поперечная исчерченность, ядра их вытянутой или овальной формы занимают преимущественно центральное положение. При этом диаметр КМЦ и их ядер у самок достоверно меньше, чем у самцов (табл. 1). Параллельно КМЦ располагаются сосуды: артериолы, каппиляры, венулы, имеющие типичное для миокарда строение, но характеризующиеся меньшим диаметром особенно крупных сосудов у крыс-самок, чем у самцов. Вокруг сосудов и между КМЦ локализуются незначительные прослойки соединительной ткани, включающие фибробласты, фиброциты, адвентициальные клетки и единичные лаброциты.
При гистологическом анализе препаратов ОЭ крыс, находившихся в состоянии гипоэстрогении 2 мес, выявлена реорганизация мышечных и немышечных элементов миокарда ЛЖ. Наблюдались гетероморфизм КМЦ, смещение их ядер на периферию, участки с умеренным интерстициальным отеком. Происходило увеличение числа капилляров, заполненных сладжированными эритроцитами, а также объема соединительной ткани (табл. 1). Данный факт можно объяснить кардиопротективным действием эстрогенов на миокард. Муньос-Кастанеда с соавт. предполагают, что овариэктомия, приводящая к снижению уровня эстрогенов в крови, увеличивает уровень окислительного стресса, достаточного для развития ремоделирования миокарда. ОЭ крысы, как сообщают исследователи, имеют значительно более низкие концентрации антиоксидантных ферментов: глутатионпероксидазы, супероксиддисмутазы, каталазы, а также эритроцитов в ткани сердца [11].
Таблица 1
Морфометрические показатели кардиомиоцитов ЛЖ крыс в группах (М ± m)
|
Показатель |
Самки, контроль n = 10 |
Самцы, контроль n = 10 |
Экспериментальные группы |
|||
|
Самки ОЭ n = 5 |
Самки 14 сут ЭСН n = 10 |
Самки ОЭ + 14 сут ЭСН n = 10 |
Самцы 14 сут ЭСН n = 10 |
|||
|
d КМЦ, мкм |
7,77 ± 0,75 |
8,14 ± 0,37* |
8,25 ± 1,54*^ |
8,73 ± 1,18*^ |
9,01 ± 1,15* |
8,93 ± 1,12# |
|
d ядра КМЦ, мкм |
2,34 ± 0,69 |
2,52 ± 0,54 |
2,35 ± 0,56^ |
2,79 ± 0,65* |
2,87 ± 0,87* |
2,9 ± 1,2# |
|
ОП КМЦ, об. % |
84,2 ± 2,51 |
85,1 ± 2,7 |
60,51 ± 6,6*^ |
77,29 ± 4,8* |
81,4 ± 3,73 |
78,4 ± 5,2 |
|
ОП стромы, об. % |
15,2 ± 1,83 |
15,6 ± 2,6 |
38,9 ± 5,4* |
34,78 ± 2,0*^ |
39,1 ± 2,12* |
43,51 ± 3,8# |
Примечания: n – количество животных в группе; ОП КМЦ – объемная плотность КМЦ; ОП стромы – объемная плотность сосудов и соединительной ткани; ОЭ – овариоэктомированные; ЭСН – экспериментальная сердечная недостаточность; * – р < 0,05 при сравнении с контролем, самки; # – р < 0,05 – при сравнении с контролем, самцы; ^ – р < 0,05 при сравнении с группой ОЭ крыс с ЭСН.
Установлено, что при ЭСН происходит существенная реорганизация как КМЦ, так и стромальных элементов миокарда, что согласуется с результатами наших предыдущих исследований [2]. Так, в миокарде ЛЖ крыс-самок и самцов на 14 сут моделирования ЭСН отмечалась выраженная оксифильная мозаичность КМЦ. Встречались как интенсивно воспринимающие эозин клетки, которые чаще характеризовались контрактурным типом повреждения, так и слабоокрашенные КМЦ с разреженной саркоплазмой. В таких зонах отмечались существенные нарушения в соединительной ткани и сосудах микроциркуляторного русла (МЦР): неравномерное расширение просветов капилляр и венул, переполнение их форменными элементами крови, участки сладжа эритроцитов. Стенки таких сосудов утолщены, некоторые эндотелиоциты истончены. Такие сосуды размещались группами в местах дистрофически и гипертрофически измененных КМЦ. Наблюдался выраженный полиморфизм ядер сердечных миоцитов. Встречались зоны плазматического пропитывания межмышечной соединительной ткани, участки клеточных инфильтратов, представленные лимфоцитами, нейтрофильными гранулоцитами, группами тучных клеток, макрофагами, эритроцитами. Необходимо отменить, что данные изменения реже встречались и были значительно менее выражены в миокарде ЛЖ крыс-самок с ЭСН по сравнению с самцами с ЭСН (табл. 1).
В миокарде ОЭ крыс на 14 сут моделирования ЭСН преобладали КМЦ с существенно измененными морфологическими и тинкториальными свойствами, что больше соответствует изменениям в миокарде ЛЖ крыс-самцов с ЭСН. Наблюдался рост количества как атрофически измененных КМЦ, так и миоцитов с признаками гипертрофии. Отмечались участки с волнообразным ходом мышечных волокон, иногда их дезинтеграцией по вставочным дискам. В некоторых зонах миокард выглядел значительно разволокненным, с признаками выраженных гемодинамических нарушений. Также происходило возрастание объема соединительной ткани по сравнению с группой самок на 14 сут ЭСН без ОЭ (табл. 1). Полученные данные можно объяснить тем, что эстрогены повышают экспрессию антиапоптотических белков в миокарде при повреждении [7]. Известно также, что эндогенные эстрогены препятствуют синтезу ангиотензиногена в печени, могут вызывать снижение уровня экспрессии р38 митоген-активированной протеинкиназы – белка, который способствует возникновению и поддержанию гипертрофии миокарда, играющего значимую роль в развитии ХСН [13]. Таким образом, наши результаты показывают, что в состоянии гипоэстрогении у ОЭ крыс с ЭСН в миокарде происходит более быстрое истощение резервных механизмов, теряется возможность внутриклеточной регенерации сократительных структур КМЦ, наблюдается ремоделирование соединительно-тканного матрикса. Полученные данные свидетельствуют о том, что структурно-функциональные изменения в миокарде при ЭСН имеют явную гендерную составляющую.
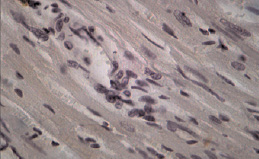
Рис. 1. Фрагмент миокарда ЛЖ овариоэктомированной крысы-самки. Окраска: иммуноцитохимическая реакция для идентификации экспрессии. МТ2-рецепторов. Ув. об. 40, ок. 10. Единичные МТ2-позитивные кардиомиоциты
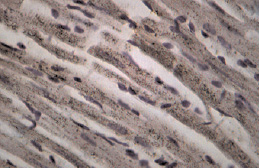
Рис. 2. Фрагмент миокарда ЛЖ крысы-самца на 14 сут моделирования ЭСН. Окраска: иммуноцитохимическая реакция для идентификации экспрессии. МТ2-рецепторов. Ув. об. 40, ок. 10. МТ2-позитивные кардиомиоциты
Таблица 2Экспрессия МТР2 в миокарде левого желудочка у интактных крыс и различных экспериментальных групп
|
Группы животных |
МТР2 |
|
Интактные самки (контроль) |
+/++ (45/55 %) |
|
Интактные самцы (контроль) |
+/++ (40/60 %) |
|
Самки ОЭ |
+/++ (80/20 %) |
|
Самки 14 сут ЭСН |
+/++/+++ (10/50/40 %) |
|
Самки ОЭ + 14 сут ЭСН |
+/++ (50/40 %) |
|
Самцы 14 сут ЭСН |
+/++/+++ (10/70/20 %) |
Примечания: ЭСН – экспериментальная сердечная недостаточность; МТР2 – мембранные мелатониновые рецепторы 2 типа.
При иммуноцитохимическом исследовании миокарда ЛЖ у крыс всех групп были обнаружены КМЦ с различной степенью активности МТ2-рецепторов (по критериям оценки экспрессии МТР2). Известно, что КМЦ и эндотелий сосудов являются органом-мишенью для мелатонина, экспрессируя оба вида мелатониновых рецепторов. При этом активация МТ1 приводит к вазоконстрикции, а МТ2 – к расширению сосудов [4]. По мнению ряда исследователей, МТ2-рецептор-опосредованная вазодилатация является эндотелийзависимой и реализуется путем повышения синтеза оксида азота, стимуляцией ацетилхолина и/или ингибированием эффектов норадреналина [3]. В миокарде контрольных групп крыс-самок и самцов преобладали участки с умеренной экспрессией МТ2 (табл. 2). У ОЭ крыс встречались участки со значимым уменьшением плотности МТР2 (рис. 1). Установлено, что избирательное усиление экспрессии MT2-рецепторов наблюдалось у крыс самок и самцов в зонах с более выраженной реорганизацией миокарда при ЭСН (рис. 2). Необходимо отметить, что у самок с ЭСН, имеющих менее выраженные морфологические изменения миокарда, чаще встречались участки с высокой степенью экспрессии МТ2-рецепторов, чем в миокарде у самцов с ЭСН. Данный факт, можно объяснить тем, что 17beta-эстрадиол по-разному влияет на функцию рецепторов мелатонина MT1 и MT2, ослабляя действие мелатонина посредством активации рецепторов MT1 и увеличивая эффекты мелатонина, повышая плотность MT2-рецепторов [10]. Повышение экспрессии MT2 в миокарде при ЭСН доказывает важную роль эндогенного мелатонина в защите сердца при повреждении. На сегодняшний день известно, что мелатонин полезен сердцу своими антиапоптотическими, антиоксидантными и сосудорасширяющими эффектами. Уменьшение количества МТ2-рецепторов у ОЭ крыс и ОЭ с ЭСН по сравнению с другими экспериментальными группами, вероятно, связано с негативным влиянием гипоэстрогении не только на миокард, но и на чувствительность МТ2-рецепторов в сердце и, возможно, на активность и концентрацию экстрапинеального мелатонина. Russel J. Reiter and Dun X. Tan в своем исследовании также отмечают различия в сосудистом ответе при введении мелатонина у крыс мужского и женского пола. Авторы считают, что циркулирующий в крови эстрадиол повышает MT2-рецептор-опосредованную вазодилатацию, что можно считать одним из механизмов влияния женских половых гормонов на активность мелатонина [15]. Полученные нами данные о половых особенностях экспрессии МТР2 в миокарде ЛЖ у крыс разного пола показывают сложные механизмы взаимодействия эстрогенов и мелатонина при ЭСН. Нарушения секреторной активности периферических звеньев синтеза мелатонина, а также изменение чувствительности МТ2-рецепторов мелатонина в миокарде в условиях гипоэстрогении, вероятно, может служить причиной развития ХСН в женской популяции.
Выводы
Резюмируя изложенное, можно заключить, что половой диморфизм в ремоделировании миокарда при ЭСН носит многофакторный характер, включая генетические отличия, связанные с X- и Y-хромосомой, активность половых гормонов или комбинацию факторов, а также, на наш взгляд, и связь с другими факторами, такими как уровень мелатонина в крови, активность мелатониновых рецепторов МТ2 в сердце. Полученные данные свидетельствуют о двойном отрицательном влиянии гипоэстрогении на миокард в условиях ЭСН у крыс-самок. Наблюдаемые изменения в экспрессии MTР2 при ЭСН показывают их прямое участие в реализации защитных механизмов мелатонина на миокард ЛЖ. В условиях снижения кардиопротективных эффектов не только эстрогенов, но и мелатонина происходит быстрое истощение компенсаторных механизмов в КМЦ, микрососудах, интерстиции с развитием выраженной структурно-функциональной реорганизации сердечной мышцы у крыс женского пола с ОЭ и ЭСН. Определение тонких механизмов взаимодействия эпифизарных и половых гормонов, а также их роль в развитии ХСН с учетом гендерных особенностей нуждаются в дальнейших исследованиях.
Рецензенты:
Стадников А.А., д.б.н., профессор, заведующий кафедрой гистологии, цитологии и эмбриологии, ГБОУ ВПО ОрГМА Минздрава России, г. Оренбург;
Железнов Л.М., д.м.н., профессор, заведующий кафедрой анатомии человека, ГБОУ ВПО ОрГМА Минздрава России, г. Оренбург.
Работа поступила в редакцию 09.09.2014.
Библиографическая ссылка
Лискова Ю.В. ГЕНДЕРНЫЕ ОСОБЕННОСТИ ЭКСПРЕССИИ МТ2-РЕЦЕПТОРОВ МЕЛАТОНИНА И РЕОРГАНИЗАЦИИ МИОКАРДА ЛЕВОГО ЖЕЛУДОЧКА КРЫС С ЭКСПЕРИМЕНТАЛЬНОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ // Фундаментальные исследования. 2014. № 10-2. С. 304-309;URL: https://fundamental-research.ru/ru/article/view?id=35337 (дата обращения: 23.12.2025).



