Широко распространенные в земной коре силикаты и алюмосиликаты, в том числе и каолиновые концентраты, являются практически неисчерпаемым источником глинозема, кремнезема, алюминия, кремния и других полезных компонентов. В последнее время важное значение приобретает переработка минерального сырья фторидными методами. Еще недавно фториды использовали в основном в атомной промышленности для производства гексафторида урана, а сейчас крупнейшей областью их использования является производство фторполимеров.
Условием рентабельности фторидных методов является многократное использование газообразного фтора, фтористого водорода и фтористоводородной кислоты, которые характеризуются множеством недостатков в экологической области и требуют повышенного обеспечения технологической безопасности. В настоящее время получило развитие фторидное обогащение силикатов и алюмосиликатов путем твердофазных реакций под действием гидродифторида (NH4HF2) и фторида (NH4F) аммония, которые в нормальных условиях представляют собой экологически и технологически безопасные вещества для приготовления реакционных смесей [5, 6].
Цель настоящей работы – разработка фторидного гидрохимического метода обогащения каолиновых концентратов в водных растворах NH4HF2 и NH4F, который позволяет проводить их переработку с комплексным извлечением различных полезных компонентов.
Экспериментальная часть
Объектами исследования являлись каолиновые концентраты марок КМ-1 и КН-73, полученные при обогащении кварц-каолин-полевошпатового сырья Чалганского месторождения (Амурская область). В состав каолиновых концентратов входит в основном минерал каолинит Al4[Si4O10](OH)8, который относится к подклассу слоистых силикатов и алюмосиликатов с добавочными анионами. Содержание глинозема в каолиновых концентратах достигает 37 мас. %, что сопоставимо с его содержанием в бокситовых рудах среднего качества [2].
Для переработки каолиновых концентратов применялись водные растворы NH4HF2 и NH4F. Реакции идут в нормальных условиях даже без перемешивания реакционной смеси, подогрев которой существенно уменьшает продолжительность фторидного обогащения. Исходные каолиновые концентраты растирали и помещали в тефлоновые тигли или чашки. Затем приливали водные растворы фторидов аммония и выдерживали в термостате при заданных температурах и временах продолжительности опытов. Полученные продукты разделяли путем фильтрования. Синтез аморфного кремнезема и гидроксида алюминия проводили в гидролизном аппарате, выполненном из фторопласта. Регенерацию аммиачной воды осуществляли в устройстве из фторопласта, восстановление NH4HF2 проводили в лабораторном выпаривателе-кристаллизаторе. Синтез глинозема осуществляли в электропечи специальной конструкции.
Исходное сырье, промежуточные фазы и конечные продукты исследовали химическим, рентгенофазовым, спектральным и электронно-микроскопическим методами анализов, применяемыми в Аналитическом центре минералого-геохимических исследований ИГиП ДВО РАН.
Перед проведением экспериментальных работ были проведены термодинамические расчеты возможности прохождения процессов гидрохимического обогащения в системах исходное сырье – водные растворы NH4HF2 или NH4F, вероятности протекания химических реакций гидролиза образовавшихся фторсолей и регенерации дополнительных компонентов. Расчеты проводили с использованием данных [3, 4]. По результатам расчетов реакции идут в сторону образования конечных продуктов (таблица).
Расчетные значения изменений энергии Гиббса (ΔG, кДж) для реакций 1–5
|
Номер реакции |
T, °C |
25 |
50 |
75 |
100 |
|
1 |
½Al4[Si4O10](OH)8 + 12NH4HF2 = 2(NH4)2SiF6 + 2(NH4)3AlF6 + 2NH3 + 9H2O |
||||
|
ΔG |
-376,0 |
-392,1 |
-408,3 |
-424,4 |
|
|
1.1 |
½Al4[Si4O10](OH)8 + 24NH4F = 2(NH4)2SiF6 + 2(NH4)3AlF6 + 14NH3 + 9H2O |
||||
|
ΔG |
-4,0 |
-8,1 |
-12,3 |
-16,4 |
|
|
2 |
(NH4)2SiF6 + 4NH4OH = SiO2↓ + 6NH4F + 2H2O |
||||
|
ΔG |
-176,8 |
-179,2 |
-181,6 |
-184,0 |
|
|
3 |
(NH4)3AlF6 + 3NH4OH = Al(OH)3↓ + 6NH4F |
||||
|
ΔG |
-43,0 |
-52,4 |
-61,7 |
-71,1 |
|
|
4 |
NH3 + H2O = NH4OH |
||||
|
ΔG |
-9,6 |
-7,5 |
-5,5 |
-3,4 |
|
|
5 |
2NH4F = NH4HF2 + NH3↑ |
||||
|
ΔG |
0,5 |
-3,7 |
-7,8 |
-12,0 |
|
Кинетическими опытами установлены оптимальные физико-химические параметры (концентрации растворов, время выдержки, температура и другие) с определением констант скоростей и энергий активации прохождения химических реакций. Расчеты термодинамических и кинетических параметров осуществлялись с применением программ, разработанных нами на основе приложения Microsoft Access 2007.
Результаты исследований и их обсуждение
Гидрохимическое выщелачивание каолиновых концентратов (реакции 1 и 1.1) проводилось при температурах 25–80 °С, исходных концентрациях (мас. %) 13,3; 26,7 и 40,0 NH4HF2 или NH4F в водных растворах и временах выдержки от 10 мин до 72 ч. Количество фторидов аммония в растворах соответствует стехиометрическому по реакциям 1 и 1.1. Обе реакции являются экзотермическими и сопровождаются выделением тепла.
В результате прохождения процессов (реакции 1 и 1.1) гексафторалюминат аммония ((NH4)3AlF6) выпадает в осадок при pH = 5,5–6,5. Анализ экспериментальных данных свидетельствует, что при температуре 25 °C и концентрации исходного водного раствора 13,3 мас. % NH4HF2 реакция 1 имеет длительный период прохождения, и превращение каолинсодержащих кислородных связей во фторидные происходит через 48 ч; для аналогичных условий (T = 25 °C и C = 13,3 мас. % NH4F) равновесие в реакции 1.1 не было достигнуто. При повышении температуры до 80 °C и 13,3 мас. % концентрации NH4HF2 максимальная степень образования гексафторалюмината аммония (более 98 % по массе) достигается через 2,5 ч, а для раствора NH4F – через 7,5 ч. Процессы характеризуются низкими константами скоростей (при Т = 80 °С Кс = 0,005519 мин–1 для реакции 1 и Кс = 0,002209 мин–1 для реакции 1.1) и высокими значениями энергии активации (Еа = 42,5 кДж/моль для реакции 1 и Еа = 49,2 кДж/моль для реакции 1.1). При температуре 80 °C повышение концентрации NH4HF2 до 26,7 и 40 мас. % приводит к замедлению процесса гидрохимического разложения каолинового концентрата и увеличению времени образования гексафторалюмината аммония – 98 % извлечение достигается через 7,5 ч при концентрации 40 мас. % NH4HF2.
После окончания процесса гидрохимического выщелачивания хорошо растворимый в воде гексафторсиликат аммония ((NH4)2SiF6) отделяется путем фильтрования от шламового осадка (NH4)3AlF6. Отделенный раствор (NH4)2SiF6 выпаривается с образованием кристаллического (NH4)2SiF6, а летучие компоненты NH3 и H2O улавливаются в устройстве, заполненном водным раствором, с образованием аммиачной воды (NH4OH) по реакции 4.
В процессе гидрохимической переработки образовавшиеся гексафторферрат ((NH4)3FeF6) и гексафтортитанат ((NH4)2TiF6) аммония, труднорастворимые в воде, выпадают в осадок и отделяются от основной реакционной массы. Примесные соединения щелочных металлов при гидрохимическом выщелачивании образуют фториды NaF и KF, хорошо растворимые в воде, которые на разных этапах также выделяются из реакционной массы.
По данным рентгенофазового, химического и спектрального анализов образовавшиеся кристаллические фазы (NH4)2SiF6 и (NH4)3AlF6 содержат незначительное количество вредных примесей - м???? 10енее 10-2 мас. % (Fe, Ti, Na, K и другие). На следующем этапе гексафторсиликат и гексафторалюминат аммония подвергаются гидролизу в воднощелочных растворах.
Водный раствор гексафторсиликата аммония (3-33 мас. % (NH4)2SiF6) взаимодействует с аммиачной водой (25 % мас. NH3) при температурах 20-80 °С до образования суспензии при pH = 8-9, которую выдерживали при заданной температуре в течение 1 ч (реакция 2). Затем суспензия путем фильтрования отделяется от раствора фторида аммония.
В результате происходит синтез нанодисперсного аморфного кремнезема высокой химической чистоты со средним размером наночастиц 17-89 нм. По данным анализа на атомно-силовом микроскопе наименьшего среднего значения (17 нм) размер наночастиц достигает в условиях синтеза при исходной концентрации 3 мас. % (NH4)2SiF6 и температуре 80 °C; наночастицы увеличиваются до средних размеров 61 и 89 нм при концентрациях 20 и 33 мас. % (NH4)2SiF6 соответственно для аналогичной температуры. При концентрации 3 мас. % (NH4)2SiF6 понижение температуры синтеза до 20 °C способствует увеличению среднего размера наночастиц до 33 нм.
В разбавленных растворах при концентрации 3 мас. % (NH4)2SiF6 и температуре 80 °C достигается максимальное извлечение аморфного кремнезёма, равное 92,36 мас. %, которое уменьшается до 71,47 мас. % при концентрации 33 мас. % (NH4)2SiF6 для аналогичной температуры. При концентрации 3 мас. % (NH4)2SiF6 и температуре 25 °С степень извлечения аморфного кремнезёма составляет 82,35 мас. %, и она уменьшается до 68,53 мас. % с повышением концентрации (NH4)2SiF6 до 20 мас. % для аналогичной температуры.
Спектральный анализ нанодисперсных порошков аморфного кремнезема подтверждает наличие в них минимального количества вредных примесей (менее 10-2 мас. %); на дифрактограммах наблюдается рентгеноаморфное гало с отсутствием кристаллических фаз. По данным химического анализа в аморфном кремнеземе содержится 99,99 мас. % SiO2 и обнаружены следы фтора.
В водном растворе (0,5-3 мас. % (NH4)3AlF6) гексафторалюминат аммония взаимодействует с аммиачной водой (25 мас. % NH3) при температурах 25-80 °C до образования осадка гидроксида алюминия при pH = 8-9, который выдерживали при заданной температуре в течение 1 ч. Затем осадок путем фильтрования отделяется от раствора фторида аммония.
В результате прохождения процесса (реакция 3) происходит образование микрочастиц гидроксида алюминия с размерами фракций от 1 до 10 мкм 2-10 %, от 10 до 50 мкм 10-60 %, микрочастицы крупнее 50 мкм - более 30 % по массе. Спектральный анализ микрочастиц гидроксида алюминия показал наличие в них минимального количества микропримесей (менее 10-1 мас. %), на дифрактограммах фиксируется кристаллическая фаза гиббсит. По данным химического анализа в гидроксиде алюминия содержится 64,98 мас. % Al2O3, суммарное содержание щелочей (Na2O + K2O) не превышает 0,1 мас. %.
В разбавленных растворах при концентрации 0,5 мас. % (NH4)3AlF6 и температуре 80 °C достигается максимальное извлечение гидроксида алюминия, равное 97,10 мас. %, которое уменьшается до 88,91 мас. % при концентрации 3 мас. % (NH4)3AlF6 для аналогичной температуры. При концентрации 0,5 мас. % (NH4)3AlF6 и температуре 25 °C степень извлечения гидроксида алюминия составляет 91,88 мас. %, и она уменьшается до 77,62 мас. % с повышением концентрации (NH4)3AlF6 до 2 мас. % для аналогичной температуры.
Математическая обработка результатов экспериментов проводилась в предположении о том, что массовая степень извлечения аморфного кремнезема или гидроксида алюминия зависит от температуры по уравнению Аррениуса [7]: а = а0 ехр(Еа/RT), а энергия активации вычислялась по формуле: Eа = R∆lnа/∆(1/Т). Средняя величина Eа составляет 1,6 кДж/моль для реакции 2 и 1,75 кДж/моль для реакции 3, что свидетельствует о протекании этих реакций в диффузионной области.
Далее гидроксид алюминия подвергается кальцинации (реакция 6) при температурах 1100-1200 °C в течение 20-40 мин с получением кондиционного металлургического глинозема, содержащего по данным рентгенофазового анализа 60-80 % γ-Al2O3 и 20-40 % αAl2O3. По данным химического, электронно-микроскопического и спектрального анализов, полученный глинозем содержит 99,8 мас. % Al2O3 и следующие примеси (мас. %): SiO2 - 0,02; Fe2O3 - 0,03; TiO2 - следы; CaO, MgO, Na2O и K2O не обнаружены, и соответствует маркам ГО и Г1 [1], и из него путем электролитического восстановления извлекается технический алюминий марок А5-А-85.
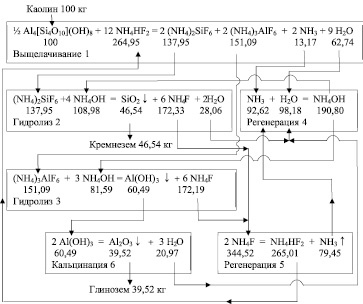
Технологическая схема материальных потоков при фторидной гидрохимической переработке каолиновых концентратов
Был произведен расчет материального баланса и определены расходные коэффициенты для всех химических соединений, участвующих в реакциях гидрохимической переработки каолинового концентрата с применением растворов гидродифторида аммония. Материальные потоки показаны на рисунке, где под формулами химических соединений приведены расходные коэффициенты на 100 кг исходного каолинового концентрата стехиометрического состава. Применяемые дополнительные компоненты (NH4HF2 и NH4OH) практически полностью регенерируются (реакции 4 и 5) и поступают на стадии переработки исходного сырья и промежуточных продуктов. Приведенная технологическая схема (рисунок) наглядно показывает замкнутость материальных потоков с высокой степенью извлечения глинозема и нанодисперсного аморфного кремнезема.
Среднемировая стоимость (долл. США/кг) каолиновых концентратов составляет 0,05, гидродифторида аммония – 2, аммиачной воды – 0,1, а конечных продуктов глинозема – 0,45 и аморфного кремнезема – 5. Из 100 кг каолинового концентрата марки КМ-1 извлекается 35 кг глинозема и 43 кг нанодисперсного аморфного кремнезема с практически полной регенерацией дополнительных компонентов.
Глинозем широко применяется для производства технического алюминия электролитическим способом, специальных видов керамики и электрокерамики, изготовления конструкционных и диэлектрических материалов для машиностроительной, энергетической и электронной отраслей промышленности. Аморфный кремнезем широко используется в резинотехнической, строительной, медицинской и косметических отраслях промышленности, для производства полупроводникового кремния, основы оптоволоконного кабеля и других целей.
Заключение
Теоретическими и экспериментальными исследованиями выявлены оптимальные физико-химические условия обогащения каолиновых концентратов в водных растворах гидродифторида и фторида аммония. В результате разработан фторидный гидрохимический метод извлечения гидроксида алюминия, глинозема и нанодисперсного аморфного кремнезема, который позволяет значительно уменьшить материальные и энергетические затраты и обеспечивает более экологически чистое и технологически безопасное получение конечной продукции по сравнению с существующими способами. При комплексной переработке каолиновых концентратов разработанный фторидный гидрохимический метод может конкурировать с широко применяемым извлечением глинозема из высококачественных бокситовых руд способом Байера.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 14-05-00239а).
Рецензенты:
Сорокин А.П., д.г.-м.н., профессор, ФГБУН «Амурский научный центр» Дальневосточного отделения Российской академии наук, г. Благовещенск;
Остапенко Н.С., д.г.-м.н., доцент, заведующий лабораторией, ФГБУН «Институт геологии и природопользования» Дальневосточного отделения Российской академии наук, г. Благовещенск.
Работа поступила в редакцию 26.08.2014.
Библиографическая ссылка
Римкевич В.С., Еранская Т.Ю., Леонтьев М.А., Гиренко И.В. РАЗРАБОТКА ФТОРИДНОГО ГИДРОХИМИЧЕСКОГО МЕТОДА ОБОГАЩЕНИЯ КАОЛИНОВЫХ КОНЦЕНТРАТОВ // Фундаментальные исследования. 2014. № 9-9. С. 2023-2027;URL: https://fundamental-research.ru/ru/article/view?id=35182 (дата обращения: 17.01.2026).



