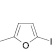
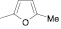
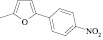
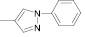
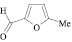
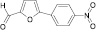
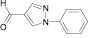
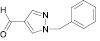
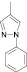Поиск новых высокоэффективных и малотоксичных лекарственных препаратов всегда остается приоритетной задачей для фармацевтической науки. Данная проблема решается либо на базе природных соединений, либо с помощью целенаправленного синтеза структур с заданной активностью. Возможности тонкого органического синтеза практически безграничны.
Многообразие и репрезентативность соединений дает возможность осуществлять целенаправленный отбор тех структур, которые обладают необходимым фармакологическим эффектом с минимальным побочным действием. Вместе с тем использование современных компьютерных технологий позволяет осуществлять прогноз как целевых структур, так и их вероятный фармакологический эффект и тем самым снизить затраты исследований.
Известно, что молекулярное моделирование с успехом используется, например, для поиска ингибиторов обратной транскриптазы ВИЧ, аминотиазольных ингибиторов циклинзависимой киназы (CDK2), поиска улучшенных аналогов антибиотика пиранмицина, а также выяснения механизма антималярийной активности артемизина [5–7].
Что касается лекарственных препаратов, то для молекулярного моделирования наиболее рационально использовать соединения, близкие по структуре к эндогенным веществам и которые ранее уже прошли фармакологическую апробацию. Накоплен значительный опыт по разнообразным путям синтеза производных хиназолин-4-онов. Целесообразность исследований в этой области, очевидно, является логическим продолжением ранее выполненных химических и фармакологических работ, поскольку этот класс соединений характеризуется широким спектром биологической активности [1–4].
Целью нашего исследования является обоснование и целенаправленный поиск гетерилпроизводных 2,3-дигидро-1H-хиназолин-4-онов.
Материалы и методы исследования
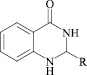
Для целенаправленного синтеза гетерилпроизводных 2,3-дигидро-1H-хиназолин-4-онов по разработанной нами методике предварительно использован логико-структурный подход, в сочетании комплексом компьютерных программ направленных на выявление возможной биологической активности, а также нами разработана методика синтеза данного класса соединений. В качестве исходных реагентов использовали амид антраниловой кислоты и различные гетероциклические альдегиды. Полученные новые целевые соединения анализировали методом ТСХ и определяли температуру плавления, а структуры полученных соединений устанавливали при помощи УФ-, ИК- и ЯМР 1H-спектроскопии.
Результаты исследования и их обсуждение
С использованием синтетической базы данных Reaxys и на основании логико-структурного подхода из массива 200 соединений нами были отобраны 7 наиболее перспективных гетерилпроизводных 2,3-дигидро-1H-хиназолин-4-она. Фармакологическая активность данных виртуальных структур была проанализирована с помощью программы PASS, что позволило выявить возможные виды активности (табл. 1).
Таблица 1
Данные по прогнозу биологической активности гетерилпроизводных 2,3-дигидро-1H-хиназолин-4-она компьютерной программой PASS, значения Pa в % характеризуют проявление вероятной активности
|
Виды биологической активности |
№ п/п |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
R |
|
|
|
|
|
|
|
|
|
Процент вероятной активности (Pa в %) |
||||||||
|
Анксиолитическая |
36,4 |
30,6 |
48,2 |
24,7 |
55,2 |
41,1 |
41,1 |
|
|
Нейропротекторная |
38,9 |
37,6 |
37,6 |
54,4 |
35,3 |
41,2 |
35,1 |
|
|
Ноотропная |
79,9 |
56,2 |
71,9 |
73,6 |
81,4 |
88,8 |
64,0 |
|
|
Противовоспалительная |
76,7 |
– |
83,3 |
73,3 |
43,6 |
84,8 |
91,8 |
|
|
Противоаллергенная |
65,8 |
18,3 |
83,3 |
73,3 |
91,6 |
84,8 |
84,2 |
|
|
Обезболивающая |
57,7 |
37,6 |
42,3 |
48,2 |
84,8 |
43,9 |
58,3 |
|
|
Антидепрессантная |
76,7 |
63,0 |
83,3 |
73,3 |
91,6 |
84,8 |
69,9 |
|
|
Противопаркинсонная |
66,2 |
– |
53,3 |
66,1 |
55,2 |
42,1 |
48,6 |
|
Как видно из представленных данных, анализируемые соединения в целом характеризуются низкой анксиолитической и нейропротекторной активностью. Соединение 5 является лидером возможного анксиолитического эффекта. Высокими значениями ноотропной, антидепрессантной, противопаркинсонной активности характеризуются все прогнозируемые соединения представленного ряда. Большинство из них характеризуется выраженной противовоспалительной, что наиболее выражено у 1, 3, 4, 6 и 7, противоаллергенной (наибольшая степень вероятности для веществ 3–7) и обезболивающей (высокие значения у 5) активностью.
Следует отметить, что данные, полученные по программе PASS, могут служить лишь ориентировочной характеристикой при отборе перспективных молекул и помогают провести первичную выборку вероятных лидеров.
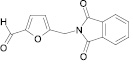
Осуществляя синтез прогнозируемых структур, мы в качестве растворителя и катализатора реакции использовали ледяную уксусную кислоту. Как известно, ядро фурана характеризуется ацидофобностью, в связи с чем реакционную смесь не следует подвергать чрезмерному нагреванию. Общая методика получения гетерилпроизводных 2,3-дигидро-1H-хиназолин-4-она заключалась во взаимодействии исходного амида антраниловой кислоты (0,01 моль) и соответствующего альдегида (0,01 моль) в 5 мл ледяной уксусной кислоты с кратковременным нагреванием при 100 °C в течение 2–10 мин, в зависимости от структуры альдегида.
Целевой продукт осаждали водой, отделяли и кристаллизовали из этанола.
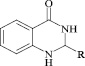
В табл. 3 представлены некоторые физико-химические параметры синтезированных нами гетерилпроизводных 2,3-дигидро-1H-хиназолин-4-она.
Таблица 2
Некоторые физико-химические свойства C-гетерилпроизводных 2,3-дигидро-1H-хиназолин-4-она
|
Номер лабораторного шифра |
R |
Выход, % |
Тпл., °С (EtOH) |
ИК-спектры, см–1 |
УФ λmax, нм |
|
|
С=О |
N–H и C=C |
|||||
|
1 QFur |
|
92 |
152–153 |
1643 |
3249 3182 1608 |
221 337 |
|
2 QFurI |
|
88 |
155–156 |
1655 |
3287 3163 1612 |
221 333 |
|
3 QFurMe |
|
90 |
159–161 |
1647 |
3283 3179 1608 |
222 315 |
|
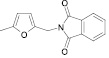
4 QFurBenzNO2 |
|
79 |
363–365 |
1674 |
3271 3128 1608 |
203 223 308 355 |
|
5 QDzPh |
|
67 |
303–305 |
1666 |
3163 3132 1597 |
208 298 |
|
6 QDzBenz |
|
62 |
308–310 |
1678 |
3175 3121 1604 |
207 335 290 |
|
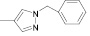
7 QFurIsoInd |
|
61 |
239–240 |
1701 1678 |
3175 3113 1604 |
218 307 |
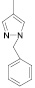
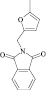
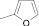
Как известно, на протекание реакции циклоконденсации существенное влияние оказывает частичный отрицательный заряд на атоме кислорода, а частичный положительный заряд на атоме азота неизменен. Чем больше δ– на атоме кислорода альдегидной группы и больше δ+ на атоме азота, тем легче протекает реакция. Исходя из этого был осуществлен расчет распределения зарядов на альдегидной группе полуэмпирическим методом (AM1) при помощи программы HyperChem версия 8.0, табл. 3.
Таблица 3
Заряды на альдегидной группе
|
№ п/п |
Альдегид |
Заряд на альдегидной группе |
||
|
C |
O |
H |
||
|
1 |
|
0,253 |
–0,279 |
0,113 |
|
2 |
|
0,251 |
–0,270 |
0,119 |
|
3 |
|
0,253 |
–0,282 |
0,112 |
|
4 |
|
0,250 |
–0,267 |
0,117 |
|
5 |
|
0,257 |
–0,294 |
0,085 |
|
6 |
|
0,257 |
–0,297 |
0,084 |
|
7 |
|
0,254 |
–0,280 |
0,112 |
Мы сочли целесообразным изучить эти закономерности и выявить взаимосвязь между практическим выходом целевого продукта и частичным отрицательным зарядом на атоме кислорода альдегидной группы. Рис. 1 и 2 наглядно отражают данную зависимость.
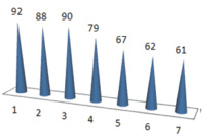
Рис. 1. Выходы целевых соединений в %
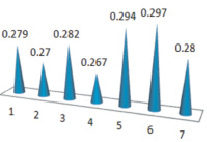
Рис. 2. Частичный отрицательный заряд на атоме кислорода альдегидной группы исходных альдегидов
Сопоставляя между собой данные двух графиков и проводя корреляцию между ними, можно сделать вывод о том, что имеет место зависимость между частичным отрицательным зарядом на атоме кислорода и выходом целевых соединений и это подтверждается для соединений 1, 2, 3, 4. Снижение выходов для соединений 5–7 можно объяснить вызванными из-за присутствия в молекулах исходных альдегидов, фенильных, бензильных заместителей.
Во втором сообщении нами будут приведены данные расчетов сродства лигандов к исследуемым рецепторам и представлены данные скрининговых фармакологических исследований прогнозируемых видов фармакологической активности.
Выводы
- Осуществлен компьютерный прогноз гетерилпроизводных 2,3-дигидро-1H-хиназолин-4-онов.
- Получены 6 новых соединений, структуры которых доказаны современными физико-химическими методами.
- Выявлена взаимосвязь между частичным отрицательным зарядом на атоме кислорода альдегидной группы исходных альдегидов и выходами целевых соединений.
Рецензенты:
Оганесян Э.Т., д.фарм.н., профессор, заведующий кафедрой органической химии, Пятигорский медико-фармацевтический институт, филиал ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Кодониди И.П., д.фарм.н., доцент кафедры органической химии, Пятигорский медико-фармацевтический институт, филиал ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.
Работа поступила в редакцию 23.07.2014.
Библиографическая ссылка
Бандура А.Ф. НОВЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ 2,3-ДИГИДРО-1H-ХИНАЗОЛИН-4-ОНА // Фундаментальные исследования. 2014. № 9-6. С. 1255-1259;URL: https://fundamental-research.ru/ru/article/view?id=35049 (дата обращения: 05.01.2026).