Проблеме переработки биомассы с целью получения биотоплива в мире уделяется значительное внимание [3]. Основным продуцентом биоэтанола в России являются дрожжи Saccharomyces сerevisiae, применяемые в производстве этилового спирта как на пищевом сырье, так и на гидролизных средах. Однако сахаромицеты не сбраживают в этанол пентозы, которых в гидролизатах может быть значительное количество (это зависит от вида сырья и способа получения гидролизата). Известно несколько видов дрожжей, сбраживающих ксилозу в этанол: Pachysolеn tannophillus, Candida shehatae, Candida tropicalis, Pichia stipitis и другие [1, 5].
Для выбора продуцента биоэтанола необходимо предварительное определение удельной скорости прироста биомассы дрожжей и скорости утилизации субстрата на синтетических средах. Целью данной работы было получение биоэтанола на среде ферментативного гидролизата целлюлозы мискантуса с помощью продуцентов Pachysolen tannophilus и Saccharomyces сerevisiae и обоснование выбора продуцента.
Материалы и методы исследования
Штамм Pachysolen tannophilus ВКПМ Y-1532 был получен из Всероссийской коллекции промышленных микроорганизмов (ВКПМ, г. Москва) и предназначался для производства спирта на гидролизатах древесины. Штамм Saccharomyces сerevisiae ВКПМ Y-1693 был выделен из ферментера Котласского целлюлозно-бумажного комбината Архангельской области и использовался для производства этанола на сульфитных щелоках.
На первом этапе изучалась биосинтетическая активность штаммов на синтетических средах. Использовалась полная дрожжевая среда, рекомендованная ВКПМ для дрожжей рода Pachysolen (ПДС-1) и её модификации (табл. 1).
В стерильные среды вносился инокулят сахаромицетов или пахизолена в количестве 5 %. Культивирование проводилось в анаэробных условиях при температуре 28 °С и рН 4,5.
Таблица 1
Состав синтетических сред
|
Компонент среды |
Дозировка компонентов, г / 1000 мл |
||
|
ПДС-1 |
ПДС-2 |
ПДС-3 |
|
|
Глюкоза |
20 |
30 |
– |
|
Ксилоза |
– |
– |
20 |
|
Пептон |
10 |
14 |
10 |
|
Дрожжевой экстракт |
5 |
7 |
5 |
На втором этапе в качестве питательной среды был использован ферментативный водный гидролизат технической целлюлозы энергетического растения Мискантус китайский, полученной азотнокислым способом на опытном производстве ИПХЭТ СО РАН [2]. Гидролизат представлял собой янтарно-жёлтую мутноватую жидкость с характерным кисловатым запахом мискантуса. Редуцирующие вещества (РВ) гидролизата представлены преимущественно глюкозой: всего РВ – 51,2 ± 0,5 г/л, в том числе ксилозы 1,7 ± 0,2 г/л; рН 4,5. Гидролизат не является полноценной средой для дрожжей, ранее было установлено, что в него дополнительно следует вносить азот в количестве, пропорциональном концентрации РВ в полученном гидролизате [4]. Поэтому в гидролизат был внесен сульфат аммония в количестве 10 г/л. Гидролизат был пастеризован при 100 °С без выдержки, охлаждён до 30 °С и направлен на спиртовое брожение. Было проведено 4 варианта биосинтеза этанола с использованием следующих продуцентов, вносимых в питательную среду в количестве 5 %:
А – P. tannophilus ВКПМ Y-1532;
Б – S. сerevisiae ВКПМ Y-1693, продолжительность культивирования 3 суток; после этого внесен P. tannophilus ВКПМ Y-1532;
В – одновременно внесены P. tannophilus ВКПМ Y-1532 и S. сerevisiae ВКПМ Y-1693;
Г – S. сerevisiae ВКПМ Y-1693.
Брожение проводилось в анаэробных условиях при рН 4,5 и температуре 28 °С, продолжительность брожения для различных вариантов составила от 7 до 10 суток.
Общее количество дрожжевых клеток в бражках определялось прямым подсчётом на камере Горяева. Редуцирующие вещества (РВ) в средах определялись спектрофотометрическим методом (спектрофотометр «UNICO UV-2804», США) в пересчете на глюкозу, для ПДС-3 – в пересчёте на ксилозу. Концентрация ксилозы в ферментативном гидролизате определялась железоорсиновым способом. Крепость бражек (объемная доля спирта) определялась ареометром для спирта в дистилляте, полученном после предварительной перегонки спирта из бражки согласно ГОСТ Р 51135-98-2003.
Результаты исследования и их обсуждение
Кинетика утилизации субстратов на синтетических глюкозных средах
Основное потребление субстрата P. tannophilus ВКПМ Y-1532 произошло через трое суток брожения на ПДС-1 и через пять на ПДС-2 (рис. 1).
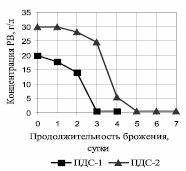
Рис. 1. Зависимость концентрации РВ от продолжительности брожения P. tannophilus на глюкозных средах
Скорость сбраживания глюкозы была рассчитана по формуле
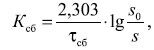
где Ксб – константа скорости сбраживания, ч–1; τсб – фиксируемый период времени от начала брожения; s0 и s – концентрация РВ в начале брожения (в сусле) и во время τсб (в бражке) [6].
Для ПДС-1 Ксб составляет 0,049 ч–1, для ПДС-2 – 0,033 ч–1, что свидетельствует о субстратном ингибировании метаболизма дрожжей при повышении концентрации субстрата всего на 10 г/л. Получен хороший выход этанола: на ПДС-1 через четверо суток синтезируется 1,1 об. % этанола, что соответствует выходу 85 % от теоретического; на ПДС-2 через 7 суток синтезируется 1,7 об. % этанола, что соответствует выходу 88 %.
Аналогичным образом проведены опыты по сбраживанию синтетических сред с помощью продуцента S. сerevisiae ВКПМ Y-1693. Получены типичные для данного рода дрожжей кривые прироста биомассы и утилизации субстрата. Результаты определения кинетических параметров приведены в табл. 2.
Таблица 2
Кинетика прироста биомассы дрожжей и утилизации субстрата и расчет экономического коэффициента брожения для продуцентов P. tannophilus ВКПМ Y-1532 и S. сerevisiae ВКПМ Y-1693
|
Показатель |
P. tannophilus ВКПМ Y-1532 |
S. сerevisiae ВКПМ Y-1693 |
||
|
ПДС-1 |
ПДС-2 |
ПДС-1 |
ПДС-2 |
|
|
Удельная скорость прироста биомассы μ, ч–1 |
0,047 |
0,036 |
0,086 |
0,124 |
|
Время удвоения, ч |
14,8 |
19,2 |
8,1 |
5,6 |
|
Константа сбраживания сахара, Ксб, ч–1 |
0,049 |
0,033 |
0,068 |
0,077 |
|
Конечная концентрация этанола в бражке, об. % |
1,10 |
1,70 |
1,25 |
1,70 |
|
Выход этанола, % от теоретического |
85 |
88 |
92 |
88 |
|
Экономический коэффициент брожения, YP/S |
0,550 |
0,567 |
0,625 |
0,567 |
Если сравнить кинетику прироста биомассы дрожжей и утилизации субстрата для дрожжей P. tannophilus ВКПМ Y-1532 и S. сerevisiae ВКПМ Y-1693 при концентрации субстрата 20 г/л, то удельная скорость прироста биомассы сахаромицетов выше в 1,8 раза, чем пахизолена, а скорость сбраживания глюкозы выше в 1,4 раза.
При концентрации 30 г/л различие скоростей прироста биомассы дрожжей и утилизации субстрата для этих культур будет ещё выше. На повышение концентрации субстрата дрожжи реагируют неодинаково: для S. сerevisiae ВКПМ Y-1693 повышается и скорость прироста биомассы (в 1,4 раза), и скорость сбраживания глюкозы (в 1,2 раза); для P. tannophilus ВКПМ Y-1532 наблюдается субстратное ингибирование: скорость прироста биомассы дрожжей снижается в 1,3 раза; скорость сбраживания – в 1,5 раза.
Таким образом, формальный анализ кинетики прироста биомассы дрожжей и утилизации субстрата продуцентами P. tannophilus ВКПМ Y-1532 и S. сerevisiae ВКПМ Y-1693 позволяет сделать следующие выводы: при совместном использовании данных штаммов концентрация дрожжей P. tannophilus ВКПМ Y-1532 должна быть в два раза выше, чем S. сerevisiae ВКПМ Y-1693, а внесены они должны быть в конце брожения, при снижении концентрации субстрата до 20 г/л.
Определение биосинтетической способности продуцентов на синтетической ксилозной среде
В синтетические ксилозные среды (ПДС-3) было внесено 20 % инокулята дрожжей рода Pachysolen или Saccaromyces. При культивировании на ксилозной среде S. сerevisiae ВКПМ Y-1693 были подтверждены литературные данные: штамм не способен к утилизации ксилозы.
Концентрация редуцирующих веществ на 7 сутки культивирования P. tannophilus составила 13,1 г/л, то есть утилизация ксилозы штаммом идет крайне медленно, выход этанола составил всего 23 %. Из литературных данных известно, что 50 % ксилозы метаболизируется P. tannophilus в этанол и 50 % – в ксилит [1]. Таким образом, эффективность синтеза этанола на ксилозной синтетической среде штаммом ВКПМ Y-1532 крайне низкая.
Определение биосинтетической способности продуцентов на среде ферментативного гидролизата целлюлозы мискантуса
Убыль редуцирующих веществ в процессе брожения гидролизатов представлена на рис. 2.
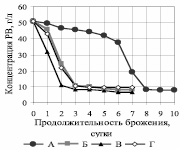
Рис. 2. Зависимость концентрации редуцирующих веществ от продолжительности брожения на среде ферментативного гидролизата
Для вариантов Б и Г кривые фактически совпадают, сахар утилизируется через 3 суток. Таким образом, внесение в среду P. tannophilus после утилизации S. сerevisiae основной части РВ (вариант Б) не привело к положительным результатам. При совместном использовании культур (вариант В) утилизация сахаров интенсифицируется и наблюдается через двое суток. При использовании только P. tannophilus (вариант А) скорость сбраживания сахаров минимальна: их утилизация происходит только на 8 сутки.
В табл. 3 представлены результаты брожения. Скорость сбраживания РВ через трое суток продуцентом P. tannophilus ВКПМ Y-1532 в 13 раз ниже, чем S. сerevisiae ВКПМ Y-1693. При совместном использовании культур скорость сбраживания увеличивается в 1,1 раза по сравнению с S. сerevisiae ВКПМ Y-1693.
Таблица 3
Кинетика утилизации субстрата и расчет экономического коэффициента брожения для продуцентов P. tannophilus ВКПМ Y-1532 и S. сerevisiae ВКПМ Y-1693 на среде ферментативного гидролизата
|
Показатель |
Варианты |
|||
|
А |
Б |
В |
Г |
|
|
Константа сбраживания сахара через трое суток брожения, Ксб, ч–1 |
0,004 |
0,050 |
0,059 |
0,052 |
|
Остаточная концентрация РВ в гидролизате после брожения, г/л |
9,5 |
8,0 |
6,7 |
8,0 |
|
Конечная концентрация этанола в бражке, об. % |
1,4 |
2,0 |
2,0 |
2,0 |
|
Выход этанола, % от теоретического |
44,0 |
62,5 |
62,5 |
62,5 |
|
Экономический коэффициент брожения, YP/S |
0,270 |
0,390 |
0,390 |
0,390 |
Бродильная активность P. tannophilus достаточно низкая: через 10 суток культура синтезирует 1,4 об. % этанола или 44 % от теоретического при полной утилизации РВ гидролизата. В остальных вариантах получено 2 об. % этанола, причём дображивание шло крайне медленно. Таким образом, совместное использование штаммов нецелесообразно, так как оно не приводит к повышению выхода биоэтанола. Кроме того, усложняется технология получения биоэтанола, так как требуется проведение дополнительных работ на стадии культивирования засевных дрожжей.
Полученная крепость бражки соответствует выходу этилового спирта 62,5 % от теоретического, или 40 л из 100 кг сбраживаемых сахаров. Выход этанола меньше, чем на гидролизных заводах (55–58 л из 100 кг сбраживаемых сахаров [5]), что объясняется неполноценностью состава питательной среды. Можно предположить, что мискантус как сырье содержит компоненты, частично ингибирующие активность зимазного комплекса дрожжей.
Выводы
Сравнение кинетики прироста биомассы дрожжей и утилизации субстрата для дрожжей P. tannophilus ВКПМ Y-1532 и S. сerevisiae ВКПМ Y-1693 при концентрации субстрата 20 г/л показывает, что удельная скорость прироста биомассы сахаромицетов выше в 1,8 раза, чем пахизолена, а скорость сбраживания глюкозы выше в 1,4 раза. При повышении концентрации субстрата до 30 г/л для S. сerevisiae ВКПМ Y-1693 повышается и скорость прироста биомассы (в 1,4 раза), и скорость сбраживания глюкозы (в 1,2 раза); для P. tannophilus ВКПМ Y-1532 наблюдается субстратное ингибирование.
Получен биоэтанол на среде ферментативного гидролизата с помощью продуцентов Pachysolen tannophilus и Saccharomyces сerevisiae. Выход этанола составил для продуцента P. tannophilus ВКПМ Y-1532 44 % от теоретического, а для S. сerevisiae ВКПМ Y-1693 – 62,5 %. При совместном применении культур скорость сбраживания увеличивается в 1,1 раза по сравнению с S. сerevisiae ВКПМ Y-1693, но повышения выхода этанола не наблюдается, поэтому совместное использование штаммов нецелесообразно. Таким образом, для получения биоэтанола на среде ферментативного гидролизата мискантуса рекомендовано применение штамма S. сerevisiae ВКПМ Y-1693.
Рецензенты:
Новожилов Е.В., д.т.н., профессор, заведующий кафедрой биотехнологии и биотехнических систем, Северный (Арктический) федеральный университет, г. Архангельск;
Разговоров П.Б., д.т.н., профессор кафедры технологии пищевых продуктов и биотехнологии, Ивановский государственный химико-технологический университет, г. Иваново;
Сечин А.И., д.т.н., профессор, Федеральное агентство по образованию, НИУ РЭТ Томский политехнический университет, г. Томск.
Работа поступила в редакцию 15.07.2014.
Библиографическая ссылка
Байбакова О.В. СБРАЖИВАНИЕ ФЕРМЕНТАТИВНОГО ГИДРОЛИЗАТА ЦЕЛЛЮЛОЗЫ МИСКАНТУСА С ПОМОЩЬЮ PACHYSOLEN TANNOPHILUS Y-1532 И SACCHAROMYCES CEREVISIAE Y-1693 // Фундаментальные исследования. 2014. № 9-5. С. 949-953;URL: https://fundamental-research.ru/ru/article/view?id=34995 (дата обращения: 17.01.2026).



