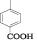
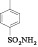
В предыдущей работе было показано, что N-гетерил-4-оксопиримидины обладают антиаллергической активностью, а удлинение цепи сопряжения путем введения стирильного фрагмента приводит к усилению фармакологического эффекта [5].
Продолжая эти исследования, нам представлялось интересным выявить вклад стирильного фрагмента в проявление психотропного действия 2-стирилпроизводных 4-оксопиримидина. Можно предположить, что формирование сопряженной системы путем введением стирильного фрагмента позволит усилить лиганд-рецепторное взаимодействие, что может привести к увеличению влияния моделируемых соединений на ЦНС.
С целью подтверждения целесообразности такого подхода к конструированию структур, обладающих нейротропной активностью, нами на основе логико-структурного подхода формировались группы прогнозируемых соединений, а затем осуществлялся их анализ с помощью программы PASS [1–4].
Наиболее перспективные из веществ получены взаимодействием N-замещенных 4-оксопиримидинов с 2-гидроксибензальдегидом в модифицированных условиях синтеза стирильных производных. Суть модификации заключается в использовании каталитических количеств диметилсульфоксида.
Достоверность молекулярного конструирования нейропротекторов в ряду стирильных производных 4-оксопиримидина подтверждена результатами фармакологических исследований анксиолитической активности целенаправленно синтезированных веществ. Результаты первичного фармакологического скрининга позволили выявить соединения-лидеры для последующих углубленных нейрофармакологических исследований.
Целью данной работы является молекулярное моделирование и целенаправленный синтез 2-стирилпроизводных 4-оксопиримидина, обладающих, выраженной анксиолитической активностью.
Материалы и методы исследования
Формирование массива прогнозируемых структур осуществлялось на основе логико-структурного подхода и ранее выявленных фармакофорных фрагментов.
Компьютерный анализ биологической активности с использованием программы PASS основан на сравнении виртуальной структуры с обучающей выборкой, содержащей значительные массивы БАС, для которых описана биологическая активность. Алгоритм работы PASS предполагает анализ структурных дескрипторов многоуровневых атомных окрестностей.
Вероятность (Pa, %) проявления различных видов биологической активности в наших исследованиях определялась с помощью программы PASS (Version 2006–09–28).
Химическая часть
Общая методика синтеза 2-стирилпроизводных 4-оксопиримидина.
Смесь (0,01 моль) соответствующего N1-арилзамещенного 2,6-диметил-5-фенил-1Н-пиримидин-4-она и 1,2 мл (0,01 моль) 2-гидроксибензальдегида растворяют в смеси 2 мл ДМСО и 3 мл этанола (6 мл ДМСО и 6 мл этанола для получения соединения (7)), кипятят 1,5 часа. Охлаждают до комнатной температуры, продукт реакции высаживают 100 мл диэтилового эфира, отфильтровывают, сушат на воздухе и кристаллизуют из этанола.
1-(4-бромофенил)-2-[2-(2-гидроксифенил)винил]-6-метил-5-фенил-1H-пиримидин-4-он (1). Выход 90,0 %. Вещество представляет собой желтоватый мелкокристаллический порошок. Тпл = 257-258 °С. 1Н ЯМР спектр (ДМСО-d6), δ, м.д. 1,69 (c, 3H, CH3); 6,50 (д, 1H,CH); 6,77-6,85 (кв, 2H, Ar); 7,13-7,43 (м, 7H, Ar); 7,57-7,62 (кв, 2H, Ar); 7,83-7,87 (кв, 2H, Ar); 8,0 (д, 1H CH); 10,20 (с, 1H, OH).
1-(4-ацетилфенил)-2-[2-(2-гидроксифенил)винил]-6-метил-5-фенил-1H-пиримидин-4-он (2). Выход 91,8 %. Вещество представляет собой желтоватый мелкокристаллический порошок. Тпл = 276-277 °С. 1Н ЯМР спектр (ДМСО-d6), δ, м.д. 1,73 (c, 3H, CH3); 2,75 (c, 3H, COCH3); 6,47 (д, 1H,CH); 6,71-8,25 (м, 13H, Ar); 8,05 (д, 1H CH); 10,15 (с, 1H, OH).
2-[2-(2-гидроксифенил)винил]-6-метил-5-фенил-1-о-толил-1H-пиримидин-4-он (3). Выход 76,5 %. Вещество представляет собой желтоватый мелкокристаллический порошок. Тпл = 243-244 °С. 1Н ЯМР спектр (ДМСО-d6), δ, м.д. 1,66 (c, 3H, CH3); 2,11 (c, 3H, CH3); 6,41 (д, 1H,CH); 6,72-6,83 (кв, 2H, Ar); 7,11-7,17 (кв, 2H, Ar); 7,32-7,56 (м, 9H, Ar); 8,05 (д, 1H CH); 10,18 (с, 1H, OH).
2-[2-(2-гидроксифенил)винил]-6-метил-5-фенил-1-п-толил-1H-пиримидин-4-он (4). Выход 65,9 %. Вещество представляет собой желтоватый мелкокристаллический порошок. Тпл = 271-272 °С. 1Н ЯМР спектр (ДМСО-d6), δ, м.д. 1,69 (c, 3H, CH3); 2,42 (c, 3H, CH3); 6,48 (д, 1H,CH); 6,73-6,84 (кв, 2H, Ar); 7,12-7,27 (кв, 2H, Ar); 7,29-7,45 (м, 9H, Ar); 8,02 (д, 1H CH); 10,16 (с, 1H, OH).
3-{2-[2-(2-гидроксифенил)винил]-6-метил-4-оксо-5-фенил-4H-пиримидин-1-ил}бензойная кислота (5). Выход 70,4 %. Вещество представляет собой желтоватый мелкокристаллический порошок. Тпл = 309-310 °С. 1Н ЯМР спектр (ДМСО-d6), δ, м.д. 1,69 (c, 3H, CH3); 6,45 (д, 1H,CH); 6,72-6,82 (кв, 2H, Ar); 7,14 (д, 2H, Ar); 7,30-7,43 (м, 5H, Ar); 7,74-8,15 (м, 4H, Ar); 8,16 (д, 1H,CH); 10,16 (с, 1H, OH); 13,50 (с, 1H, COOH).
4-{2-[2-(2-гидроксифенил)винил]-6-метил-4-оксо-5-фенил-4H-пиримидин-1-ил}бензойная кислота (6). Выход 80,0 %. Вещество представляет собой желтоватый мелкокристаллический порошок. Тпл = 367-368 °С. 1Н ЯМР спектр (ДМСО-d6), δ, м.д. 1,70 (c, 3H, CH3); 6,48 (д, 1H,CH); 6,72-6,82 (кв, 2H, Ar); 7,13 (д, 2H, Ar); 7,26-7,43 (м, 5H, Ar); 7,73-8,15 (м, 4H, Ar); 8,33 (д, 1H,CH); 10,16 (с, 1H, OH); 13,40 (с, 1H, COOH).
4-{2-[2-(2-гидроксифенил)винил]-6-метил-4-оксо-5-фенил-4H-пиримидин-1-ил}бензолсульфонамид (7). Выход 80,0 %. Вещество представляет собой желтоватый мелкокристаллический порошок. Тпл = 323-324 °С. 1Н ЯМР спектр (ДМСО-d6), δ, м.д. 1,69 (c, 3H, CH3); 6,37 (д, 1H,CH); 6,72-6,85 (кв, 2H, Ar); 7,01-7,19 (кв, 2H, Ar); 7,28-7,44 (м, 5H, Ar); 7,83-8,07 (м, 4H, Ar); 8,19 (д, 1H, CH); 8,51 (д, 2H, NH2); 10,20 (с, 1H, OH).
Cтроение синтезированных соединений подтверждали методами 1Н ЯМР, ИК- и УФ-спектроскопии [4].
Электронные спектры поглощения измерены на спектрофотометре СФ-103 в кварцевых кюветах толщиной 1 см, а ИК-спектры - на Varian Excalibur 3100 FT-IR, а Varian Excalibur 3100 FT-IR, методом НПВО (нарушенное полное внутреннее отражение кристалла селенида цинка).
Спектры Н1ЯМР регистрировали в DMSO-D6, на приборе Brucker-300Mhz при 20 °С., в качестве внутреннего стандарта - ГМДС. Положение сигналов определялось по шкале δ в м.д., с указанием интенсивности и мультиплетности. Все реактивы соответствовали маркам «Ч.Д.А.» и «Х.Ч.».
Фармакологическая часть
Исследование выполнено на крысах-самцах, линии Wistar, массой 160–180 г, содержавшихся в стандартных условиях вивария со свободным доступом к воде и пище при естественном световом режиме. Соединения вводились животным в дозе 50 мг/кг, в виде равномерной взвеси в 5 %-м растворе лецитина. Введение соединений и раствора лецитина контрольным животным проводилось однократно перорально за 45 минут до выполнения поведенческих тестов.
Метод «открытое поле» позволяет изучить спонтанную двигательную активность, ориентировочно–исследовательское поведение и уровень эмоциональности животных. Тестируемое животное помещалось в центральный квадрат площадки хвостом к экспериментатору. В течение трёх минут наблюдения за животным регистрировали следующие показатели: число пересечённых квадратов (горизонтальная двигательная активность), число вставаний на задние лапы и заглядываний в отверстия (ориентировочно-исследовательская активность), количество выходов в центральную зону, число актов груминга и фекальных болюсов (эмоциональный фактор).
Метод приподнятого крестообразного лабиринта (ПКЛ) позволяет оценить транквилизирующее (антифобическое) действие изучаемых соединений. Методика основана на предпочтении грызунами закрытых рукавов (тёмных нор), естественного страха нахождения на открытых площадках и падения с высоты. Животное помещают в ПКЛ на центральную площадку, головой к открытому рукаву и в течение 3 минут регистрируют время пребывания животных в открытых, закрытых рукавах, а также на центральной площадке, количество заходов в открытые и закрытые рукава, количество стоек в них.
Определение острой токсичности «соединений–лидеров» по методу Кербера проводилось по группам веществ в зависимости от их химического строения. Крысам внутрибрюшинно вводили производные 4-оксопиримидина.
Результаты исследования и их обсуждение
В табл. 1 приведены данные прогноза биологической активности наиболее перспективных производных 2-стирилпроизводных 4-оксопиримидина.
Таблица 1
Прогноз биологической активности 2-стирилпроизводных 1,4-дигидро-4-оксопиримидина компьютерной программой PASS, значения Pa в %
|
Виды биологической активности |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
|
|
|
|
|
|
|
|
Значение Ра в % |
|||||||
|
Агонист целостности мембран |
80,3 |
91,1 |
85,7 |
85,7 |
81,6 |
83,1 |
67,5 |
|
Нейропротекторная |
41,7 |
44,0 |
55,6 |
52,9 |
52,9 |
52,1 |
49,5 |
|
Агонист D4 дофаминовых рецепторов |
– |
– |
– |
31,7 |
– |
– |
83,9 |
|
Анксиолитическая |
55,0 |
59,2 |
62,5 |
62,0 |
58,5 |
59,2 |
56,5 |
|
Противовоспалительная |
45,8 |
41,5 |
47,7 |
44,1 |
54,9 |
56,4 |
42,1 |
Из табл. 1 видно, что все прогнозируемые соединения являются агонистами целостности мембран, причем наиболее выражена данная активность у 2-стирилпроизводного 4-оксопиримидина с остатком ацетофенона (2). Наибольшей вероятностью проявления нейропротекторной активности характеризуются толильные и карбоксифенильные производные. Последние структуры могут проявлять значительную противовоспалительную активность.
Соединение, содержащее остаток стрептоцида (7), с высокой вероятностью прогнозируется как агонист D4-дофаминового рецептора.
На основании виртуального скрининга можно предположить, что исследуемые вещества с большой вероятностью способны проявлять биологическую активность в отношении ЦНС.
Одним из способов удлинения цепи сопряжения является введение стирильного фрагмента в положение 2 гетероциклического кольца.
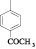
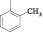
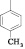
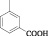
Для достижения этой цели мы осуществили конденсацию N-арил-4-оксопиримидинов с 2-гидроксибензальдегидом. Реакцию проводили кипячением исходных соединений в среде этанол – ДМСО (3:2), выходы продуктов (1–7) составили 65–92 % (рисунок).
ИК–спектры 2-стирилпроизводных характеризуются появлением дополнительной полосы С = С поглощения в интервалах 1620–1590 и 990–955 см–1. По нахождению полос поглощения в области 990–955 см–1 возможно предположить трансоидную конфигурацию двойной связи стирильного фрагмента.
Влияние 2-стирилпроизводных 4-оксо-1,4-дигидропиримидина на поведение животных в тесте «открытое поле» представлено в табл. 2.
Исходя из данных табл. 2, видно, что максимальную активность проявляет соединение 2-[2-(2-гидроксифенил)винил]-6-метил-5-фенил-1-о-толил-1H-пиримидин-4-он (3).
Влияние 2–стирилпроизводных 4-оксо-1,4-дигидропиримидина на поведение животных в тесте «приподнятый крестообразный лабиринт» представлено в табл. 3.
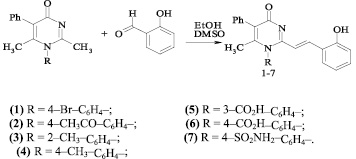
Схема взаимодействия 4-оксопиримидинов с 2-гидроксибензальдегидом
Таблица 2
Влияние 2-стирилпроизводных 1,4-дигидро-4-оксопиримидина на поведение животных в тесте «открытое поле»
|
Вещество |
Число пройденных квадратов, Δ % |
Число заглядываний, Δ % |
Число стоек, Δ % |
Груминг, Δ % |
Время в центральных квадратах, Δ % |
|
Контроль |
9,5 ± 4,5 100,0 |
5,0 ± 3,0 100,0 |
2,6 ± 0,81 100,0 |
2,0 ± 1,0 100,0 |
2,2 ± 1,2 100,0 |
|
(2) |
8,2 ± 3,31 –13,68 |
4,2 ± 1,16 –16,0 |
3,2 ± 1,77 23,08 |
10,2 ± 3,92 410,0 |
4,4 ± 3,19 120,0 |
|
(3) |
14,8 ± 3,06 55,79 |
2,0 ± 1,05 –60,0 |
7,0 ± 3,74 169,23 |
5,6 ± 2,77 180,0 |
17,2 ± 5,83 681,82 |
|
(4) |
8,4 ± 2,04 –11,58 |
4,4 ± 1,63 –12,0 |
2,8 ± 0,8 7,69 |
9,8 ± 5,01 390,0 |
9,0 ± 3,49 350,0 |
|
(5) |
9,5 ± 5,5 0,0 |
8,0 ± 5,0 60,0 |
2,25 ± 0,63 –13,46 |
23,67 ± 18,68 1083,50 |
8,0 ± 8,0 263,63 |
|
(6) |
8,0 ± 2,0 –15,79 |
1,5 ± 0,5 –70,0 |
3,0 ± 0,71 15,38 |
7,0 ± 4,04 250,0 |
2,6 ± 0,88 18,18 |
|
(7) |
7,6 ± 3,87 –20,0 |
1,8 ± 0,8 –64,0 |
2,0 ± 0,84 –23,08 |
9,2 ± 7,75 360,0 |
1,4 ± 0,4 –30,0 |
Таблица 3
Влияние 2–стирилпроизводных 1,4-дигидро-4-оксопиримидина на поведение животных в тесте «приподнятый крестообразный лабиринт»
|
Вещество |
Время в закр. рук., Δ % |
Время в центр. квадрате, Δ % |
Время в откр.рук., Δ % |
Стойки, Δ % |
Свешивания, Δ % |
Груминг, Δ % |
|
Контроль |
127,2 ± 34,12 100,0 |
11,6 ± 7,03 100,0 |
2,4 ± 2,4 100,0 |
7,2 ± 2,24 100,0 |
0,4 ± 0,4 100,0 |
6,6 ± 2,27 100,0 |
|
(2) |
136,2 ± 20,67 7,08 |
12,8 ± 11,30 10,34 |
31,0 ± 13,261 191,67 |
9,2 ± 7,96 27,78 |
1,0 ± 0,631 50,0 |
1,0 ± 1,0* –84,85 |
|
(3) |
143,6 ± 22,84 12,89 |
30,2 ± 19,611 60,34 |
5,4 ± 2,77 125,0 |
6,8 ± 2,96 –5,56 |
0,2 ± 0,2 –50,0 |
0,0* 0,0 |
|
(4) |
116,6 ± 33,19 –8,33 |
40,6 ± 26,692 50,0 |
22,8 ± 11,43 850,0 |
16,8 ± 8,0 3133,33 |
0,8 ± 0,58 100,0 |
0,4 ± 0,4* –93,94 |
|
(5) |
134,6 ± 34,1 95,82 |
23,4 ± 17,38 100,72 |
22,0 ± 17,048 16,67 |
1,4 ± 0,87* –80,56 |
0,2 ± 0,2 –50,0 |
0,4 ± 0,4* –93,94 |
|
(6) |
109,4 ± 42,65 –13,99 |
14,2 ± 10,272 2,41 |
56,4 ± 34,862 250,0 |
1,8 ± 1,36 –75,0 |
0,2 ± 0,2 –50,0 |
0,0* 0,0 |
|
(7) |
127,8 ± 34,94 0,47 |
13,2 ± 9,64 13,79 |
39,0 ± 25,631 525,0 |
3,2 ± 1,71 –55,56 |
1,8 ± 1,8 350,0 |
2,6 ± 2,14 –60,61 |
Из табл. 3 видно, что соединение 4-{2-[2-2-гидроксифенил)винил]-6-метил-4-оксо-5-фенил-4H-пиримидин-1-ил}бензойная кислота (6) увеличило время пребывания в открытых рукавах установки в 23,5 раза относительно значений показателя контрольной группы.
При введении 2-[2-(2-гидроксифенил)винил]-6-метил-5-фенил-1-o-толил-1H-пиримидин-4-она (3) время в центральном квадрате и открытых рукавах возросло в 2 раза. Выявлено, что 2-[2-(2-гидроксифенил)винил]-6-метил-5-фенил-1-п-толил-1H-пиримидин-4-он (4) увеличивает время пребывания животных в центральном квадрате в 3 раза.
Введение 4-{2-[2-(2-гидроксифенил)винил]-6-метил-4-оксо-5-фенил-4H-пиримидин-1-ил}бензолсульфонамида (7) привело к увеличению времени, проведенному в центральных квадратах, в 4 раза и открытых рукавах в 9,3 раза относительно значений контрольной группы.
Выводы
1. Исследование острой токсичности 2-стирилпроизводных 4-оксо-1,4-дигидропиримидина показало, что синтезированные соединения относятся к веществам IV и V классов токсичности по Сидорову, то есть являются малотоксичными или практически нетоксичными.
2. В результате фармакологического эксперимента выявлено, что снижается время нахождения крысы в закрытых рукавах и увеличивается время нахождения в открытых рукавах лабиринта. Это позволяет сделать вывод о выраженном анксиолитическом действии синтезированных соединений.
3. Данные, полученные в ходе фармакологического исследования, подтверждают обоснованность целенаправленного поиска БАВ, обладающих анксиолитической активностью в ряду 2-стирилпроизводных 4-оксопиримидина.
Рецензенты:
Попова О.И., д.фарм.н., профессор кафедры фармакогнозии, Пятигорский медико-фармацевтический институт – филиал ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск;
Погребняк А.В., д.х.н., к.фарм.н., доцент кафедры физической и коллоидной химии, Пятигорский медико-фармацевтический институт – филиал ГБОУ ВПО ВолгГМУ Минздрава России, г. Пятигорск.
Работа поступила в редакцию 28.07.2014.
Библиографическая ссылка
Жогло Е.Н., Кодониди И.П., Оганесян Э.Т., Воронков А.В., Дьякова И.Н., Бандура А.Ф., Сочнев В.С., Смирнова Л.П., Ивченко А.В. СИНТЕЗ И АНКСИОЛИТИЧЕСКАЯ АКТИВНОСТЬ 2-СТИРИЛПРОИЗВОДНЫХ 4-ОКСОПИРИМИДИНА // Фундаментальные исследования. 2014. № 8-6. С. 1413-1417;URL: https://fundamental-research.ru/ru/article/view?id=34778 (дата обращения: 21.01.2026).