Рак молочной железы (РМЖ) является распространенной патологией среди женщин во всем мире, поэтому предпринимаются попытки поиска новых методов неоадъювантной терапии, направленных на элиминацию метастазов из региональных лимфатических узлов, в том числе и с использованием веществ, активирующих клетки иммунной системы [3–5]. Известно, что препараты нуклеиновых кислот, применяемые в терапии пациентов с онкологической патологией, способствуют активации как факторов неспецифической защиты организма (нейтрофилы, макрофаги, натуральные киллерные клетки), так и факторов специфической защиты организма (Т- и В-лимфоциты, дендритные клетки).
Поэтому целью исследования стало изучение влияния полихимиотерапии на уровни продукции биологически активных веществ на фоне лечения фрагментированной ДНК из плаценты человека у крыс линии Wistar с РМЖ, индуцированными введением метилнитрозомочевины.
Материалы и методы исследования
Эксперименты на лабораторных животных проведены в соответствии с «Правилами работ с использованием экспериментальных животных» (Приложение к приказу Министерства здравоохранения СССР от 12.08.1977 г. № 755) и с соблюдением принципов Хельсинкской декларации BMA (2000). Эксперимент выполнен на 25 крысах-самках линии Wistar с массой 300–350 г. Животные содержались на стандартной лабораторной диете и имели свободный доступ к воде. РМЖ у 21 крысы линии Wistar индуцировали введением N-метил-N-нитрозомочевины (Sigma-Aldrich, США) 5 раз с интервалом в 7 дней подкожно в область одной и той же молочной железы (2-я молочная железа справа) [6]. Было сформировано 6 групп животных: 1-я группа – интактные особи (n = 4); 2-я группа – животным проведено только оперативное удаление пораженной молочной железы (n = 3); 3-я группа – животным проведено оперативное удаление пораженной молочной железы, подключена полихимиотерапия и введение фрагментированной ДНК (n = 5); 4-я группа – животным проведено оперативное удаление опухоли и проводилась полихимиотерапия (n = 5); 5-я группа – животным не удалялась опухоль молочной железы, но проводилась полихимиотерапия (n = 4). 6-ю группу составили животные, которым индуцировали РМЖ (опухоленосители), но не проводилось хирургическое вмешательство и полихимиотерапия (n = 4). Курс полихимиотерапии (ПХТ) включал в себя: 5-фторурацил (Ebewe, Австрия) из расчета 15 мг/кг внутрибрюшинно на 1 и 8 день курса терапии; метотрексат (Ebewe, Австрия) из расчета 2,5 мг/кг внутрибрюшинно на 1 и 8 день курса терапии; циклофосфан (ОАО «Биохимия», Саранск) из расчета 3 мг/кг внутрибрюшинно ежедневно однократно 14 дней. Курс терапии фрагментированной ДНК (5 мг/кг) проводили внутрибрюшинным введением однократно в течение 14 дней через 3 часа после введения циклофосфана. В экспериментах использовали субстанцию препарата Панаген с содержанием фрагментированной ДНК 1,7 мг/мл. Препарат Панаген (ЛСР № 004429/08 от 09.06.08) представляет собой фрагментированный нуклеопротеидный комплекс, выделенный из плаценты человека. Оперативное лечение проводили через 6 месяцев от момента индукции РМЖ. Животных из эксперимента выводили через 6 месяцев под наркозом (40 мг/кг нембутана внутрибрюшинно; Sigma-Aldrich, США), что обусловливалось необходимостью прижизненного сбора лимфы из грудного лимфатического протока. Ядросодержащие клетки костного мозга (КМ) получали при помощи перфузии бедренных костей лабораторных животных [2]. Мультипотентные мезенхимальные стромальные клетки (ММСК) от линии крыс Wistar (n = 5) получали из клеток КМ. Ядросодержащие клетки КМ ресуспендировали в среде DMEM (Биолот, СПб) и пропускали через фильтр (размер пор 80 мкм) для удаления клеточного дебриса, подсчитывали количество жизнеспособных клеток. Для получения КМ-ММСК ядросодержащие клетки КМ инкубировали в пластиковых флаконах (TPP, Швейцария) в среде DMEM (Биолот, СПб), дополненной 100 мкг/мл гентамицина сульфата (Дальхимфарм, Хабаровск), 2 мM L-глютамина (ICN, США) и 15 % FCS при 37 °С в атмосфере 5 % СО2. Через 48 часов неприкрепленные к пластику клетки удаляли, а прилипающую фракцию клеток культивировали до получения конфлюэнтного слоя. Снятие КМ-ММСК при пассировании осуществляли с использованием 0,25 % раствора трипсина/0,02 % раствора ЭДТА (ICN, США). Суспензию спленоцитов получали измельчением селезенок от лабораторных животных [2]. Мононуклеарные клетки (МНК) из лимфы получали осаждением при 1500 об/мин в течение 5 минут с последующей 2-кратной отмывкой в забуференном физиологическом растворе. Через 72 часа надосадочная жидкость от клеток КМ, спленоцитов и МНК снималась, разливалась по аликвотам и хранилась при –70 °С до момента использования в работе. В кондиционной среде определяли содержание IL-1β, TNF-α, TGF-β1 с использованием коммерческих наборов для иммуноферментного анализа (eBioscience, Австрия). Статистическую обработку данных проводили с использованием программы Statistica 6.0, меры центральной тенденции и рассеяния описаны медианой (Ме), нижним (Lq) и верхним (Hq) квартилями; достоверность различия рассчитывалась по U-критерию Манна – Уитни, и принималась при значениях p < 0,05 [1].
Результаты исследования и их обсуждение
Известно, что опухолевые клетки способны синтезировать и продуцировать широкий спектр биологически активных веществ, направленных на поддержание пролиферации и миграции опухолевых клеток из очага роста в близлежащие ткани и органы. С другой стороны, продуцируемые биоактивные вещества привлекают в зону роста опухолевой ткани не только клетки лимфоидной системы, которые, утрачивая цитотоксический потенциал, приобретают функцию по поддержанию роста опухолевой ткани и проявляют иммуносупрессорную активность, но и стволовые/прогениторные клетки, необходимые для формирования сосудистой системы и стромы, необходимой для благоприятного роста опухоли [7]. Исходя из этого, нами был исследован спектр биоактивных веществ, обладающих провоспалительной активностью (IL-1β, TNF-α), и веществ, способных проявлять иммуносупрессорное влияние на клетки иммунной системы организма (TGF-β1).
Нами не выявлено статистически значимых различий по уровню спонтанной продукции TNF-α МНК в исследуемых группах животных (рис. 1).
В то же время показано статистически значимое увеличение продукции TNF-α при стимуляции МНК митогеном в контрольной группе РМЖ по сравнению с группой животных, подвергшихся оперативному вмешательству, и в группе, получавшей дополнительно к оперативному вмешательству ПХТ (p < 0,05). В то же время уровни спонтанной и митоген-стимулированной продукции TNF-α клетками КМ в группах животных, получавших только ПХТ или же комбинацию ПХТ с оперативным вмешательством по поводу РМЖ, были статистически значимо меньше, нежели в остальных группах животных (p < 0,05). Что же касается уровней продукции TNF-α спленоцитами, то показано статистически значимое снижение уровней спонтанной продукции TNF-α спленоцитами в группе животных, получавших оперативное вмешательство с ПХТ, а также в группе с дополнительной терапией фрагментированной ДНК (p < 0,05). По уровню митоген-стимулированной продукции TNF-α спленоцитами контрольная группа РМЖ отличалась статистически значимо большими уровнями продукции по сравнению с другими группами животных (p < 0,05).
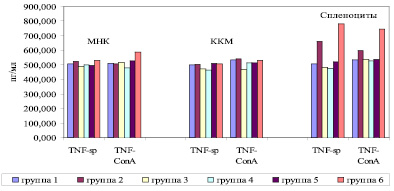
Рис. 1. Уровни продукции TNF-α мононуклеарными клетками грудного протока крыс-самок линии Wistar (Me). МНК – мононуклеарные клетки из лимфы грудного протока; ККМ – ядросодержащие клетки костного мозга из бедренных костей; Sp – уровни спонтанной продукции цитокинов, ConA – уровни стимулированной Конканавалином (10 мкг/мл) продукции цитокинов. На оси абсцисс – исследуемые цитокины; на оси ординат – уровни цитокинов
Как видно из рис. 2, по уровню спонтанной и митоген-стимулированной продукции МНК IL-1β в группе контроля РМЖ отмечено статистически значимое увеличение ее в сравнении с уровнями продукции в группе, подвергшейся оперативному вмешательству, а также в группах, получавших ПХТ с экзогенной ДНК или без экзогенной ДНК (p < 0,05).
Кроме этого, отмечено статистически значимое увеличение уровней продукции IL-1β при стимуляции МНК митогеном в группе, подвергшейся оперативному вмешательству, по сравнению с группой, получавшей терапию фрагментированной ДНК (p < 0,05). В группе животных, подвергшихся оперативному вмешательству с последующей ПХТ и лечением фрагментированной ДНК, отмечено статистически значимое уменьшение уровней продукции как спонтанной, так и митоген-стимулированной IL-1β по сравнению с другими группами животных (p < 0,05). Что касается уровней продукции IL-1β клетками КМ, то показано, что уровни спонтанной и митоген-стимулированной продукции IL-1β в группах животных, получавших только ПХТ или же комбинацию ПХТ с оперативным вмешательством по поводу РМЖ, были статистически значимо меньше, нежели в остальных группах животных (p < 0,05). Показаны статистически значимые меньшие уровни продукции спленоцитами, как спонтанной, так и митоген-стимулированной, IL-1β по сравнению с другими группами животных (p < 0,05) в группе животных, подвергшихся оперативному вмешательству с последующей ПХТ и лечением фрагментированной ДНК.
Как видно из рис. 3, установлено статистически значимое снижение уровней продукции TGF-β1 МНК в группе, получавшей только ПХТ, по сравнению с группой, подвергшейся оперативному вмешательству с ПХТ или без ПХТ (p < 0,05).
В отношении уровней спонтанной продукции TGF-β1 клетками КМ отмечено статистически значимое снижение уровней продукции в группах, получавших только ПХТ, ПХТ и оперативное вмешательство, а также в контрольной группе РМЖ по сравнению с остальными группами животных (p < 0,05). По уровням продукции TGF-β1 клетками КМ контрольная группа животных по РМЖ и группа, получавшая ПХТ после оперативного вмешательства, статистически значимо меньше продуцировали уровни TGF-β1 на митогенный стимул по сравнению с остальными группами животных (p < 0,05). В отношении уровней продукции TGF-β1 спленоцитами установлено, что статистически значимо меньшие уровни спонтанной продукции характерны для группы животных, получавших ПХТ после оперативного вмешательства по сравнению с другими группами животных (p < 0,05). В группах животных, получавших ПХТ, комбинацию оперативного лечения с ПХТ и с фрагментированной ДНК или без фрагментированной ДНК, уровни продукции TGF-β1 спленоцитами в ответ на митогенный стимул были статистически значимо меньше, нежели в других группах животных (p < 0,05).
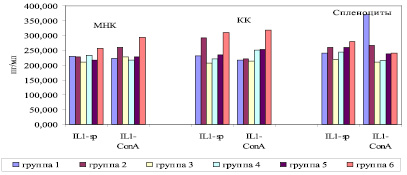
Рис. 2. Уровни продукции IL-1β клетками костного мозга крыс-самок линии Wistar (Me). МНК – мононуклеарные клетки из лимфы грудного протока; ККМ – ядросодержащие клетки костного мозга из бедренных костей; Sp – уровни спонтанной продукции цитокинов, ConA – уровни стимулированной Конканавалином (10 мкг/мл) продукции цитокинов. На оси абсцисс – исследуемые цитокины; на оси ординат – уровни цитокинов
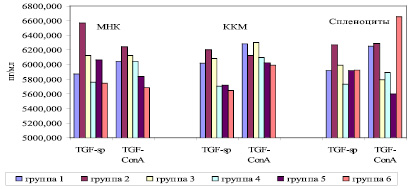
Рис. 3. Уровни продукции TGF-β1 спленоцитами крыс-самок линии Wistar (Me). МНК – мононуклеарные клетки из лимфы грудного протока; ККМ – ядросодержащие клетки костного мозга из бедренных костей; Sp – уровни спонтанной продукции цитокинов, ConA – уровни стимулированной Конканавалином (10 мкг/мл) продукции цитокинов. На оси абсцисс – исследуемые цитокины; на оси ординат – уровни цитокинов
Анализ сопряженности уровней продукции цитокинов с пролиферативной активностью МНК из лимфы грудного протока выявил ее наличие для группы животных РМЖ, получивших оперативное лечение, ПХТ и дополнительно введение фрагментированной ДНК. Так, между уровнем спонтанной пролиферации МНК и уровнями спонтанной и митоген-стимулированной продукции TNF-α МНК имеется прямая, сильная и высокая зависимость (r = 0,97; p = 0,005 и r = 0,9; p = 0,037 соответственно). Кроме этого, выявленная прямая, сильная и высокая сопряженность между митоген-стимулированной пролиферацией МНК и уровнями митоген-стимулированной продукции МНК TGF-β1 (r = 0,9; p = 0,037). Также нами установлено наличие прямой, сильной и высокой взаимосвязи между митоген-стимулированной пролиферацией клеток КМ и уровнями митоген-стимулированной продукции клетками КМ TNF-α (r = 0,89; p = 0,042).
Таким образом, в группе животных РМЖ, получавших терапию фрагментированной ДНК, выявлена тенденция к снижению спонтанной продукции провоспалительных цитокинов (TNF-α, IL-1β) клетками кроветворения и лимфоидной тканью и увеличение уровней спонтанной продукции иммуносупрессорного фактора (TGF-β1) мононуклеарными клетками из лимфы грудного протока, что может свидетельствовать о выраженной иммуносупресии в данной группе животных.
Дополнительно нами исследован эффект кондиционной среды от клеток РМЖ на пролиферативный потенциал КМ-ММСК интактных животных. Так, наличие кондиционной среды от клеток РМЖ (50 % от общего объема питательной среды) приводило к статистически значимому увеличению пролиферативной активности КМ-ММСК на 31–74 % от исходного уровня пролиферации (p < 0,05). Полученные данные подтверждают способность клеток опухолей к продукции биоактивных веществ, способных через паракринный механизм оказывать влияние на функциональную активность окружающих опухолевую ткань клеток. Более того, это указывает также и на возможность активации процессов формирования кровеносной системы и стромы, необходимой для поддержания жизнеспособности вновь образующихся опухолевых клеток.
Получены новые данные о функциональной активности мононуклеаров лимфы грудного протока, спленоцитов, ядросодержащих клеток костного мозга (пролиферативный потенциал, цитокинпродуцирующая активность), которые также указывают на разнонаправленное влияние фрагментированной ДНК. Так, под влиянием фрагментированной ДНК отмечено снижение пролиферативного потенциала клеток КМ и спленоцитов по сравнению с контрольной группой животных по РМЖ. По уровням продукции провоспалительных цитокинов мононуклеарами лимфы и клетками КМ животные, получавшие терапию фрагментированной ДНК, отличались от группы сравнения по РМЖ в сторону ее снижения. Это указывает на выраженное подавление «иммуносупрессивного эффекта» данных цитокинов на процессы гемопоэза, с одной стороны, а с другой стороны, на недостаточность начальной фазы иммунного ответа. Более того, подтверждением высокой иммуносупрессии на фоне терапии фрагментированной ДНК свидетельствуют и повышенные уровни продукции TGF-β1.
Также, полученные нами данные о снижении уровней продукции цитокинов на фоне адъювантной терапии у крыс с РМЖ согласуются с результатами других исследователей [8–10]. Так, [9] отмечено резкое снижение уровней продукции спленоцитами на фоне терапии циклофосфамидом TNF-α , IFN-γ и сохранность уровней продукции IL-10. В работе [8] указывается на угнетение уровней продукции CD4 Т-клетками селезенки провоспалительных цитокинов (TNF-α, IFN-γ, IL-2) и тем самым смещения баланса Th1/ Th2 цитокинов в сторону Th2. Исследования [10] акцентируют внимание на угнетении терапией мышей с опухолью уровней продукции спленоцитами IFN-γ, IL-4, TGF-β1.
Заключение
Следовательно, исходя из изложенного, становится очевидным факт, что на фоне неоадъювантной терапии отмечается подавление цитокинпродуцирующей активности клетками гемо- и лимфопоэза на фоне полихимиотерапии.
Выражаем благодарность за техническую и организационную помощь в проведении экспериментов Алямкиной Е.А., Долговой Е.В., Рогачеву В.А. и Богачеву С.С., сотрудникам ИЦИГа.
Рецензенты:
Бгатова Н.П., д.б.н., зав. лабораторией ультраструктурных исследований, ФГБУ «НИИКЭЛ» СО РАМН, г. Новосибирск;
Горчаков В.Н., д.м.н., зав. лабораторией функциональной морфологии лимфатической системы, ФГБУ «НИИКЭЛ» СО РАМН, г. Новосибирск.
Работа поступила в редакцию 04.06.2014.
Библиографическая ссылка
Лыков А.П., Бондаренко Н.А., Повещенко О.В., Кабаков А.В., Райтер Т.В., Казаков О.В., Стрункин Д.Н., Шурлыгина А.В., Повещенко А.Ф., Коненков В.И. ВЛИЯНИЕ ЭКЗОГЕННОЙ ДНК НА ЦИТОКИНПРОДУЦИРУЮЩУЮ АКТИВНОСТЬ КЛЕТОК ГЕМО- И ЛИМФОПОЭЗА ПРИ ЭКСПЕРИМЕНТАЛЬНОМ РАКЕ МОЛОЧНОЙ ЖЕЛЕЗЫ У КРЫС ЛИНИИ WISTAR // Фундаментальные исследования. 2014. № 8-4. С. 871-876;URL: https://fundamental-research.ru/ru/article/view?id=34686 (дата обращения: 01.02.2026).



